心脏舒张功能障碍是一种老年人群中常见的心血管疾病。研究表明,心脏舒张功能障碍的发生率随着年龄的增长而增加,约有40%的人口(45岁或以上)有不同程度的舒张功能[1-3]。有研究显示,心肌肌浆网Ca2+-ATP酶(sarcoplasmic reticulum Ca2+ ATPase,SERCA2a)在老年心脏中表达降低,其与心脏功能的下降关系密切[4-5],而组蛋白修饰参与了编码SERCA2a的Atp2a2基因的表达调控[6]。表没食子儿茶素没食子酸酯[(-)-epigallo-catechin-3-gallate,EGCG]是一种源于绿茶和一些钩藤类植物提取物的多酚类物质,作为儿茶素中生物活性最强的成分,具有抗氧化、抗自由基、诱导细胞凋亡等作用[7];同时,有研究发现EGCG可直接作用于心肌肌丝系统,有效改善患有舒张功能障碍的限制型心肌病小鼠的舒张功能[8]。有研究报道,EGCG具有表观遗传调控作用,如抑制DNA甲基化转移酶,并且可以通过抑制Ⅰ类组蛋白去乙酰化酶(histone deacetylase,HDACs)参与基因的表达和调控[9-10];我们前期研究发现,老年小鼠心脏SERCA2a的表达下降,其基因启动子区组蛋白AcH3K9水平降低,而HDAC1表达和结合水平升高,提示由HDAC1介导的组蛋白H3K9低乙酰化可能参与了老年小鼠心脏SERCA2a的低表达;为验证这一科学假说,本研究利用EGCG可以抑制Ⅰ类组蛋白去乙酰化酶这一作用来干预老年小鼠,以期证实EGCG可以通过抑制HDAC1参与与舒张功能障碍关系密切的老年心脏SERCA2a的表达;通过探讨其具体作用机制,为老年相关的心脏舒张功能障碍的改善提供新的思路。
1 材料与方法 1.1 材料 1.1.1 实验动物的选择及分组8只3月龄的健康SPF级雄性C57BL/6小鼠及24只16月龄健康SPF级雄性C57 BL/6小鼠,体质量(21±2)g,均购于重庆医科大学实验动物中心。24只16月龄老年小鼠随机数字表法分成EGCG+老年组、DMSO+老年组以及未处理的老年组,每组8只;EGCG+老年组给予EGCG[50 mg/(kg·d )]腹腔注射,老年+DMSO组给予DMSO(与溶解EGCG剂量一致)腹腔注射,未处理的老年组不给予任何干预;并以3月龄成年小鼠作为青年组(n=8)。干预8周后,二氧化碳麻醉处死小鼠,分离各组小鼠心脏,预冷PBS清洗后置于-80 ℃保存备用。
1.1.2 主要试剂及仪器EGCG(纯度99%,Selleck,美国),抗SERCA2a抗体(Abcam,英国),β-actin抗体(中杉金桥,北京),染色质免疫共沉淀(ChIP)试剂盒(Abcam,英国),ChIP级抗HDAC1抗体、抗AcH3K9抗体、抗GATA4抗体、抗Mef 2c抗体(Abcam,英国),SYBR Green试剂盒(KAPA,美国),高纯度总RNA 提取试剂盒(BioTeke,北京),逆转录试剂盒(Takara,日本),全蛋白提取试剂盒(KeyGEN,南京),SDS-PAGE配胶试剂盒(Beyotime,上海),超声破碎仪(Diagenode,比利时),荧光定量PCR仪(Bio-Rad,美国)。
1.2 方法 1.2.1 总RNA提取及RT-PCR提取左心室心肌组织总RNA,采用核酸蛋白测定仪测定D(260)/D(280)比值确定总RNA浓度,以800 ng RNA按照Takara逆转录试剂盒操作说明将RNA逆转录为cDNA,并于-20 ℃保存。运用Primer Premier 5.0软件针对Atp2a2及HDAC1基因CDS核心编码区设计特异性引物,由上海生工生物工程股份有限公司合成。Atp2a2基因引物序列:上游5′-TCGACCAGTCAATTCTTACAGG-3′,下游5′ - CAGGGACAGGGTCAGTATGC-3′,内参基因β-actin引物序列:上游5′-CACACCCGCCACCAGTTCG-3′,下游5′-GTCCTTCTGACCCATTCCCACC-3′。HDAC1基因引物序列:上游5′-ATGAGCTGCCCTACAACGAC-3′,下游5′-GACGCTGCTTGATCTTCTCC-3′。反应条件:95 ℃预变性2 min,95 ℃变性10 s,60 ℃退火30 s,40个循环。所得的实验数据采用Bio-Rad CFX96荧光定量PCR仪自带的基于pfaffl原理的相对定量数据分析软件进行分析。
1.2.2 Western blot提取左心室心肌组织全蛋白,10%SDS-PAGE凝胶分离蛋白,PVDF膜转膜后,5%脱脂牛奶封闭1 h,分别加入抗SERCA2a抗体(1 :1 000)及内参蛋白抗β-actin抗体(1 :2 000),4 ℃孵育14~16 h,TBST洗膜3次,每次10 min;然后加入HRP标记的山羊抗小鼠二抗(1 :5 000),在脱色摇床上室温孵育2 h,TBST洗膜3次,每次10 min。加入显色剂后,运用Bio-Rad图像分析仪进行图像扫描,采用Quantity One4.4软件进行灰度值分析,以SERCA2a与β-actin灰度值之比表示SERCA2a的相对表达量。
1.2.3 染色质免疫共沉淀(ChIP)取左心室心肌组织,眼科剪剪碎,用预冷PBS清洗3次后加入终浓度1%的甲醛交联。用超声破碎仪切割DNA,使DNA片段长度在200~1 000 bp之间。分别用ChIP级抗HDAC1抗体、抗AcH3K9抗体、抗GATA4抗体、抗MEF2c抗体进行染色质免疫共沉淀,收集并纯化DNA后,冻存于-20℃备用。
1.2.4 ChIP-Q-PCR选取Atp2a2基因外显子5′端前1 000 bp序列,运用Primer Premier5.0软件,针对该序列设计特异性引物,由上海生工生物工程股份有限公司合成。Atp2a2基因启动子区引物序列:上游5′-AGCCAAGGACACCAGTGC-3′,下游5′-GGGATAGAGC-GCGGAGTT-3′。反应条件:95 ℃预变性2 min,95 ℃变性10 s,63 ℃退火15 s,68 ℃延伸20 s,45个循环。所得的实验数据采用Bio-Rad CFX96荧光定量PCR仪自带的基于pfaffl原理的相对定量数据分析软件分析。
1.3 统计学分析所有的实验数据均采用SPSS 22.0统计软件进行统计学分析,数据用x±s表示,组间比较采用单因素方差分析。
2 结果 2.1 EGCG升高老年小鼠心脏Atp2a2基因mRNA的表达RT-PCR结果显示,老年小鼠心脏Atp2a2基因在mRNA水平的表达降低,与青年组比较,差异具有统计学意义(P<0.05);EGCG升高了老年小鼠心脏Atp2a2 基因在mRNA水平的表达(P<0.05)。EGCG +老年组与青年组比较,差异无统计学意义。见图 1。
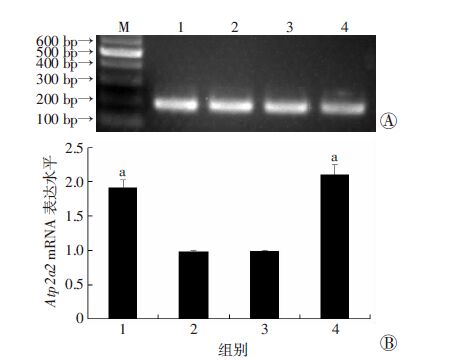
|
| M:Marker标准;1:青年组:2:老年组;3:DMSO+老年组;4:EGCG +老年组 A:RT-PCR结果;B :定量分析结果 a: P<0.05,与老年组比较(n=8, x±s) 图 1 RT-PCR检测心肌组织Atp2a2基因mRNA的表达水平 |
2.2 EGCG升高老年小鼠心脏SERCA2a的表达
Western blot结果表明,老年小鼠心脏SERCA2a的表达下降,与青年组相比,差异具有显著性(P<0.05);EGCG上调并逆转了老年小鼠心脏SERCA2a的表达(P<0.05)。EGCG +老年组与青年组比较,无显著性差异。见图 2。
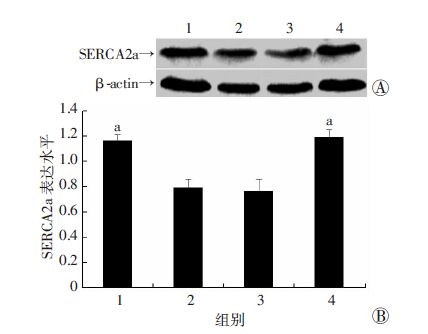
|
| 1:青年组:2:老年组;3:DMSO+老年组;4:EGCG +老年组 A:Western blot结果;B:定量分析结果 a: P<0.05,与老年组比较(n=8, x±s) 图 2 Western blot检测心肌组织SERCA2a的表达水平 |
2.3 EGCG抑制组蛋白去乙酰化酶HDAC1的mRNA表达及在Atp2a2基因启动子区的结合
经RT-PCR检测,老年小鼠心脏HDAC1的mRNA表达水平升高(P<0.05);ChIP-Q-PCR结果表明,老年小鼠心脏Atp2a2基因启动子区HDAC1的结合量升高(P<0.05),EGCG干预后,老年小鼠心脏HDAC1 mRNA的表达及其在Atp2a2基因启动子区的结合下降 (P<0.05)。见图 3,4。
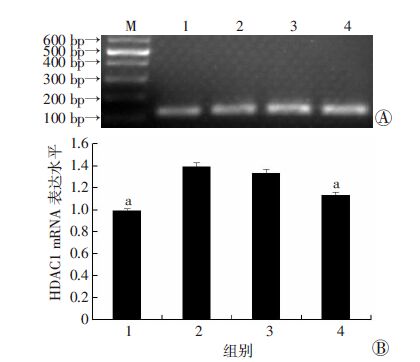
|
| M:Marker标准;1:青年组:2:老年组;3:DMSO+老年组;4:EGCG +老年组 A:RT-PCR结果;B :定量分析结果 a: P<0.05,与老年组比较(n=8, x±s) 图 3 RT-PCR检测心肌组织HDAC1基因mRNA的表达水平 |
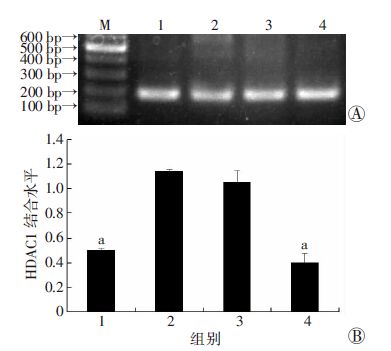
|
| M:Marker标准;1:青年组:2:老年组;3:DMSO+老年组;4:EGCG +老年 A:琼脂糖电泳结果;B :定量分析结果 a: P<0.05,与老年组比较(n=8,x±s) 图 4 ChIP-Q-PCR检测心肌组织Atp2a2基因启动子区 HDAC1的结合水平 |
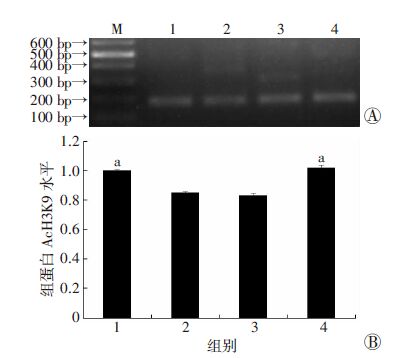
2.4 EGCG升高老年小鼠心脏Atp2a2基因启动子区组蛋白AcH3K9水平
ChIP-Q-PCR结果显示,老年小鼠心脏Atp2a2基因启动子区组蛋白AcH3K9水平明显降低(P<0.05),EGCG升高了老年小鼠心脏Atp2a2基因启动子区组蛋白AcH3K9水平(P<0.05)。见图 5。
|
| M:Marker标准;1:青年组:2:老年组;3:DMSO+老年组;4:EGCG +老年组 A:琼脂糖电泳结果;B :定量分析结果 a: P<0.05,与老年组比较(n=8,x±s) 图 5 ChIP-Q-PCR检测心肌组织Atp2a2基因启动子区组 蛋白AcH3K9水平 |
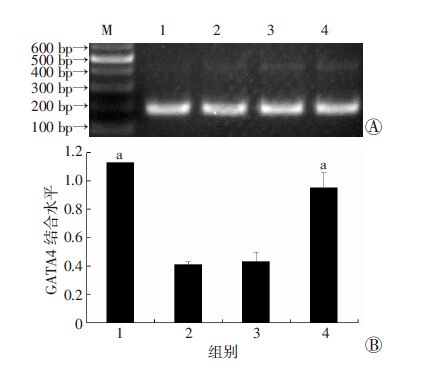
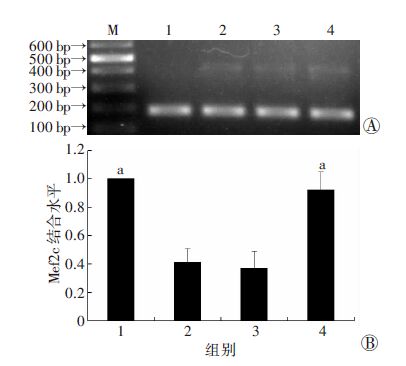
2.5 EGCG增加核心转录因子GATA4、Mef2c在Atp2a2基因启动子区的结合
ChIP-Q-PCR结果显示,老年小鼠心脏Atp2a2基因启动子区GATA4、Mef2c的结合量降低(均P<0.05),EGCG增加了GATA4、Mef2c在老年小鼠心脏Atp2a2基因启动子区的结合量(均P<0.05)。见图 6,7。
|
| M:Marker标准;1:青年组:2:老年组;3:DMSO+老年组;4:EGCG +老年组 A:琼脂糖电泳结果;B :定量分析结果 a: P<0.05,与老年组比较(n=8,x±s) 图 6 ChIP-Q-PCR检测心肌组织Atp2a2基因启动子区 GATA4的结合水平 |
|
| M:Marker标准;1:青年组:2:老年组;3:DMSO+老年组;4:EGCG +老年组 A:琼脂糖电泳结果;B :定量分析结果 a: P<0.05,与老年组比较(n=8, x±s) 图 7 ChIP-Q-PCR检测心肌组织Atp2a2基因启动子区 Mef2c的结合水平 |
3 讨论
心力衰竭目前已成为一个全球性的公共卫生健康问题,其主要分为心室射血功能下降的收缩性心力衰竭以及心室舒张期充盈能力下降而射血分数正常的舒张性心力衰竭;然而老年相关的心脏衰老通常与舒张性心力衰竭有关[11],这种心力衰竭又称为保留射血分数的心力衰竭(heart failure with preserved ejection fraction,HFpEF)[12]。据有关报道,美国约500万例心力衰竭患者中,约有一半的患者被诊断患有HFpEF,且超过90%的HFpEF患者年龄超过60岁[13-14]。大量的临床药物试验表明,治疗收缩性心力衰竭的标准化治疗方案对于舒张性心力衰竭的疗效欠佳[15-16]。目前有关老年相关的舒张功能障碍的发生机制尚不清楚,更好地认识其发生的分子基础,可以为开发新的治疗措施提供新的思路。
EGCG作为儿茶素中生物活性最强的物质,具有抗氧化、抗自由基、诱导细胞凋亡等作用[7];同时,有研究发现,EGCG可以有效改善患有舒张功能障碍的限制型心肌病小鼠的舒张功能[8]。有研究报道,EGCG具有表观遗传调控作用,如抑制DNA甲基化转移酶,并且可以通过抑制Ⅰ类组蛋白去乙酰化酶(histone deacetylase,HDACs)参与基因的表达和调控[9-10]。组蛋白乙酰化修饰作为表观遗传的主要调控方式,由动态平衡的组蛋白去乙酰化酶和乙酰化酶共同介导,组蛋白去乙酰化酶可使染色质的空间结构变得紧密,不利于基因表达[17],如Ⅰ类组蛋白去乙酰化酶可以抑制抗肥厚基因Inpp5f,KLF4的表达[18],同时,心脏转录因子GATA4及Mef2c也在基因表达调控中起着重要作用[19]。因此,降低组蛋白去乙酰化酶的水平可能有助于基因的转录和翻译。心肌肌浆网Ca2+-ATP酶SERCA2a是心脏重要的功能蛋白,在心功能的维持和调节中起着重要作用。研究表明,老年心脏的功能下降与SERCA2a在老年心脏中的表达下降有密切关系[4-5]。我们前期研究发现,老年小鼠心脏SERCA2a 的表达下降,编码SERCA2a的Atp2a2基因启动子区存在组蛋白乙酰化修饰作用,提示组蛋白乙酰化修饰可能参与了老年小鼠心脏SERCA2a的表达调控。本研究发现,老年小鼠心脏HDAC1的mRNA表达水平升高;同时,ChIP-Q-PCR结果表明,HDAC1在老年小鼠心脏Atp2a2基因启动子区的结合水平也升高,组蛋白AcH3K9水平降低,GATA4以及Mef2c的结合水平降低;通过RT-PCR和Western blot检测,老年小鼠心脏SERCA2a在mRNA和蛋白水平表达同时降低,这表明由HDAC1介导的基因启动子区低乙酰化修饰状态可能在老年小鼠心脏SERCA2a的表达降低中起着关键性作用。EGCG干预结果表明,EGCG可以抑制HDAC1 mRNA的表达及其在Atp2a2基因启动子区的结合,提高组蛋白AcH3K9水平,同时增加GATA4和Mef2c的结合量,进而升高并逆转SERCA2a在mRNA和蛋白水平的表达,参与SERCA2a的调控。由此可见,老年小鼠心脏SERCA2a表达降低可能是由HDAC1介导的基因启动子区组蛋白H3K9低乙酰化水平引起的,而EGCG可以通过抑制HDAC1的表达和结合,上调基因启动子区的组蛋白AcH3K9水平升高并参与老年小鼠心脏SERCA2a的表达。
综上所述,由HDAC1介导的组蛋白H3K9低乙酰化可能是老年心脏SERCA2a表达降低的关键机制之一,而过去的研究主要是通过基因治疗的方式来提高SERCA2a的表达量,具有一定的难度和风险性;本研究首次通过绿茶提取物活性成分EGCG作为干预方式通过组蛋白乙酰化修饰作用改善老年相关的SERCA2a的表达,为老年相关的舒张功能障碍的治疗提供了新的治疗靶点。
| [1] | Redfield M M, Jacobsen S J, Jr J C B, et al. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic[J]. JAMA,2003, 289 (2) : 194 –202. DOI:10.1001/jama.289.2.194 |
| [2] | Kane G C, Karon B L, Mahoney D W, et al. Progression of Left Ventricular Diastolic Dysfunction and Risk of Heart Failure[J]. Jama,2011, 306 (8) : 856 –863. DOI:10.1001/jama.2011.1201 |
| [3] | Roger V L, Weston S A, Redfield M M, et al. Trends in heart failure incidence and survival in a community-based population[J]. JAMA,2004, 292 (3) : 344 –50. DOI:10.1001/jama.292.3.344 |
| [4] | Jiao Q, Takeshima H, Ishikawa Y, et al. Sarcalumenin plays a critical role in age-related cardiac dysfunction due to decreases in SERCA2a expression and activity[J]. Cell Calcium,2012, 51 (1) : 31 –39. DOI:10.1016/j.ceca.2011.10.003 |
| [5] | Qin F, Siwik D A, Lancel S, et al. Hydrogen peroxide-mediated SERCA cysteine 674 oxidation contributes to impaired cardiac myocyte relaxation in senescent mouse heart[J]. J Am Heart Assoc,2013, 2 (4) : e000184 . DOI:10.1161/JAHA.113.000184 |
| [6] | Angrisano T, Schiattarella GG, Keller S, et al. Epigenetic switch at atp2a2 and myh7 gene promoters in pressure overload-induced heart failure[J]. PLoS ONE,2014, 9 (9) : e106024 . DOI:10.1371/journal.pone.0106024 |
| [7] | Yang C S, Landau J M, Huang M T, et al. Inhibition of carcinogenesis by dietary polyphenolic compounds[J]. Annu Rev Nutr,2001, 21 : 381 –406. DOI:10.1146/annurev.nutr.21.1.381 |
| [8] | Gupta S. Green tea polyphenols increase p53 transcriptional activity and acetylation by suppressing class Ⅰ histone deacetylases. International Journal of Oncology, 2012. DOI: 10.3892/ijo.2012.1449 |
| [9] | Nandakumar V, Vaid M, Katiyar SK. (-)-Epigallocatechin-3-gallate reactivates silenced tumor suppressor genes, Cip1/p21 and p16INK4a, by reducing DNA methylation and increasing histones acetylation in human skin cancer cells[J]. Carcinogenesis,2011, 32 (4) : 537 –544. DOI:10.1093/carcin/bgq285 |
| [10] | Zhang L, Nan C, Chen Y, et al. Calcium desensitizer catechin reverses diastolic dysfunction in mice with restrictive cardiomyopathy[J]. Arch Biochem Biophys,2015, 573 : 69 –76. DOI:10.1016/j.abb.2015.03.015 |
| [11] | Crendal E, Dutheil F, Naughton G, et al. Increased myocardial dysfunction, dyssynchrony, and epicardial fat across the lifespan in healthy males[J]. BMC Cardiovasc Disord,2014, 14 : 95 . DOI:10.1186/1471-2261-14-95 |
| [12] | Sharma K, Kass DA. Heart failure with preserved ejection fraction: mechanisms, clinical features, and therapies[J]. Circ Res,2014, 115 (1) : 79 –96. DOI:10.1161/CIRCRESAHA.115.302922 |
| [13] | Borlaug B A, Paulus W J. Heart failure with preserved ejection fraction: pathophysiology, diagnosis, and treatment[J]. Eur Heart J,2011, 32 (6) : 670 –679. DOI:10.1093/eurheartj/ehq426 |
| [14] | Scantlebury D C, Borlaug B A. Why are women more likely than men to develop heart failure with preserved ejection fraction[J]. Curr Opin Cardiol,2011, 26 (6) : 562 –568. DOI:10.1097/HCO.0b013e32834b7faf |
| [15] | Bhatia R S, Tu J V, Lee D S, et al. Outcome of heart failure with preserved ejection fraction in a population-based study[J]. N Engl J Med,2006, 355 (3) : 260 –269. DOI:10.1056/NEJMoa051530 |
| [16] | Pitt B, Pfeffer M A, Assmann S F, et al. Spironolactone for heart failure with preserved ejection fraction[J]. N Engl J Med,2014, 370 (15) : 1383 –1392. DOI:10.1056/NEJMoa1313731 |
| [17] | Pan B, Zhu J, Lv T, et al. Alcohol consumption during gestation causes histone3 lysine9 hyperacetylation and an alternation of expression of heart development-related genes in mice[J]. Alcohol Clin Exp Res,2014, 38 (9) : 2396 –2402. DOI:10.1111/acer.12518 |
| [18] | Di Lisi R, Millino C, Calabria E, et al. Combinatorial cis-acting elements control tissue-specific activation of the cardiac troponin I gene in vitro and in vivo[J]. J Biol Chem,1998, 273 (39) : 25371 –25380. DOI:10.1074/jbc.273.39.25371 |
| [19] | Papait R, Condorelli G. Epigenetics in heart failure[J]. Ann N Y Acad Sci,2010, 1188 : 159 –164. DOI:10.1111/j.1749-6632.2009.05096.x |



