前列腺癌为全球男性发病率第二的肿瘤,2012年前列腺癌新发病例1 100 000例,占男性全部癌症患者的15%[1]。据2015年数据统计,我国前列腺癌发病率2005-2011年环比上升4.7%;致死率2000-2011年环比上升5.5%[2]。前列腺癌是激素依赖性肿瘤,激素治疗是其首选标准方案。然而,前列腺癌患者经过一段时间激素治疗以后,往往发展成雄激素难治性前列腺癌(hormone refractory prostate cancer,HRPC)。HRPC转移性强,预后较差,病死率高,目前对其尚无有效的临床治疗方案。
长期以来,坏死都被认为是细胞突发死亡的结果,是不被基因所调控的。2005年,Degterev等[3]提出一种新的细胞死亡方式--不能被Caspase广谱抑制剂抑制,但能被necrostatin-1特异性抑制的细胞死亡,将其命名为程序性坏死(necroptosis)。程序性坏死在形态学上呈坏死样(即细胞膜完整性消失、胞核溶解),但却受到细胞内精密的基因调控,受体相互作用蛋白(receptor interacting protein-1, RIP1)/混合谱系激酶结构区域样蛋白(mixed lineage kinase domain-like, MLKL)是程序性坏死的主要通路。
皂苷类化合物在抗肿瘤方面发挥重要作用,Zhou等[4]发现桔梗皂苷D可通过周期阻滞、诱导凋亡从而在体内外有效抑制前列腺癌生长。Cheng等[5]研究发现从绞股蓝中提取出来的皂苷类化合物可抑制前列腺癌PC3细胞的凋亡。麦冬皂苷D’(Ophiopogonin D’,OPD’)作为皂苷类化合物,它的抗前列腺癌潜能可能巨大。因此,本研究以雄激素非依赖的前列腺癌PC3细胞为研究对象,观察OPD’对该细胞存活的影响,并进一步讨论OPD’抑制前列腺癌的可能相关机制。
1 材料与方法 1.1 化合物和试剂OPD’购买于成都曼思特生物科技有限公司,纯度>98%。Ham’s F-12、胎牛血清(FBS)购买于GIBCO公司(New York, USA),胰酶购于北京中杉金桥生物技术有限公司,磷酸盐缓冲液(PBS)购买于江苏祥盛生物技术有限公司。Annexin V-FITC/PI试剂盒购买于上海贝博生物。Western blot实验所用抗体:RIP1购于sigma公司(St. Louis, MO),anti-MLKL、anti-p-MLKL购于Abcom (Cambridge, UK),anti-β-actin购买于杭州贤至生物科技有限公司。辣根过氧化物酶标记的山羊抗小鼠/兔IgG (H+L)购买于北京中杉金桥。程序性坏死特异性抑制剂necrostatin-1购于Sigma公司(St. Louis, MO)。Caspase广谱抑制剂Z-VAD-FMK、Caspase 3抑制剂AC-DEVD-CHO、四甲基偶唑氮盐(3-(4, 5-Dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide,MTT)、结晶紫染料均购于上海碧云天生物技术有限公司。二甲基亚砜(dimethyl sulfoxide,DMSO)购于Sigma公司(St. Louis, MO)。
1.2 细胞株和细胞培养人前列腺癌PC3细胞为本实验室所保存。PC3细胞培养于Ham’s F-12培养基(含10% FBS),在37 ℃含5% CO2的细胞培养箱中进行培养,根据细胞生长情况每2~3天进行传代。
1.3 MTT实验检测细胞生存率将处于对数生长期PC3细胞以1×104个/孔接种于96孔板,每个浓度均设3个平行孔,置于细胞培养箱中培养24 h后,以不同浓度的OPD’(0、1、2.5、5、10 μmol/L)处理细胞24 h后,每孔加入5 mg/mL的MTT溶液10 μL,于细胞培养箱中继续培养3 h后去上清,每孔加入100 μL DMSO溶解形成的甲臜晶体。运用多功能酶标仪在570 nm波长处读取光密度值,计算生存率,并得出IC50值。
1.4 流式细胞术检测Annexin V-Fitc和PI双染将处于对数生长期的PC3细胞以2×105个/孔接种于6孔板,置于细胞培养箱中培养24 h后,以不同浓度的OPD’(0、1、2.5、5、10 μmol/L)处理细胞6 h,或者用5 μmol/L OPD’处理细胞0、0.5、1、2、4、6 h后,收集细胞及上清,以1 500 r/min离心5 min,弃上清,PBS洗涤2次后,用结合液重悬,分别用Annexin V-FITC和PI染色后,于4 ℃避光孵育15 min,运用流式细胞仪进行检测。
1.5 Western blot检测细胞蛋白表达将处于对数生长期的PC3细胞以1×106个/瓶接种于25 cm2培养瓶中,待其贴壁后分别用不同浓度的OPD’(0、2.5、5 μmol/L)处理细胞6 h,或者以5 μmol/L OPD’处理细胞0、0.5、1、2、4、6、8 h。到达时间点时收集细胞,并提取细胞全蛋白。检测Cleaved-RIP1(30×103)、RIP1(78×103)、MLKL (54×103)、p-MLKL (220×103)的蛋白表达。提取蛋白后进行凝胶电泳,湿转法将蛋白转移至PVDF膜上,5%脱脂牛奶室温封闭3 h,一抗(1:1 000)4 ℃孵育过夜。用TBST洗脱液洗膜(10 min×3次),孵育辣根过氧化物酶共轭的山羊抗鼠/兔二抗2 h,再次洗膜(10 min×3次),凝胶成像系统成像扫描分析。
1.6 结晶紫染色实验观察OPD’对PC3细胞形态学的改变将处于对数生长期的PC3细胞以3×104个/孔接种于24孔板的10 mm×10 mm玻片内,置于细胞培养箱中培养过夜后,以不同浓度的OPD’(0、2.5、5 μmol/L)处理细胞24 h,弃上清,用PBS洗涤2次,加入多聚甲醛室温固定30 min后,PBS洗涤3次,加入结晶紫染色10 min,用PBS洗涤3次,于倒置显微镜下观察拍照。
1.7 透射电镜实验观察OPD’对PC3细胞超微结构的影响将处于对数生长期的PC3细胞以1×106个/瓶接种于25 cm2培养瓶中,待其贴壁后用10 μmol/L的OPD’处理细胞2 h后,收集细胞及上清,以1 500 r/min离心5 min,弃上清,用PBS混匀清洗,离心(1 500 r/min,5 min),去掉上清,加入2%戊二醛,4 ℃固定过夜,PBS清洗1次之后1%锇酸固定2 h,丙酮梯度脱水、环氧树脂618浸透包埋、超薄切片,厚度100 nm,铀铅双染观察。
1.8 统计学分析数据以x±s表示,采用SPSS 11.0统计软件进行单因素方差分析,时间依赖进行线性回归分析。检验水准α=0.05。
2 结果 2.1 OPD’抑制PC3细胞生长采用MTT实验检测OPD’对PC3细胞存活能力的影响。OPD’处理24 h后MTT实验结果见图 1,5 μmol/L的OPD’即可显著抑制PC3细胞活性,10 μmol/L的OPD’处理细胞24 h可抑制88.04%细胞的生长,其半数抑制剂量IC50为(6.25±0.31)μmol/L。

|
| 1:对照组;2: 0.5 μmol/L OPD’处理组;3:1.0 μmol/L OPD’处理组;4: 2.5 μmol/L OPD’处理组;5: 5.0 μmol/L OPD’处理组;6: 10.0 μmol/L OPD’处理组a:P < 0.05, 与对照组比较 图 1 OPD’抑制PC3细胞活性 |
2.2 OPD’诱导PC3细胞凋亡和坏死
不同浓度(0、1、2.5、5 μmol/L) OPD’处理PC3细胞24 h后Annexin V-Fitc和PI双染结果见图 2A,5 μmol/L OPD’诱导21.24%的PC3细胞早期凋亡(P < 0.05),43.5%的细胞晚期凋亡/坏死(P < 0.05),3.86%的细胞坏死(P < 0.05);5 μmol/L OPD’处理PC3细胞不同时间(0、0.5、1、2、4、6 h)后Annexin V-Fitc和PI双染结果见图 2B,5 μmol/L OPD’诱导PC3细胞晚期凋亡/坏死呈明显的时间依赖关系(r=0.728,P < 0.001), 而早期凋亡象限(r=0.149,P=0.554)和坏死象限(r=0.123,P=0.627)不呈时间依赖。
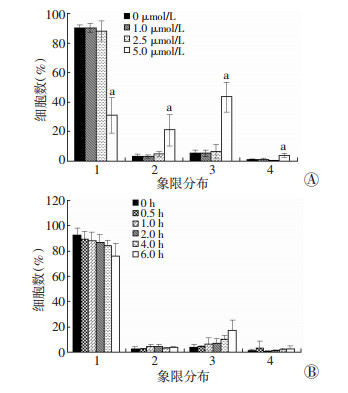
|
| A:麦冬皂苷D’诱导PC3细胞凋亡和坏死呈剂量依赖;B:麦冬皂苷D’诱导PC3细胞凋亡和坏死呈时间依赖;1:存活细胞;2:早期凋亡;3:晚期凋亡/坏死;4:坏死;a:P < 0.05,与对照组(0 μmol/L)比较 图 2 OPD’诱导PC3细胞凋亡和坏死 |
2.3 OPD’诱导PC3细胞Caspase非依赖死亡
结果见表 1,Caspase广谱抑制剂Z-VAD-FMK (20 μmol/L)单独处理PC3细胞,并不抑制PC3细胞活性;而Z-VAD-FMK预处理细胞1 h,再联合5 μmol/L OPD’处理24 h,并不比5 μmol/L OPD’单独处理的杀伤效果弱,反而杀伤效果更强,表明OPD’诱导前列腺癌细胞的死亡是不依赖于Caspase的死亡。同样,用Caspase 3抑制剂AC-DEVD-CHO (10 μmol/L)单独处理PC3细胞并不抑制PC3细胞存活,但AC-DEVD-CHO预处理细胞1 h后,再联合5 μmol/L OPD’,同样比5 μmol/L OPD’单独处理杀伤了更多的PC3细胞,进一步表明OPD’诱导前列腺癌细胞的死亡为Caspase非依赖性死亡。
| 抑制剂 | 0 μmol/L | 5 μmol/L |
| DMSO | 100.00±0.00 | 60.65±4.99 |
| Z-VAD-FMK (20 μmol/L) | 97.03±6.55 | 46.38±4.17a |
| AC-DEVD-CHO (10 μmol/L) | 93.48±4.53 | 48.69±1.76a |
| a:P < 0.05, 与5 μmol/L OPD’(DMSO溶剂)比较 | ||
2.4 OPD’诱导PC3细胞发生程序性坏死
10 μmol/L Nec-1单独处理PC3细胞,并不抑制PC3细胞活性,而Nec-1预处理细胞1 h后再联合10 μmol/L OPD’处理,则逆转OPD’诱导的PC3细胞死亡(P=0.047,图 3),表明OPD’诱导了PC3细胞的程序性坏死。
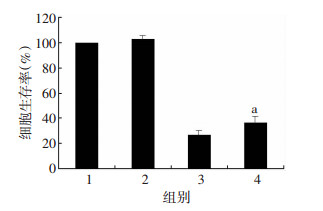
|
| 1:对照组;2:Nec-1处理组;3:OPD’处理组;4:Nec-1+OPD’处理组;a:P < 0.05, 与OPD’处理组比较 图 3 OPD’诱导PC3细胞程序性坏死 |
2.5 OPD’上调程序性坏死相关蛋白RIP1、下调Cleaved-RIP1蛋白的表达
不同浓度OPD’(0、2.5、5 μmol/L)处理PC3细胞6 h后,5 μmol/L组Cleaved-RIP1表达水平明显下调,RIP1表达水平明显上调,Cleaved-RIP1/RIP1比值下降(P < 0.001,图 4)。表明OPD’通过RIP1途径诱导PC3细胞发生程序性坏死。
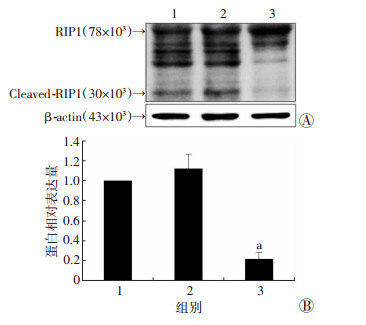
|
| A: Western blot检测结果;B:半定量分析;1:对照组;2:2.5 μmol/L OPD’处理组;3:5 μmol/L OPD’处理组;a:P < 0.05,与对照组比较 图 4 OPD’调节Cleaved-RIP1、RIP1蛋白表达 |
2.6 OPD’上调p-MLKL四聚体蛋白表达水平
同浓度OPD’(0、2.5、5 μmol/L)处理PC3细胞6 h后,5 μmol/L OPD’处理组p-MLKL四聚体表达水平明显上调、p-MLKL/MLKL比值上升(P < 0.001,图 5A、B);5 μmol/L OPD’处理细胞0、0.5、1、2、4、6、8 h后,p-MLKL四聚体水平逐渐上调,p-MLKL/MLKL比值上升,存在明显的时间效应依赖关系(r=0.907,P=0.005,5C、D)。表明OPD’经由MLKL途径诱导PC3细胞程序性死亡。
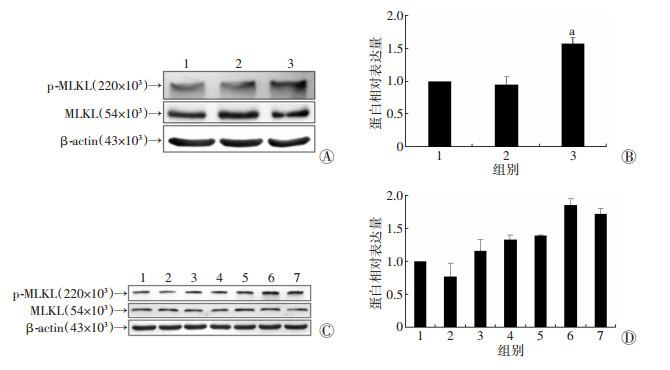
|
| A:不同剂量OPD’对p-MLKL四聚体表达的影响;B:图A蛋白相对表达量;1:对照组;2:2.5 μmol/L OPD’处理组;3:5 μmol/L OPD’处理组;a:P < 0.05,与对照组比较; C: OPD’处理不同时间对p-MLKL四聚体表达的影响;D:图C蛋白相对表达量;1:0 h处理组;2:0.5 h处理组;3:1.0 h处理组;4:2.0 h处理组;5:4.0 h处理组;6:6.0 h处理组;7:8.0 h处理组 图 5 Western blot检测OPD’激活p-MLKL的表达 |
2.7 OPD’诱导PC3细胞呈坏死样改变
进一步用结晶紫和透射电镜观察OPD’对PC3细胞形态学的影响。5 μmol/L OPD’处理PC3细胞6 h后,结晶紫染色显示,与对照组相比,处理组细胞肿胀、胞浆空泡化(图 6A~C)。透射电镜结果显示,10 μmol/L OPD’处理PC3细胞2 h后,处理组细胞胞体肿胀、胞核溶解,细胞呈坏死样死亡(图 6D、E)。

|
| A~C:结晶紫染色显示麦冬皂苷D’诱导PC3细胞肿胀(×400);A;对照组;B:2.5 μmol/L OPD’处理组;C:5 μmol/L OPD’处理组;箭头示细胞肿胀;D、E:透射电镜显示麦冬皂苷D’诱导PC3细胞呈坏死样改变;D:对照组;E:10 μmol/L OPD’处理组;箭头示细胞坏死 图 6 OPD’诱导PC3细胞呈坏死样改变 |
3 讨论
前列腺癌的发生与遗传、生活方式、环境污染等多种因素有关,其中年龄是重要的发病因素。随着人们期望寿命的延长,前列腺癌的发病率必然会越来越高。常规的抗前列腺癌药物主要以诱导肿瘤细胞凋亡为主。近几年,肿瘤细胞的程序性坏死(necroptosis)受到关注,被认为是肿瘤细胞死亡的主要方式之一,尤其是耐药肿瘤细胞有可能通过程序性坏死被清除,necroptosis有希望作为治疗耐药性肿瘤的新靶标[6]。
程序性坏死在抗结肠癌、淋巴瘤、口腔癌中发挥重要作用[7-9],而在对前列腺癌的研究中发现,绿茶提取物茶多酚可诱导前列腺癌PC3细胞程序性坏死[10]。然而皂苷类化合物对前列腺癌程序性坏死的研究鲜见报道。
本研究采用Annexin V-Fitc和PI双染检测早期凋亡、晚期凋亡和坏死的细胞:Annexin V (+) PI (+)为晚期凋亡细胞,Annexin V (+) PI (-)为早期凋亡细胞,Annexin V (-) PI (+)为坏死细胞,Annexin V (-) PI (-)为活细胞。在坏死细胞中,PI能够透过细胞膜与细胞核结合呈现红色。细胞凋亡时,位于细胞膜磷脂双分子层内侧的磷脂酰丝氨酸由内侧翻向外侧,与标记了FITC的Annexin V特异性结合,是检测细胞凋亡的重要手段。但Annexin V阳性并不只出现在凋亡细胞中,细胞膜完整性受到破坏的坏死细胞同样会有Annexin V阳性,即Annexin V (+) PI (+)中存在一部分坏死细胞[11]。Annexin V-Fitc和PI双染实验结果表明,5 μmol/L的OPD’主要诱导PC3细胞晚期凋亡/坏死,且与晚期凋亡/坏死象限中的细胞数呈明显的时间依赖关系(r=0.728,P < 0.001)。后续实验运用Caspase抑制剂、程序性坏死特异性抑制剂Nec-1实验结果显示,凋亡不是OPD’诱导PC3死亡的主要机制,有可能程序性坏死才是。
死亡受体所介导的RIP1/MLKL通路是程序性坏死的主要途径。RIP1是细胞程序性坏死的必须因素。当细胞内Caspase家族有活性时,Caspase家族切割RIP1,使其失活,细胞就通过凋亡的方式死亡;当Caspase活性被抑制无法切割RIP1时,细胞则启动程序性坏死[12]。本研究结果表明OPD’处理的PC3细胞Cleaved-RIP1表达水平明显下调、RIP1表达水平明显上调,Cleaved-RIP1/RIP1比值上升,提示细胞启动了程序性坏死。
MLKL是RIP1/MLKL通路中的核心分子,当细胞启动程序性坏死时,MLKL中T357/S358两个位点发生磷酸化[13],p-MLKL蛋白(54×103)中的螺旋束开始折叠,最终使p-MLKL蛋白形成四聚体(220×103),与细胞膜或细胞器膜中的磷脂酰肌醇脂质(phosphatidylinositol lipids,PIP)[14]结合, 从而开放细胞膜孔道,引起细胞内Ca2+、Na+流紊乱造成细胞或细胞器肿胀,最终导致细胞呈坏死样死亡[15]。本研究的Western blot检测结果表明,OPD’处理的PC3细胞p-MLKL四聚体表达水平上调,p-MLKL/MLKL比值上升,且呈明显的时间依赖关系,提示OPD’诱导了肿瘤细胞程序性坏死。临床上已有证据表明,胰腺癌和卵巢癌患者肿瘤组织中MLKL高表达者,其预后更好,生存期更长[16-17],MLKL可能是治疗肿瘤的新靶标。
在程序性坏死通路中,除死亡受体介导的RIP1/MLKL通路以外,电离辐射、放疗、活性氧、钙离子过载等可能通过不同的机制引起程序性坏死。当X射线照射结直肠癌细胞时,激活RIP1引起细胞程序性坏死[18]。过量的Ca2+活化脂肪氧合酶,使溶酶体破裂,释放体内水解酶,从而引起细胞程序性坏死[19]。ROS通过氧化蛋白和脂质分子破坏细胞膜、影响线粒体氧化磷酸化水平和Ca2+浓度,从而引起程序性坏死[20]。
本研究证实OPD’可通过RIP1/MLKL通路抑制前列腺癌PC3细胞的生长,具有明显的抗肿瘤效应,其诱导PC3细胞程序性坏死可能是其发挥抗肿瘤效应的机制之一。OPD’与程序性坏死还存在诸多未知机制,需要进一步研究证实。本研究拓展了天然化合物诱导肿瘤细胞发生程序性坏死机制的认识,丰富了我们对天然化合物抗肿瘤机制的理解,从而为OPD’诱导前列腺癌程序性坏死提供实验依据,为其成为新的抗肿瘤备选药物提供理论基础。
| [1] | Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin,2015, 65 (2) : 87 –108. DOI:10.3322/caac.21262 |
| [2] | Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin,2016, 66 (2) : 115 –132. DOI:10.3322/caac.21338 |
| [3] | Degterev A, Huang Z, Boyce M, et al. Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury[J]. Nat Chem Biol,2005, 1 (2) : 112 –119. DOI:10.1038/nchembio711 |
| [4] | Zhou R, Lu Z, Liu K, et al. Platycodin D induces tumor growth arrest by activating FOXO3a expression in prostate cancer in vitro and in vivo[J]. Curr Cancer Drug Targets,2015, 14 (9) : 860 –871. DOI:10.2174/1568009614666141128104642 |
| [5] | Cheng T C, Lu J F, Wang J S, et al. Antiproliferation effect and apoptosis mechanism of prostate cancer cell PC-3 by flavonoids and saponins prepared from Gynostemma pentaphyllum[J]. J Agric Food Chem,2011, 59 (20) : 11319 –11329. DOI:10.1021/jf2018758 |
| [6] | Bonapace L, Bornhauser B C, Schmitz M, et al. Induction of autophagy-dependent necroptosis is required for childhood acute lymphoblastic leukemia cells to overcome glucocorticoid resistance[J]. J Clin Invest,2010, 120 (4) : 1310 –1323. DOI:10.1172/JCI39987 |
| [7] | Sulkshane P, Teni T. BH3 mimetic Obatoclax (GX15-070) mediates mitochondrial stress predominantly via MCL-1 inhibition and induces autophagy-dependent necroptosis in human oral cancer cells[J]. Oncotarget,2016 . DOI:10.18632/oncotarget.11085 |
| [8] | Li X, Guo J, Ding A P, et al. Association of Mixed Lineage Kinase Domain-Like Protein Expression With Prognosis in Patients With Colon Cancer[J]. Technol Cancer Res Treat,2016 . DOI:10.1177/1533034616655909 |
| [9] | Locatelli S L, Giacomini A, Guidetti A, et al. Perifosine and sorafenib combination induces mitochondrial cell death and antitumor effects in NOD/SCID mice with Hodgkin lymphoma cell line xenografts[J]. Leukemia,2013, 27 (8) : 1677 –1687. DOI:10.1038/leu.2013.28 |
| [10] | Rizzi F, Naponelli V, Silva A, et al. Polyphenon E (R), a standardized green tea extract, induces endoplasmic reticulum stress, leading to death of immortalized PNT1a cells by anoikis and tumorigenic PC3 by necroptosis[J]. Carcinogenesis,2014, 35 (4) : 828 –839. DOI:10.1093/carcin/bgt481 |
| [11] | Rosolen D, Kretzer I F, Winter E, et al. N-phenylmaleimides affect adipogenesis and present antitumor activity through reduction of FASN expression[J]. Chem Biol Interact,2016, 258 : 10 –20. DOI:10.1016/j.cbi.2016.08.005 |
| [12] | Vanden Berghe T, Vanlangenakker N, Parthoens E, et al. Necroptosis, necrosis and secondary necrosis converge on similar cellular disintegration features[J]. Cell Death Differ,2010, 17 (6) : 922 –930. DOI:10.1038/cdd.2009.184 |
| [13] | Sun L, Wang H, Wang Z, et al. Mixed lineage kinase domain-like protein mediates necrosis signaling downstream of RIP3 kinase[J]. Cell,2012, 148 (1/2) : 213 –227. DOI:10.1016/j.cell.2011.11.031 |
| [14] | Dondelinger Y, Declercq W, Montessuit S, et al. MLKL compromises plasma membrane integrity by binding to phosphatidylinositol phosphates[J]. Cell Rep,2014, 7 (4) : 971 –981. DOI:10.1016/j.celrep.2014.04.026 |
| [15] | Chen X, Li W, Ren J, et al. Translocation of mixed lineage kinase domain-like protein to plasma membrane leads to necrotic cell death[J]. Cell Res,2014, 24 (1) : 105 –121. DOI:10.1038/cr.2013.171 |
| [16] | He L, Peng K, Liu Y, et al. Low expression of mixed lineage kinase domain-like protein is associated with poor prognosis in ovarian cancer patients[J]. Onco Targets Ther,2013, 6 : 1539 –1543. DOI:10.2147/OTT.S52805 |
| [17] | Colbert L E, Fisher S B, Hardy C W, et al. Pronecrotic mixed lineage kinase domain-like protein expression is a prognostic biomarker in patients with early-stage resected pancreatic adenocarcinoma[J]. Cancer,2013, 119 (17) : 3148 –3155. DOI:10.1002/cncr.28144 |
| [18] | Mantel F, Frey B, Haslinger S, et al. Combination of ionising irradiation and hyperthermia activates programmed apoptotic and necrotic cell death pathways in human colorectal carcinoma cells[J]. Strahlenther Onkol,2010, 186 (11) : 587 –599. DOI:10.1007/s00066-010-2154-x |
| [19] | Yamashima T, Oikawa S. The role of lysosomal rupture in neuronal death[J]. Prog Neurobiol,2009, 89 (4) : 343 –358. DOI:10.1016/j.pneurobio.2009.09.003 |
| [20] | Shindo R, Kakehashi H, Okumura K, et al. Critical contribution of oxidative stress to TNFalpha-induced necroptosis downstream of RIPK1 activation[J]. Biochem Biophys Res Commun,2013, 436 (2) : 212 –216. DOI:10.1016/j.bbrc.2013.05.075 |



