He Fengtian, E-mail: hefengtian06@aliyun.com
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤。其发病率高,病死率高,预后差[1-3]。因此,深入阐明HCC的发生、发展机制以及寻找抗HCC治疗的新靶点具有十分重要的意义。近年来,与HCC密切相关的微小RNA (microRNA)备受关注。microRNA (miRNA)是机体内源性表达的单链、非编码小分子RNA (19-22nt),通过与靶mRNA相互作用而调节基因的表达[4]。越来越多的研究发现,miRNA密切参与生物体的生长发育及多种生理病理学过程,尤其与肿瘤的发生、发展密切相关[5]。miR-134作为抑癌基因,密切参与肝癌、肺癌、结直肠癌、子宫内膜癌、垂体瘤等多种肿瘤的发生、发展[6-9]。文献[10-11]报道,在HCC中miR-134可通过下调KRAS及ITGB1, 抑制HCC的远端转移。那么,miR-134是否存在其他的调控机制参与HCC的发生、发展,仍需深入研究。
叉头盒蛋白M1(forkhead box M1,FOXM1)是进化保守的FOX转录因子家族成员之一[12]。FXOM1是一种重要的促癌基因,在多种肿瘤如肝癌、肺癌、乳腺癌、卵巢癌、前列腺癌中均高表达,并且可以作为肿瘤患者预后的分子标志[13]。因此有效抑制FOXM1的表达及功能无疑有助于肿瘤的防治,但目前关于FOXM1的自身表达调控机制尚不十分明确。那么作为重要肿瘤调节因子miR-134是否参与调节FOXM1,该调节通路是否是miR-134发挥抗HCC作用的新机制,目前尚不清楚。
因此,本研究在发现miR-134可显著抑制HCC细胞增殖的基础上,探讨其作用机制。HCC细胞中miR-134与FOXM1蛋白表达的负相关性提示二者可能存在表达调控相关性;进一步研究发现miR-134可以特异性结合于FOXM1 mRNA的3′-UTR,从而下调FOXM1及其下游靶基因CyclinD1的表达;过表达FOXM1可减弱miR-134对HCC细胞增殖的抑制效应。上述研究为阐明miR-134与HCC发生、发展的相关性,以及FOXM1自身的表达调控机制积累新的理论资料,为探索以FOXM1和miR-134为靶标的抗HCC治疗措施提供新的科学依据。
1 材料与方法 1.1 材料 1.1.1 质粒、菌株及细胞系pmir-GLO双荧光素酶报告基因质粒,购自Promega公司;FOXM1过表达质粒pEGFP-FOXM1由本科室保存;大肠杆菌DH5α、人肝癌细胞系HepG2、Hep3B、Huh7、PLC、SMMC-7721和人胎肝细胞系L02均由本室保存。
1.1.2 主要试剂胎牛血清(FBS)、MEM培养基、DMEM培养基购自美国Gibco公司;PBS缓冲液购自北京中杉金桥公司;胰酶购自美国HyClone公司;Opti-MEM培养基购自美国Gibco公司;Lipofectamine 2000购自美国Invirogen公司;CCK-8试剂盒购自日本Dojindo公司;TRIzol购自北京康为世纪公司;PrimeScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒购自大连TaKaRa公司;All-in-OneTM miRNA qRT-PCR Detection System试剂盒购自广州复能基因公司;SYBR购自美国ABI公司;蛋白酶抑制剂购自美国Roche公司;RIPA裂解液、BCA蛋白浓度检测试剂盒、一抗稀释液均购自江苏碧云天公司;封闭蛋白干粉购自武汉博士德公司;β-actin小鼠单克隆抗体(ab8226)、FOXM1兔多克隆抗体(ab83097)购自美国Abcam公司;山羊抗鼠、山羊抗兔二抗均购自北京中杉公司;PVDF膜、ECL化学发光试剂盒均购自美国Bio-Rad公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司。
1.2 方法 1.2.1 细胞培养及处理肝癌细胞HepG2、Hep3B、Huh7、PLC、SMMC-7721和人胎肝细胞L02采用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的MEM培养基或DMEM培养基培养,置于5% CO2、37℃恒温恒湿培养箱中培养,细胞生长密度达90%左右时进行细胞传代,待细胞进入对数生长期后,转染miR-134 mimic (5′-UGUGACUGGUUGACCAGAGG-GG-3′),mimic negative control (mimic NC,5′-UUGUACUACACAAAAGUACUG-3′),miR-134 inhibitor (5′-CCC-CUCUGGUCAACCAGUCACA-3′),inhibitor negative control (inhibitor NC,5′-CAG UACUUUUGUGUAGUACAA-3′)。转染操作按照Lipofectamine 2000说明书进行。
1.2.2 CCK-8实验取对数生长期的HepG2和Hep3B细胞,胰酶消化按每孔细胞密度达50%接种于96孔板中,培养24 h后,转染miR-134 mimic、miR-134 inhibitor,或相对应的NC;细胞共转染实验分别转染pEGFP-FOXM1+miR-134 mimic,或pEGFP-N1+miR-134 mimic。继续培养24 h后,每孔加入10 μL CCK-8试剂,37 ℃孵育1 h于酶标仪450 nm波长下测细胞的光密度值[D(450)]。
1.2.3 Real-time PCR检测miR-134表达依据TRIzol说明书提取细胞总RNA,All-in-OneTM miRNA qRT-PCR Detection System试剂盒将所得RNA逆转录成miRNA第1条链,具体操作按说明书进行。以U6为内参Real-time PCR检测miR-134表达,成熟miR-134上游引物:5′-TGTGACTGGTTGACCAGAGGGG-3′,下游引物由试剂盒提供;U6内参引物上游:5′-CGCTTCGGCAGCACATATACTAA-3′,下游:5′-TATGGAACGCTTCACGAATTTGC -3′。
1.2.4 Real-time PCR检测FOXM1及CyclinD1表达依据TRIzol说明书提取细胞转染miR-134 mimic或mimic NC并培养24 h后的总RNA,利用PrimeScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒去除基因组DNA并将所得RNA逆转录为cDNA, 以β-actin为内参进行Real-time PCR检测。引物序列如下:β-actin上游:5′-CGAGGCCCCCCT GAAC-3′,下游:5′-GCCAGAGGCGTACAGGGATA-3′;FOXM1上游:5′-AGTAGTGGGCCCAACAAATTCAT -3′,下游:5′-CTTT-TGGCATCATAGCTGGTTTG-3′;CyclinD1上游:5′-CGCCCCACCCCTCCAG-3′,下游:5′-CCGCCCAGACCCTCAGACT-3′。
1.2.5 Western blot检测FOXM1蛋白的表达处理后的细胞经含蛋白酶抑制剂的RIPA裂解液裂解,离心取上清,BCA试剂盒测定蛋白浓度,加入5×蛋白上样缓冲液煮沸10 min使蛋白变性。取等量蛋白(80 μg)经10% SDS-PAGE凝胶电泳后,采用半干法转PVDF膜,转膜结束后于5%脱脂奶粉中室温封闭2 h,封闭结束后将膜置于一抗稀释液(1:1 000)4 ℃孵过夜,PBST洗膜3次,每次10 min,将膜置于二抗(1:10 000)中室温孵育2 h,PBST洗膜3次,每次10 min,ECL化学发光显影。
1.2.6 质粒构建经生物信息学预测软件TargetScan (http://www.targetscan.org/)和miRanda (http://www.microrna.org/microrna/getGeneForm.do)预测FOXM1 3′-UTR上miR-134可能结合位点。将包含miR-134结合位点的FOXM1 3′-UTR连接至双荧光素酶报告基因载体pmir-GLO上,命名为pmir-FOXM1;包含了miR-134结合位点突变的FOXM1 3′-UTR连接至pmir-GLO上,命名为pmir-FOXM1-Mut;质粒构建由上海生工公司完成。
1.2.7 报告基因检测将HepG2和Hep3B细胞接种于96孔板中,培养24 h后细胞密度达90%左右,共转染报告基因质粒和miR-134 mimic/miR-134 inhibitor或mimic NC /inhibitor NC,24 h后,使用双荧光素酶报告基因检测试剂盒测定报告基因活性,具体操作参照说明书,报告基因活性以萤火虫荧光素酶活性与海肾荧光素酶活性之比表示。
1.3 统计学分析所有数据以x±s表示,采用Graphpad Prism 5统计软件进行分析,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 CCK-8实验检测细胞增殖情况CCK-8实验检测HepG2和Hep3B细胞转染miR-134 mimic或miR-134 inhibitor后,结果显示:相对于对照组(NC),miR-134 mimic可抑制细胞增殖(P < 0.05,图 1A),而转入miR-134 inhibitor抑制内源性miR-134可促进细胞增殖(P < 0.05, 图 1B)。
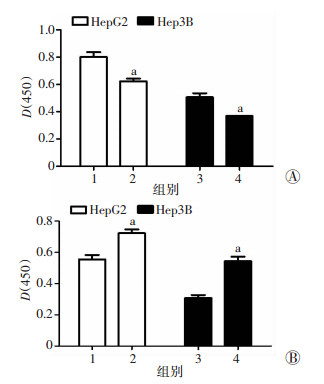
|
| A:HepG2和Hep3B细胞转染mimic NC或miR-134 mimic后细胞增殖情况1:mimic NC组;2:miR-134 mimic组;3:mimic NC组;4:miR-134 mimic组;B:HepG2和Hep3B细胞转染inhibitor NC或miR-134 inhibitor后细胞增殖情况1:inhibitor NC组;2:miR-134 inhibitor组;3:inhibitor NC组;4:miR-134 inhibitor组a:P < 0.05,与mimic NC组或inhibitor NC组比较 图 1 CCK-8检测HCC细胞转染miR-134 mimic或inhibitor后细胞增殖情况 |
2.2 Western blot和Real-time PCR检测HCC细胞系和人正常胎肝细胞L02中的FOXM1和miR-134的表达
Western blot和Real-time PCR检测了5种HCC细胞系和人正常胎肝细胞L02中的FOXM1和miR-134的表达。检测结果显示,与人正常胎肝细胞L02相比,HepG2、Hep3B、Huh7、PLC细胞中FOXM1蛋白表达显著升高(图 2A、B),而miR-134在HCC中的表达显著降低(P < 0.05,图 2C),经Pearson′s相关性分析显示,miR-134的表达与FOXM1蛋白的表达存在负相关性(R2=0.705,P < 0.05,图 2D)。
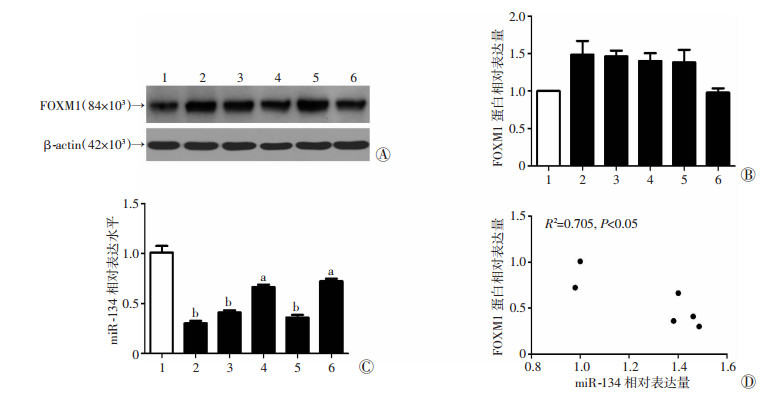
|
| A:Western blot检测结果;B:半定量分析结果;C:Real-time PCR检测结果;D:L02和5种HCC细胞中FOXM1和miR-134表达的相关性分析1:L02;2:Hep3B;3:HepG2;4:Huh7;5:PLC; 6:SMMC-7721 a:P < 0.05,b:P < 0.01,与L02比较` 图 2 Western blot和Real-time PCR检测HCC细胞中FOXM1与miR-134的表达 |
2.3 Western blot和Real-time PCR检测miR-134对FOXM1蛋白和mRNA表达的影响
HepG2和Hep3B细胞转染miR-134 mimic、mimic NC或miR-134 inhibitor、inhibitor NC后,分别检测FOXM1在蛋白和mRNA水平的表达。Western blot结果显示:相对NC组,miR-134 mimic可下调FOXM1蛋白表达(图 3A、B),相反地,转入miR-134 inhibitor组,抑制内源性miR-134,FOXM1蛋白的表达明显恢复(图 3C、D);Real-time PCR结果显示,miR-134 mimic不影响FOXM1 mRNA的表达(图 3E)。进一步我们检测了FOXM1下游靶基因CyclinD1的表达,结果显示,miR-134 mimic可抑制FOXM1下游靶基因CyclinD1的表达(P < 0.05,图 3F)。以上结果提示miR-134可转录后抑制FOXM1的表达。

|
| A:HepG2细胞Western blot检测结果1:mimic NC组;2:miR-134 mimic组;B: Hep3B细胞Western blot检测结果1:mimic NC组;2:miR-134 mimic组;C:HepG2细胞Western blot检测结果1:inhibitor NC组;2:miR-134 inhibitor组; D: Hep3B细胞Western blot检测结果1:inhibitor NC组;2:miR-134 inhibitor组; E:Real-time PCR检测FOXM1表达1:mimic NC组;2:miR-134 mimic组;3:mimic NC组;4:miR-134 mimic组;F:Real-time PCR检测CyclinD1表达1:mimic NC组;2:miR-134 mimic组;3:mimic NC组;4:miR-134 mimic组a:P < 0.05,与mimic NC组(对照组)比较 图 3 Western blot和Real-time PCR检测miR-134对FOXM1蛋白和mRNA表达的影响 |
2.4 双荧光素酶报告基因检测miR-134与FOXM1 3′-UTR的结合
为了进一步探索miR-134抑制FOXM1的分子机制,经生物信息学预测miR-134的结合位点位于FOXM1 mRNA的第2 672~2 679之间(命名为FOXM1-MIRE134)(图 4)。设计并合成包含结合位点以及结合位点突变的寡核苷酸片段的报告基因质粒,与miR-134 mimic、miR-134 inhibitor及相应的NC共转染HepG2和Hep3B细胞,检测荧光素酶活性,结果显示,与对照组相比,miR-134 mimic可显著抑制FOXM1 3′-UTR的报告基因活性(P < 0.01,图 5A、B),而miR-134 inhibitor则可恢复FOXM1 3′-UTR报告基因活性(P < 0.05,图 5C、D),此外,miR-134 mimic或miR-134 inhibitor不影响miR-134关键结合位点突变的FOXM1 3′-UTR报告基因活性(图 5),以上结果提示,miR-134直接结合于FOXM1 3′-UTR,FOXM1是miR-134的直接靶基因。
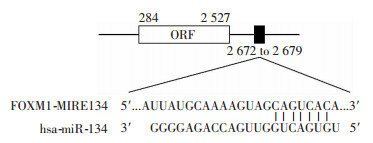
|
| 图 4 生物信息学预测miR-134在FOXM1 3′-UTR上的可能结合位点 |
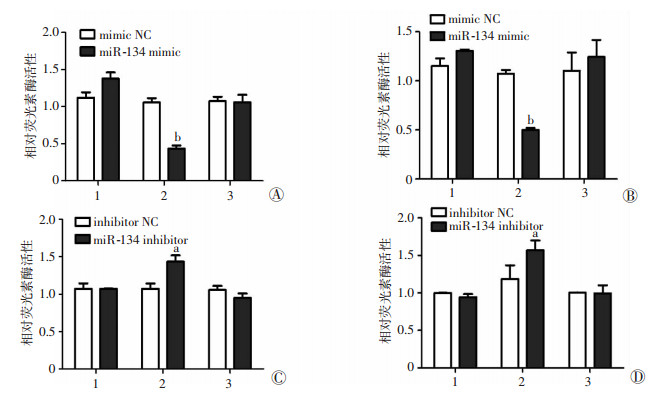
|
| A:HepG2细胞共转染miR-134 mimic/NC+报告基因质粒pmir-FOXM1/pmir-FOXM1-Mut的萤火虫荧光素酶/海肾荧光素酶活性比;B:Hep3B细胞共转染miR-134 mimic/NC+报告基因质粒pmir-FOXM1/pmir-FOXM1-Mut的萤火虫荧光素酶/海肾荧光素酶活性比;C:HepG2细胞共转染miR-134 inhibitor/NC+报告基因质粒pmir-FOXM1/pmir-FOXM1-Mut的萤火虫荧光素酶/海肾荧光素酶活性比;D:Hep3B细胞共转染miR-134 inhibitor/NC+报告基因质粒pmir-FOXM1/pmir-FOXM1-Mut的萤火虫荧光素酶/海肾荧光素酶活性比1:pmir-GLO; 2:pmir-FOXM1;3:pmir-FOXM1-Mut a:P < 0.05,与转染inhibitor NC+pmir-FOXM1比较;b:P < 0.01,与转染mimic NC+pmir-FOXM1比较 图 5 双荧光素酶报告基因检测miR-134与FOXM1 3′-UTR的结合 |
2.5 CCK-8检测过表达FOXM1后miR-134对HCC细胞增殖的影响
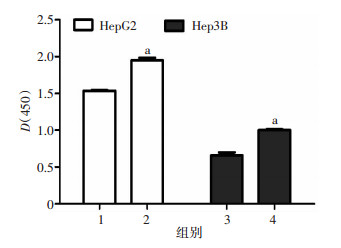
HepG2和Hep3B共转染miR-134 mimic和FOXM1过表达质粒pEGFP-FOXM1或空载对照质粒pEGFP-N1,经CCK-8检测细胞增殖情况,结果显示:相对于空载对照组,当过表达FOXM1后,miR-134 mimic对HepG2和Hep3B细胞增殖的抑制作用明显减弱(P < 0.05,图 6)。
|
| 1:pEGFP-N1+miR-134 mimic组;2:pEGFP-FOXM1+miR-134 mimic组;3:pEGFP-N1+miR-134 mimic组;4:pEGFP-FOXM1+miR-134 mimic组a:P < 0.05, 与pEGFP-N1+miR-134 mimic组比较 图 6 CCK-8检测过表达FOXM1后miR-134对HCC细胞增殖的影响 |
3 讨论
本研究探讨了miR-134对FOXM1的调控作用及其对肝细胞癌细胞增殖的影响。我们的研究发现,miR-134可显著抑制HCC细胞增殖;HCC细胞中miR-134与FOXM1蛋白表达存在负相关;进一步研究发现miR-134可抑制FOXM1及其下游靶基因CyclinD1的表达,其调节机制是由miR-134特异性结合于FOXM1 mRNA的3′-UTR介导;过表达FOXM1可减弱miR-134对HCC细胞增殖的抑制效应。
miRNA可通过与靶基因mRNA的3′-UTR特异性识别及结合,从而抑制靶基因mRNA的翻译过程或促进其降解,实现对基因表达的转录后调控[4-5]。大量研究表明miRNA的表达失调与多种肿瘤有关,可作为促癌基因又可作为肿瘤抑制基因发挥作用[14-15]。一个miRNA可调控多个下游靶基因,同样地,一个基因也可由多个miRNA调控,共同调控肿瘤的进程。miR-134是一个重要的肿瘤相关miRNA,多在肿瘤中表达下调[16],miR-134通过调控多个与肿瘤细胞增殖相关的靶基因(如EGFR、WWOX、KRAS、Meis2、Nanog[6, 17-20])发挥重要的抑癌作用。在非小细胞肺癌中,miR-134通过下调EGFR抑制肿瘤细胞增殖[6];在结直肠癌中,miR-134通过削弱EGFR和PI3K信号通路抑制肿瘤细胞增殖及肿瘤转移和侵袭[7];在子宫内膜癌中,miR-134通过下调POGLUT1抑制肿瘤干细胞的增殖[8];在垂体瘤中,过表达miR-134可阻滞细胞周期从而抑制细胞增殖[9]。除了以上肿瘤细胞增殖靶基因外,miR-134是否还调控其他与肿瘤细胞增殖相关的靶基因及作用机制如何?我们的研究发现miR-134可抑制HCC细胞的增殖,并与FOXM1的水平呈负相关,该发现目前尚少见报道,结合生物信息学分析,提示FOXM1可能是miR-134的新靶标。但其具体的机制尚需深入探讨。
研究发现FOXM1是重要的促癌基因,在多种肿瘤如肝癌、肺癌、乳腺癌、卵巢癌、前列腺癌中均过表达[13],且FOXM1的蛋白水平可用来预测接受肝移植的肝癌患者的预后情况[21]。FOXM1通过上调基质金属蛋白酶MMP-2、MMP-9促进肿瘤转移[12, 22]。FOXM1作为重要的细胞增殖相关的转录因子,可通过调控细胞周期蛋白Cdc25A、Cdc25B、CyclinB1、CyclinD1、P21和P27促进细胞周期G1~S期、G2~M期的进程,从而促进细胞增殖[23-26]。但目前关于FOXM1自身的表达调控机制尚不十分明确,有研究发现,促癌分子RAS可上调其表达[27],而抑癌分子如p53[28]、p19ARF[29]可下调其表达,核受体LXRα也可下调FOXM1表达[23]。文献[30-33]报道,一些miRNA也参与FOXM1的表达调节,如miR-877、miR-216b、miR-370、miR-204等均可以通过下调FOXM1抑制肿瘤进程。那么miR-134抑制HCC细胞增殖是否与调节FOXM1相关,我们研究发现,HCC细胞中miR-134的表达明显降低(P < 0.05),FOXM1蛋白表达明显增强,二者存在负相关性(R2=0.705, P < 0.05),提示二者可能存在一定的调节作用。进一步的研究发现,miR-134特异性结合于FOXM1 mRNA的3′-UTR,在蛋白水平抑制FOXM1的表达,且过表达FOXM1可减弱miR-134对HCC细胞增殖的抑制效应。
综上所述,本研究证实了miR-134可通过下调FOXM1抑制HCC细胞增殖,miR-134/FOXM1通路是miR-134发挥抗HCC作用的新机制。为阐明miR-134与HCC发生、发展的相关性,以及FOXM1自身的表达调控机制积累新的理论资料,为探索以FOXM1和miR-134为靶标的抗HCC治疗措施提供新的科学依据。
| [1] | EI-Serag H B, Rudolph K L. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis[J]. Gastroenterology,2007, 132 (7) : 2557 –2576. DOI:10.1053/j.gastro.2007.04.061 |
| [2] | 卢燕军, 付陆军, 杨家进, 等. siRNA介导BMP7基因沉默对人肝癌HepG2细胞增殖和迁移的影响[J]. 世界华人消化杂志,2016, 24 (1) : 10 –18. DOI:10.11569/wcjd.v24.i1.10 |
| [3] | 付林, 李林. 射频消融与手术切除治疗原发性肝癌的近期及远期预后回顾性分析[J]. 河北医学,2016, 22 (1) : 119 –122. DOI:10.3969/j.issn.1006-6233.2016.01.041 |
| [4] | Zhou P, Huang G, Zhao Y, et al. MicroRNA-363-mediated downregulation of S1PR1 suppresses the proliferation of hepatocellular carcinoma cells[J]. Cell Signal,2014, 26 (6) : 1347 –1354. DOI:10.1016/j.cellsig.2014.02.020 |
| [5] | Zhang Y, Gong W, Dai S, et al. Downregulation of human farnesoid X receptor by miR-421 promotes proliferation and migration of hepatocellular carcinoma cells[J]. Mol Cancer Res,2012, 10 (4) : 516 –522. DOI:10.1158/1541-7786.MCR-11-0473 |
| [6] | Qin Q, Wei F, Zhang J, et al. miR-134 inhibits non-small cell lung cancer growth by targeting the epidermal growth factor receptor[J]. J Cell Mol Med,2016, 20 (10) : 974 –1983. DOI:10.1111/jcmm.12889 |
| [7] | EI-Daly S M, Abba M L, Patil N, et al. miRs-134 and -370 function as tumor suppressors in colorectal cancer by independently suppressing EGFR and PI3K signaling[J]. Sci Rep,2016, 6 : 24720 . DOI:10.1038/srep24720 |
| [8] | Gao Y, Liu T, Huang Y. MicroRNA-134 suppresses endometrial cancer stem cells by targeting POGLUT1 and Notch pathway proteins[J]. FEBS Lett,2015, 589 (2) : 207 –214. DOI:10.1016/j.febslet.2014.12.002 |
| [9] | Cheunsuchon P, Zhou Y, Zhang X, et al. Silencing of the imprinted DLK1-MEG3 locus in human clinically nonfunctioning pituitary adenomas[J]. Am J Pathol,2011, 179 (4) : 2120 –2130. DOI:10.1016/j.ajpath.2011.07.002 |
| [10] | Yin C, Wang P, Xu W, et al. Hepatocyte nuclear factor-4α reverses malignancy of hepatocellular carcinoma through regulating miR-134 in the DLK1-DIO3 region[J]. Hepatology,2013, 58 (6) : 1964 –1976. DOI:10.1002/hep.26573 |
| [11] | Zha R, Guo W, Zhang Z, et al. Genome-wide screening identified that miR-134 acts as a metastasis suppressor by targeting integrin β1 in hepatocellular carcinoma[J]. PLoS One,2014, 9 (2) : e87665 . DOI:10.1371/journal.pone.0087665 |
| [12] | 孔飞飞, 袁海花, 王炯轶, 等. Foxm1对非小细胞肺癌中MMP-2、MMP-9和迁移侵袭的影响[J]. 现代肿瘤医学,2014, 22 (8) : 1775 –1778. DOI:10.3969/j.issn.1672-4992.2014.08.09 |
| [13] | Wierstra I. FOXM1 (Forkhead box M1) in tumorigenesis: overexpression in human cancer, implication in tumorigenesis, oncogenic functions, tumor-suppressive properties, and target of anticancer therapy[J]. Adv Cancer Res,2013, 119 : 191 –419. DOI:10.1016/B978-0-12-407190-2.00016-2 |
| [14] | Calin G A, Croce C M. MicroRNA signatures in human cancers[J]. Nat Rev Cancer,2006, 6 (11) : 857 –866. DOI:10.1038/nrc1997 |
| [15] | Kumar M S, Lu J, Mercer K L, et al. Impaired microRNA processing enhances cellular transformation and tumorigenesis[J]. Nat Genet,2007, 39 (5) : 673 –677. DOI:10.1038/ng2003 |
| [16] | 俞万钧, 汪一萍, 李纪鹏, 等. miR-134调控人肺腺癌细胞顺铂耐药[J]. 中国病理生理杂志,2015, 31 (7) : 1214 –1218. DOI:10.3969/j.issn.1000-4718.2015.07.011 |
| [17] | Chen T, Gao F, Feng S, et al. MicroRNA-134 regulates lung cancer cell H69 growth and apoptosis by targeting WWOX gene and suppressing the ERK1/2 signaling pathway[J]. Biochem Biophys Res Commun,2015, 464 (3) : 748 –754. DOI:10.1016/j.bbrc.2015.07.021 |
| [18] | Zhao Y, Pang D, Wang C, et al. MicroRNA-134 modulates glioma cell U251 proliferation and invasion by targeting KRAS and suppressing the ERK pathway[J]. Tumour Biol,2016, 37 (8) : 11485 –11493. DOI:10.1007/s13277-016-5027-9 |
| [19] | Wu Y, Zhao H, Zhou L, et al. miR-134 modulates the proliferation of human cardiomyocyte progenitor cells by targeting meis2[J]. Int J Mol Sci,2015, 16 (10) : 25199 –25213. DOI:10.3390/ijms161025199 |
| [20] | Niu C, Yang Y, Cheng C. MiR-134 regulates the proliferation and invasion of glioblastoma cells by reducing Nanog expression[J]. Int J Oncol,2013, 42 (5) : 1533 –1540. DOI:10.3892/ijo.2013.1844 |
| [21] | Sun H, Teng M, Liu J, et al. FOXM1 expression predicts the prognosis in hepatocellular carcinoma patients after orthotopic liver transplantation combined with the Milan criteria[J]. Cancer Lett,2011, 306 (2) : 214 –222. DOI:10.1016/j.canlet.2011.03.009 |
| [22] | Koo C Y, Muir K W, Lam E W. FOXM1: From cancer initiation to progression and treatment[J]. Biochim Biophys Acta,2012, 1819 (1) : 28 –37. DOI:10.1016/j.bbagrm.2011.09.004 |
| [23] | Hu C, Liu D, Zhang Y, et al. LXRα-mediated downregulation of FOXM1 suppresses the proliferation of hepatocellular carcinoma cells[J]. Oncogene,2014, 33 (22) : 2888 –2897. DOI:10.1038/onc.2013.250 |
| [24] | Wang X, Quail E, Hung NJ, et al. Increased levels of forkhead box M1B transcription factor in transgenic mouse hepatocytes prevent age-related proliferation defects in regenerating liver[J]. Proc Natl Acad Sci USA,2001, 98 (20) : 11468 –11473. DOI:10.1073/pnas.201360898 |
| [25] | Wang X, Krupczak-Hollis K, Tan Y, et al. Increased hepatic Forkhead Box M1B (FoxM1B) levels in old-aged mice stimulated liver regeneration through diminished p27Kip1 protein levels and increased Cdc25B expression[J]. J Biol Chem,2002, 277 (46) : 44310 –44316. DOI:10.1074/jbc.M207510200 |
| [26] | Ye H, Holterman A X, Yoo K W, et al. Premature expression of the winged helix transcription factor HFH-11B in regenerating mouse liver accelerates hepatocyte entry into S phase[J]. Mol Cell Biol,1999, 19 (12) : 8570 –8580. DOI:10.1128/MCB.19.12.8570 |
| [27] | Park H J, Carr J R, Wang Z, et al. FoxM1, a critical regulator of oxidative stress during oncogenesis[J]. EMBO J,2009, 28 (19) : 2908 –2918. DOI:10.1038/emboj.2009.239 |
| [28] | Pandit B, Halasi M, Gartel A L. p53 negatively regulates expression of FoxM1[J]. Cell Cycle,2009, 8 (20) : 3425 –3427. DOI:10.4161/cc.8.20.9628 |
| [29] | Kalinichenko V V, Major M L, Wang X, et al. Foxm1b transcription factor is essential for development of hepatocellular carcinomas and is negatively regulated by the p19ARF tumor suppressor[J]. Genes Dev,2004, 18 (7) : 830 –850. DOI:10.1101/gad.1200704 |
| [30] | Huang X, Qin J, Lu S. Up-regulation of miR-877 induced by paclitaxel inhibits hepatocellular carcinoma cell proliferation though targeting FOXM1[J]. Int J Clin Exp Pathol,2015, 8 (2) : 1515 –1524. |
| [31] | Zheng W W, Zhou J, Zhang C H, et al. MicroRNA-216b is downregulated in hepatocellular carcinoma and inhibits HepG2 cell growth by targeting Forkhead box protein M1[J]. Eur Rev Med Pharmacol Sci,2016, 20 (12) : 2541 –2550. |
| [32] | Duan N, Hu X, Yang X, et al. MicroRNA-370 directly targets FOXM1 to inhibit cell growth and metastasis in osteosarcoma cells[J]. Int J Clin Exp Pathol,2015, 8 (9) : 10250 –10260. |
| [33] | Sun Y, Yu X, Bai Q. miR-204 inhibits invasion and epithelial-mesenchymal transition by targeting FOXM1 in esophageal cancer[J]. Int J Clin Exp Pathol,2015, 8 (10) : 12775 –12783. |



