2. 400038 重庆,第三军医大学:西南医院心血管内科
2. Department of Cardiology, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
心房颤动(房颤)是临床上最常见的快速性心律失常,一般人群房颤的总患病率为0.4%~1.0%[1],随着老龄化的加快,房颤患病率逐渐增加。房颤患者容易发生卒中、肾功能障碍等并发症,给个人、家庭和社会带来了沉重的负担。房颤确切的病因及发病机制至今仍未阐明[1-3]。目前房颤的治疗和预防仍然是个难题,药物治疗存在副作用、治疗不够规范以及停药率较高等问题;另一方面除颤器和不断改善的射频消融技术也各有其缺点,前者容易并发功能性的损伤[3],而后者存在复发率高、严重并发症、成本高等问题。因此,建立房颤的动物模型,对深入研究房颤的病因、发病机制和新的治疗措施意义重大。
目前常用的房颤动物模型以大动物为主,一般用羊、犬、兔等较多,造模的方式主要有动物电生理模型、神经激素和血管生理异常的动物模型、结构重构性动物模型和药物干预,但是以大动物建模通常存在费用较高、造模周期长、造模不稳定等缺点。虽然基因工程房颤模型用小鼠作为造模动物,但是由于目前尚缺乏明确的致房颤基因,加上小鼠的心房过小不容易容纳多折返环等诸多原因,此方面的研究仍处于起始阶段[4]。
CD4+T细胞亚群是细胞免疫的重要组成部分,除了Th1、Th2细胞外,近年来新发现了Th17细胞,以特异性分泌细胞因子IL-17A为主要特征,具有很强的促炎症作用,并发现参与许多自身免疫性疾病、肿瘤及炎性疾病的发生与发展[5]。另外,在炎症反应的相关因子中,急性期反应蛋白CRP作为非常敏感的炎症标记物,可反映当前炎症反应的水平[6]。本研究采用心房快速起搏的方法建立SD大鼠房颤模型,并探讨IL-17A、CRP在房颤中的变化以及心房纤维化的改变,为房颤的预防和诊治提供新的思路。
1 材料与方法 1.1 动物及分组清洁级SD大鼠20只,由第三军医大学实验动物中心提供[生产许可证号SCXK (渝)2012-0003,使用许可证号SYXK (渝)2012-0002],常规喂养,环境温度(23±2)℃,湿度40%~70%,体质量250~300 g,雄性。采用随机数字表法分为房颤组和阴性对照组,每组10只。
1.2 食道快速心房起搏电刺激方法建立房颤模型房颤组所有大鼠戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,仰卧固定于实验台上,注意保温,四肢皮下记录Ⅱ导联心电图(生物信号采集处理系统,MADLAB-4C/501H,北京众实)。沿正中线切开颈部皮肤,钝性分离气管前肌肉,暴露气管,在可视状态下,从口中插入自制气管插管至气管中部,并验证气管插管停留在气管内,固定,必要时连接小动物呼吸机(DW-3000C,北京众实),人工辅助呼吸。接着,食道调搏电极(头端有4个直径1 mm的环状电极,间隔2 mm)经食道插入至能捕获心房心电图的位置,尾端连接生理药理电子刺激仪(YLS-9A,北京众实),通过刺激仪发出的脉冲波起搏心房,脉冲波电压20 V,电流4 mA,波宽6 ms,间隙20 ms。每次刺激30 s,间隔5 min行下次刺激,每天行1组刺激(每组5次),间隔4天行第2组刺激。对照组除不进行心房起搏外,其余步骤同房颤组,两组大鼠均自由进食、饮水。
1.3 心电监测两组大鼠在气管插管前监测10 min心电图,插管后监测10 min心电图,待心电图稳定后,将食道调搏电极插入食道,房颤组进行快速心房起搏,对照组不做任何处理,观察并持续记录心电图。生物信号采集处理系统(MADLAB-4C/501H,北京众实)记录每次房颤发作时的持续时间,房颤发生前后心电图改变,包括心率、RR间期、QRS间期和QT间期的改变。
以出现典型的房颤f波及p波消失为房颤发生标志,以恢复窦性心律,f波消失及p波出现为房颤终止[7]。房颤诱发率指房颤的发生次数占所有诱发次数的比例;房颤持续时间指每次房颤开始发作到此次停止发作时的间隔时间[8]。
1.4 标本收集实验开始前、第5天及第10天实验后,将房颤组与对照组大鼠腹腔麻醉,均仰卧固定于实验台上,尾静脉取血1 mL,立即注入抗凝管,摇匀,以2 000 r/min离心20 min,分离血浆与血细胞并冻存于-80 ℃。房颤组10次快速心房起搏完成后与对照组大鼠深度麻醉,开胸处死,剪开心包膜,暴露心脏,用头皮针刺入左心室进行心脏灌注,先用生理盐水灌注冲洗,然后用4%的多聚甲醛进行灌注固定,并保存于装有4%多聚甲醛的容器内,保存待用。
1.5 IL-17A和CRP检测运用酶联免疫吸附试剂盒(上海,博谷生物科技有限公司)测定房颤组与对照组血浆中IL-17A与CRP的浓度,每个样品设4个重复,实验遵照试剂盒说明书进行,光密度值检测运用Model 680型酶标仪(BIO-RAD公司),标准曲线的绘制(logit-log模式)以及样本浓度的计算采用ElisaCalc软件进行。
1.6 心房纤维化检测取出4%多聚甲醛固定的心脏组织,分离出心房部分,石蜡包埋并切片。进行Masson染色,切片脱蜡至水,依次用Weigert铁木素、丽春红酸性品红、磷钼酸、甲苯胺蓝染色,无水乙醇脱水,二甲苯透明,中性树胶封固。马松三色染色试剂盒购自上海博谷生物科技有限公司。
观察心房纤维化程度的改变,心肌胶原纤维染成蓝色,肌肉组织染成红色。并运用计算机图像分析处理系统照相,用image-pro plus 6.0软件定量计算胶原含量,每张切片随机选取5个视野进行胶原容积分数的测量,胶原容积分数=胶原总面积/图像总面积,取其均值记为胶原容积分数。
1.7 统计学分析应用SPSS 17.0统计软件进行分析,计量资料以x±s表示,计数资料以百分比表示,两组间比较计量资料采用t检验,计数资料采用卡方检验,检验水准α=0.05。
2 结果 2.1 大鼠房颤诱发情况两组共20只大鼠均顺利完成实验,对照组大鼠均未出现房颤发作。房颤组每只大鼠给予10次电刺激,共刺激100次,成功诱发出房颤发作96次,房颤诱发率为96%,持续时间为(45.52±60.88) s,最短房颤发作持续时间为10 s,最长持续时间为470 s。
2.2 大鼠房颤诱发前后心电图表现房颤组大鼠经食道快速心房起搏刺激后,均出现典型大鼠房颤心电图:p波消失,出现f波,R-R间期不等,对照组大鼠均表现为正常时的窦性心律(图 1)。
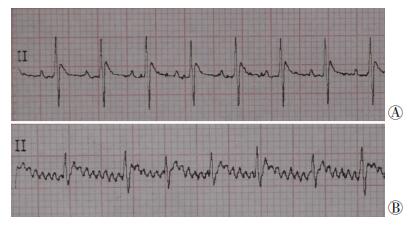
|
| A:大鼠正常窦性心律时心电图;B:大鼠房颤发作时心电图 图 1 大鼠房颤诱发前后心电图表现 |
2.3 两组大鼠心电指标的变化及比较
房颤组大鼠经食道快速心房起搏后,心率明显加快,由正常时的(159.63±18.25)次/min增加至(203.24±33.56)次/min。同时,与对照组比较,房颤组的QRS间期、QT间期均明显延长,差异均有统计学意义(P < 0.05,图 2)。
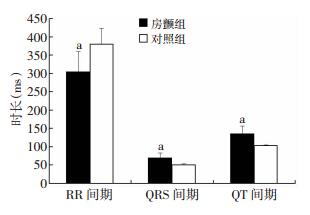
|
| a:P < 0.05,与对照组比较 图 2 SD大鼠房颤组和对照组RR、QRS及QT间期的比较 |
2.4 房颤大鼠心房组织纤维化程度的变化
经Masson染色后,房颤组心房组织纤维化程度明显较对照组严重(蓝染越多代表纤维化程度越严重,图 3)。同时,胶原容积分数测量发现,房颤组胶原容积分数较对照组升高,差异有统计学意义[(18.15±9.45)% vs (6.51±4.49)%,P < 0.01]。

|
| 图 3 房颤组(A)与对照组(B)心房组织Masson染色观察(×100) |
2.5 房颤大鼠血浆中IL-17A、CRP浓度的变化
运用酶联免疫吸附法分别于实验开始前,第5、10天实验后测定房颤组及对照组大鼠血浆中IL-17A、CRP水平,结果发现,随着时间的推移及刺激次数的增多,房颤组大鼠血浆中IL-17A和CRP浓度均有上升的趋势,与房颤诱发前比较,差异均有统计学意义(P < 0.05),但第10天与第5天相比,血浆中这两种细胞因子的浓度差异无统计学意义(图 4、5),对照组大鼠血浆中IL-17A及CRP浓度随时间无明显变化(P>0.05)。
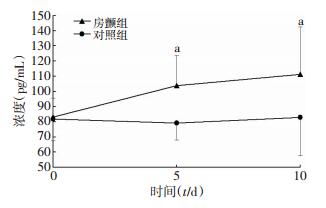
|
| a:P < 0.05,与对照组比较 图 4 两组大鼠血浆中IL-17A浓度随时间的变化 |

|
| a:P < 0.05,与对照组比较 图 5 两组大鼠血浆中CRP浓度随时间的变化 |
3 讨论
目前,许多学者认为,折返形成是心律失常的主要原因之一,是电传导过程中形成了大量的折返转子,导致心肌收缩不同步,有效不应期的离散度增加,从而最终导致心律失常[9]。根据此原理,已成功建立房颤动物模型的方法主要有经食道快速心房起搏[10-12]和经颈静脉心房起搏[8]等。国际上目前运用得比较成熟的造模方法为经食道快速心房起搏,我们在Haugan和Sugiyama等[10, 12]的方法基础上,以戊巴比妥钠代替精神抑制麻醉药组合(枸橼酸芬太尼+氟阿尼酮+咪达唑仑)进行腹腔注射麻醉大鼠,简化麻醉过程并省略“窒息”一步,同时气管插管过程由自制导管在可视状态下经口中插入气管,无需气管切开,为大鼠的后续存活及反复诱发房颤提供保障,接着以设定好的刺激条件经食道快速起搏大鼠心房建立阵发性房颤动物模型。这种方法操作简单,耗费时间短,诱发成功率高,重复操作性强,为后期研究房颤的早期病变及其机制研究提供稳定的动物模型基础。本研究中,通过食道调搏电极对大鼠心房局部进行高频电刺激,诱发出时长>1 s的房颤,成功率为96%,成功率较高。
目前公认,房颤的发生需要触发因素和维持因素,异位局灶的快速冲动发放是房颤发生的触发因素,而心房重构是房颤得以持续存在的维持因素。心房重构主要包括电重构和结构重构[13]。心房间质纤维化及心房扩大是结构重构的重要特征,心房纤维化增加心肌组织电兴奋的离散度,有利于形成折返,而扩大的心房可容纳更多的折返子波数,心房结构重构和电重构共同促进房颤的发生和维持[14]。本研究通过食道对心房进行快速起搏诱发房颤发作,电刺激可能导致了心房结构发生变化,Masson染色结果显示,通过电刺激后,大鼠心房纤维化明显加重,这与Fu等[15]的研究结果一致。本研究还显示胶原容积分数也明显升高,提示可能通过电刺激,心房结构发生重构,进而引发心房纤维化,继而引起房颤发生,为后续房颤的机制研究提供了科学基础。
早在1997年,Frustaci等[16]对房颤患者的心脏组织活检时就发现了炎症反应在房颤中的重要作用。循环系统高水平的CRP可能与心肌细胞膜上的相应受体结合,直接参与局部组织的炎症反应,对心肌细胞造成伤害,形成间质纤维化而在心脏结构重构中起作用[17]。另有研究发现,房颤患者CRP水平较无房颤者高,且持续性房颤患者CRP水平较阵发性房颤更高[18]。随房颤CRP水平升高,房颤复发风险明显增高[19]。本研究进一步运用动物模型来验证房颤发生时血中CRP浓度的变化,结果证实CRP水平较对照组有显著升高,且随房颤发生次数的增多有上升趋势,这些证据都提示CRP参与房颤的发生与维持。目前房颤患者心房结构重塑与炎症反应之间的关系尚未完全明确,有研究认为,房颤时的快速心率可能导致心肌细胞钙超载,并使心房肌细胞凋亡,CRP可能作为调理素黏附于心房肌细胞并参与凋亡细胞的清除,导致局部炎症反应及补体激活,此后心肌细胞的缺失由纤维组织填补,造成纤维化[6]。CRP与房颤心房纤维化的关联值得进一步深入研究。
辅助性T细胞17(T helper cell, Th17)是2005年由Park[20]和Harrington[21]分别发现的,因其特异性分泌IL-17而得名。Th17细胞被证明是一群重要的介导炎症反应的细胞[22-23]。IL-17为一个细胞因子家族,其成员包括IL-17A、B、C、D、E和F,Th17细胞的特征性效应因子主要为IL-17A,也是重要的促炎因子[22-23]。近年来研究发现,Th17/IL-17在多种心血管疾病,包括动脉粥样硬化、急性冠状动脉综合征、慢性心力衰竭以及病毒性心肌炎的发生发展中,均发挥了重要的作用[24-27]。但是,IL-17A与房颤发生发展相关的研究证据尚较少,目前仅有一项动物实验发现IL-17A可能通过调节炎症反应的发生及心房组织纤维化来导致术后房颤的发生发展[15]。本研究运用心房快速起搏诱导房颤动物模型,比较了房颤组与对照组血浆中IL-17A水平,发现房颤组IL-17A浓度较对照组显著升高,且随房颤发生次数的增多有上升趋势,进一步证实IL-17A可能在房颤的发生发展中有作用。
本研究通过大鼠房颤模型初步研究了炎症因子CRP及IL-17A与房颤的关联性,并发现房颤发生过程中纤维化程度的改变,为后续Th17相关因子及炎症因子在房颤中的作用和机制研究奠定了基础。但是,本研究也存在一定的局限性。首先,关于CRP及IL-17A与房颤发生的因果关系,本研究无法得到证实;其次,本研究并没有探讨炎症因子的水平与心房纤维化程度之间的关系,这个将会在后面更大样本量的实验中进行验证。
综上,本研究运用经食道快速心房起搏的方法成功建立了大鼠房颤模型,为后期研究房颤的早期病变及其机制提供稳定的动物模型基础。本研究也发现炎症因子CRP及IL-17A水平在房颤组也有明显的升高;同时,房颤发生过程中心房纤维化程度有明显的改变,为后续深入探讨房颤的发生机制提供了新的思路。
| [1] | January C T, Wann L S, Alpert J S, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society[J]. J Am Coll Cardiol,2014, 130 : 2071 –2104. DOI:10.1161/CIR.0000000000000040 |
| [2] | Passman R, Bernstein R A. New Appraisal of Atrial Fibrillation Burden and Stroke Prevention[J]. Stroke,2016, 47 (2) : 570 –576. DOI:10.1161/STROKEAHA.115.009930 |
| [3] | Chen L Y, Shen W K. Epidemiology of atrial fibrillation: a current perspective[J]. Heart Rhythm,2007, 4 (3Suppl) : S1 –S6. DOI:10.1016/j.hrthm.2006.12.018 |
| [4] | 张荣君, 李源, 黄卫斌. 心房纤颤动物模型制作方法现状及展望[J]. 实用心脑肺血管病杂志,2010, 18 (11) : 1737 –1739. DOI:10.3969/j.issn.1008-5971.2010.11.122 |
| [5] | 官莉, 宫原, 陈世雄. IL-17生物学效应与临床研究进展[J]. 现代免疫学,2013, 34 (2) : 171 –173, 159. |
| [6] | 戴天医, 罗太阳, 何怡华, 等. 犬房颤模型心房纤维化对心房重塑和炎症水平的影响[J]. 第三军医大学学报,2013, 35 (22) : 2409 –2414. DOI:10.16016/j.1000-5404.2013.22.013 |
| [7] | 陈春林, 巩甜甜, 汤依群, 等. SD大鼠房颤模型的建立[J]. 实验动物科学,2009, 26 (3) : 1 –4. |
| [8] | Xu D, Murakoshi N, Tada H, et al. Age-related increase in atrial fibrillation induced by transvenous catheter-based atrial burst pacing: an in vivo rat model of inducible atrial fibrillation[J]. J Cardiovasc Electrophysiol,2010, 21 (1) : 88 –93. DOI:10.1111/j.1540-8167.2009.01591.x |
| [9] | 陈唐葶, 李涛, 李妙龄, 等. 心房快速起搏致豚鼠房颤模型建立及心房肌动作电位的改变[J]. 泸州医学院学报,2012, 35 (6) : 551 –553. DOI:10.3969/j.issn.1000-2669.2012.06.001 |
| [10] | Haugan K, Lam H R, Knudsen C B, et al. Atrial fibrillation in rats induced by rapid transesophageal atrial pacing during brief episodes of asphyxia: a new in vivo model[J]. J Cardiovasc Pharmacol,2004, 44 (1) : 125 –135. DOI:10.1097/00005344-200407000-00017 |
| [11] | Schrickel J W, Bielik H, Yang A, et al. Induction of atrial fibrillation in mice by rapid transesophageal atrial pacing[J]. Basic Res Cardiol,2002, 97 (6) : 452 –460. DOI:10.1007/s003950200052 |
| [12] | Sugiyama A, Takahara A, Honsho S, et al. A simple in vivo atrial fibrillation model of rat induced by transesophageal atrial burst pacing[J]. J Pharmacol Sci,2005, 98 (3) : 315 –318. DOI:10.1254/jphs.SCJ05002X |
| [13] | Takemoto Y, Ramirez R J, Yokokawa M, et al. Galectin-3 regulates atrial fibrillation remodeling and predicts catheter ablation outcomes[J]. JACC Basic Transl Sci,2016, 1 (3) : 143 –154. DOI:10.1016/j.jacbts.2016.03.003 |
| [14] | Scridon A, Tabib A, Barres C, et al. Left atrial endocardial fibrosis and intra-atrial thrombosis-landmarks of left atrial remodeling in rats with spontaneous atrial tachyarrhythmias[J]. Rom J Morphol Embryol,2013, 54 (2) : 405 –411. |
| [15] | Fu X X, Zhao N, Dong Q, et al. Interleukin-17A contributes to the development of post-operative atrial fibrillation by regulating inflammation and fibrosis in rats with sterile pericarditis[J]. Int J Mol Med,2015, 36 (1) : 83 –92. DOI:10.3892/ijmm.2015.2204 |
| [16] | Frustaci A, Chimenti C, Bellocci F, et al. Histological substrate of atrial biopsies in patients with lone atrial fibrillation[J]. Circulation,1997, 96 (4) : 1180 –1184. DOI:10.1161/01.CIR.96.4.1180 |
| [17] | 兰法定. 心房颤动患者血清C反应蛋白的变化及意义[J]. 中国实用医药,2011, 6 (35) : 46 –47. DOI:10.3969/j.issn.1673-7555.2011.35.024 |
| [18] | Nyrnes A, Njolstad I, Mathiesen E B, et al. Inflammatory biomarkers as risk factors for future atrial fibrillation. An eleven-year follow-up of 6315 men and women: the Troms' study[J]. Gend Med,2012, 9 (6) : 536 –547. DOI:10.1016/j.genm.2012.09.001 |
| [19] | Watanabe E, Arakawa T, Uchiyama T, et al. High-sensitivity C-reactive protein is predictive of successful cardioversion for atrial fibrillation and maintenance of sinus rhythm after conversion[J]. Int J Cardiol,2006, 108 (3) : 346 –353. DOI:10.1016/j.ijcard.2005.05.021 |
| [20] | Park H, Li Z, Yang X O, et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J]. Nat Immunol,2005, 6 (11) : 1133 –1141. DOI:10.1038/ni1261 |
| [21] | Harrington L E, Hatton R D, Mangan P R, et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J]. Nature Immunology,2005, 6 (11) : 1123 –1132. DOI:10.1038/ni1254 |
| [22] | Singh R P, Hasan S, Sharma S, et al. Th17 cells in inflammation and autoimmunity[J]. Autoimmun Rev,2014, 13 (12) : 1174 –1181. DOI:10.1016/j.autrev.2014.08.019 |
| [23] | Romagnani S, Maggi E, Liotta F, et al. Properties and origin of human Th17 cells[J]. Mol Immunol,2009, 47 (1) : 3 –7. DOI:10.1016/j.molimm.2008.12.019 |
| [24] | Taleb S, Tedgui A, Mallat Z. IL-17 and Th17 Cells in Atherosclerosis: Subtle and Contextual Roles[J]. Arterioscler Thromb Vasc Biol,2015, 35 (2) : 258 –264. DOI:10.1161/ATVBAHA.114.303567 |
| [25] | Li Q, Wang Y, Wang Y, et al. Treg/Th17 ratio acts as a novel indicator for acute coronary syndrome[J]. Cell Biochem Biophys,2014, 70 (2) : 1489 –1498. DOI:10.1007/s12013-014-9993-5 |
| [26] | Li N, Bian H, Zhang J, et al. The Th17/Treg imbalance exists in patients with heart failure with normal ejection fraction and heart failure with reduced ejection fraction[J]. Clin Chim Acta,2010, 411 (23/24) : 1963 –1968. DOI:10.1016/j.cca.010.08.013 |
| [27] | Li Z, Yue Y, Xiong S. Distinct Th17 inductions contribute to the gender bias in CVB3-induced myocarditis[J]. Cardiovasc Pathol,2013, 22 (5) : 373 –382. DOI:10.1016/j.carpath.2013.02.004 |



