2. 400016 重庆,重庆医科大学基础医学院, 生物信息学教研室;
3. 400038 重庆,第三军医大学高原军事医学系军事医学地理学教研室;
4. 400016 重庆,重庆医科大学基础医学院, 实验教学中心
2. Department of Bioinformatics, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016;
3. Department of Military Medical Geography, College of High Altitude Military Medicine, Third Military Medical University, Chongqing, 400038, China;
4. Experimental Teaching Center, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016
糖尿病肾病(diabetic nephropathy,DN)是糖尿病主要的微血管并发症之一,已成为导致终末期肾功能衰竭的重要原因,严重影响糖尿病患者的预后和生存。DN进展的重要特征是系膜细胞(mesangial cells, MCs)增殖、细胞外基质堆积、基底膜增厚、系膜区扩张,从而发展为肾小球硬化。其早期以系膜细胞增殖、细胞外基质增生为代表的肾小球系膜病变是DN最突出的病理改变之一[1-2]。DN的发病机制十分复杂,涉及到细胞增殖、糖脂代谢紊乱、血流动力学异常、炎症介质释放、细胞因子以及氧化应激等多因素的作用,但具体机制仍不完全清楚[3-6]。
长链非编码RNA (long non-coding RNA, lncRNA)是一类位于细胞核或胞质内长度超过200个核苷酸的基因转录产物。既参与表观遗传、可变剪接、入核转运等过程,也能以细胞微结构原件、小RNA前体等发挥功能[7]。近年,大量研究证实lncRNAs在癌症、糖尿病及其并发症等多种疾病中表达异常[8-15]。本课题组前期通过二代测序筛选出糖尿病肾病小鼠肾脏组织中呈明显差异表达的lncRNAs,其中Gm4419较正常肾脏组织上调水平最高。本实验以Gm4419为研究对象,在糖尿病肾病小鼠肾脏组织和高低糖培养的肾小球系膜细胞中检测其表达水平,进一步构建Gm4419小干扰RNA (small interfering RNA, siRNA)和pcDNA3.1(+)-Gm4419过表达质粒,转染肾小球系膜细胞,检测Gm4419对细胞增殖能力和纤维化的影响。
1 材料与方法 1.1 仪器及试剂PCR扩增仪、CFX96 PCR仪、流式细胞仪和酶标仪(Bio-Rad);pcDNA3.1(+)表达载体、宿主菌E. coli DH5α和脂质体Lipofectamine 3000 (Invitrogen);总RNA提取试剂Trizol、逆转录试剂盒、DNA Marker和SYBR®Premix Ex TaqTMⅡ(大连宝生物);兔抗Ⅳ型胶原蛋白(fibronectin, FN)、纤粘连蛋白(collagen Ⅳ, Col. Ⅳ)抗体(Bioword);兔抗GAPDH抗体、RIPA裂解液和PMSF (碧云天);DMEM培养基(HyClone);澳洲特级胎牛血清(上海生工生物);lncRNA原位荧光杂交(fluorescent in situ hybridization, FISH)探针试剂盒和EdU细胞增殖检测试剂盒(广州锐博生物);DNA纯化回收试剂盒和去内毒素质粒提取试剂盒(Omega);山羊抗兔IgG抗体(北京中杉金桥),ECL显色试剂盒(Millipore);限制性内切酶BamHⅠ和EcoRⅤ (Fermentas);山羊抗兔IgG-FITC二抗(武汉博士德生物)。
1.2 pcDNA3.1(+)-Gm4419真核表达质粒构建参考Ensembl的小鼠Gm4419基因序列,用Primer premier 5.0设计引物,并根据pcDNA3.1(+)载体多克隆位点,在上下游引物分别加入BamHⅠ和EcoRⅤ位点(下划线标记),用BLAST软件分析引物的特异性,对Gm4419的全长序列进行扩增。引物序列:上游引物5′-GGGGATCCGGCTTTCGACCTCCGAGGCTGCGAC-3′,下游引物5′-TTGATATCACAACATTTGTGGTAGAGGTTAAACGGATATC-3′。提取系膜细胞总RNA,并逆转录成cDNA,利用cDNA末端快速扩增法(rapid amplification of cDNA ends, RACE)扩增小鼠Gm4419的全长序列。取2 μL扩增产物进行琼脂糖凝胶电泳分析,大小约为1 741 bp,并纯化回收PCR产物,测序结果证实与模板序列一致。将PCR产物用BamHⅠ和EcoRⅤ 37 ℃双酶切1 h,T4 DNA连接酶16 ℃过夜连接入pcDNA3.1(+)真核表达载体,连接产物转化E. coli DH5α感受态细胞,将100 μL已转化的感受态细胞转移到AMP+(100 μg/mL)的固体LB琼脂糖培养基上,挑取阳性单克隆37 ℃,250 r/min振荡过夜后,用质粒提取试剂盒提取质粒进行PCR、单双酶切鉴定并测序。通过BLAST比对,扩增的目的基因片段序列与Ensembl上公布的小鼠Gm4419基因序列的同源性为100%,说明目的基因和表达载体pcDNA-3.1(+)-Gm4419真核表达质粒构建成功。构建正确的pcDNA3.1(+)-Gm4419质粒扩大培养,用去内毒素质粒提取试剂盒抽提质粒,同时构建空载体作为对照组。
1.3 设计合成Gm4419小干扰RNA参考Ensembl上公布的小鼠Gm4419基因序列通过Oligo软件设计出3条siRNA,序列如下:No.1: 5′-CCUACCGGACUCAAAGAAUTT-3′;No.2: 5′ -CCCGGU-GUUAUUUCUGGAATT-3′;No.3: 5′ -CCCUAAAUUAGAGCAGCAATT-3′, 并由上海生工生物有限公司合成。3条siRNA干扰效率通过荧光定量PCR测定。
1.4 系膜细胞培养及转染小鼠肾小球系膜细胞株购于中国科学院细胞库,以含5.5 mmol/L葡萄糖加入19.5 mmol/L甘露醇的DMEM培养基模拟正常生理环境,并命名为低糖组。以含25 mmol/L葡萄糖的DMEM培养基模拟糖尿病状态下的生理环境,并命名为高糖组。本实验将高糖组进一步分为高糖mock组(在转染过程中仅加脂质体Lipofectamine 2000)、高糖对照组和高糖Gm4419 knockdown组(转染Gm4419 siRNA);低糖组进一步分为低糖mock组(在转染过程中仅加脂质体Lipofectamine 3000)、低糖对照组(仅转染空载体)和低糖Gm4419组(转染Gm4419过表达质粒)。取对数生长期的系膜细胞,以每孔5.5×105个细胞接种于6孔板,每组设3个平行孔, 在含5% CO2、37 ℃的孵箱中培养,按脂质体Lipofectamine 3000或者Lipofectamine 2000转染试剂操作手册进行转染,在转染后4~6 h更换新鲜培养基根据实验需求培养24 h或者48 h。用荧光定量PCR检测转染效率。
1.5 荧光定量PCR检测Gm4419的表达按Trizol试剂说明书提取细胞总RNA。用酶标仪检测RNA的浓度和纯度。总RNA逆转录反应体系按逆转录试剂盒说明书进行,经37 ℃ 15 min,85 ℃ 5 s,逆转录合成cDNA。利用Primer premier 5.0软件设计小鼠Gm4419引物, 进一步用在线软件BLAST分析引物特异性,并由美国Invitrogen公司合成。Gm4419:上游引物5′-GGAACCAAGCAGACCGAAGAC-3′,下游引物5′-CCCCAACCCACAGGAACATAA-3′;β-actin:上游引物5′-GGCTGTATTCCCCTCCATCG-3′,下游引物5′-CCAGTTGGTAACAATGCCATGT-3′。以cDNA为模板对Gm4419基因的编码区扩增,扩增反应体系终体积为10 μL,包含SYBR®Premix Ex TaqTMⅡ 5 μL,cDNA 1 μL (100 ng),上、下游引物各0.8 μL和ddH2O 3.2 μL,每个检验指标设3个平行复孔。扩增条件为:95 ℃预变性3 min,95 ℃ 5s、60 ℃ 30 s、72 ℃ 30 s,共39个循环,65 ℃延伸5 s。最终数据用2-ΔΔCT公式分析。
1.6 FISH检测Gm4419细胞定位根据Gm4419荧光FISH探针试剂盒的使用方法进行实验,检测Gm4419在高低糖培养的小鼠系膜细胞中的分布情况。首先用4%多聚甲醛室温固定10 min,然后用含0.5% Triton X-100的预冷PBS冰上通透细胞5 min,PBS清洗后,加入预杂交液,37 ℃预处理细胞30 min。弃去预杂交液后,每孔加入20 μmol/L Cy3标记的Gm4419 FISH探针杂交液,避光,37 ℃杂交过夜。用含0.1% Tween-20的4×SSC 42 ℃清洗细胞3次,每次5 min。随后用2×SSC和1×SSC 42 ℃清洗细胞各5 min。最后,每孔加入10 μL DAPI工作液,室温静置10 min,采用激光共聚焦显微镜进行图像获取并用LAS AF Lite软件进一步分析。
1.7 EdU检测细胞增殖能力将系膜细胞以每孔1.5×105个细胞接种于24孔板中。转染后24 h,按EdU细胞增殖检测试剂盒步骤进行EdU标记、细胞固定、Apollo染色、DNA染色,最后共聚焦显微镜进行图像获取。
1.8 Western blot检测纤维标记因子的蛋白表达收集转染48 h后的系膜细胞,离心沉淀后按100:1的比例加入RIPA裂解液和PMSF冰上裂解30 min,期间每间隔5 min漩涡振荡15 s,15 000 r/min离心30 min,收集上清液。按1:5的比例混合SDS-PAGE蛋白上样缓冲液和上清液,并100 ℃,10 min使蛋白变性。SDS-PAGE后,转膜,分别加入兔抗Col.Ⅳ抗体(1:500稀释)、兔抗FN抗体(1:500稀释)和兔抗GAPDH抗体(1:1 000稀释),4 ℃过夜,TBST洗PVDF膜3次后,加入辣根酶标记山羊抗兔lgG (1:8 000稀释),室温摇床孵育2 h,ECL显色,以GAPDH抗体作为内参。
1.9 统计学分析实验数据用SPSS 17.0软件进行数据处理,以x±s表示。3组之间数据比较采用单因素方差分析,两组数据比较采用t检验,检验水准α=0.05。
2 结果 2.1 Gm4419在db/db小鼠肾脏组织和高糖培养的系膜细胞中高表达我们前期二代测序结果发现lncRNA在糖尿病肾病模型db/db小鼠肾脏组织中较正常对照呈异常表达,其中Gm4419在糖尿病肾脏组织中显著上调。本实验进一步通过荧光定量PCR在糖尿病肾病小鼠模型(db/db)肾脏组织和高糖培养的肾小球系膜细胞中验证Gm4419的表达。如图 1所示,与正常对照组或低糖组比较,Gm4419在糖尿病肾病疾病组或高糖组中呈高表达(P < 0.01)。
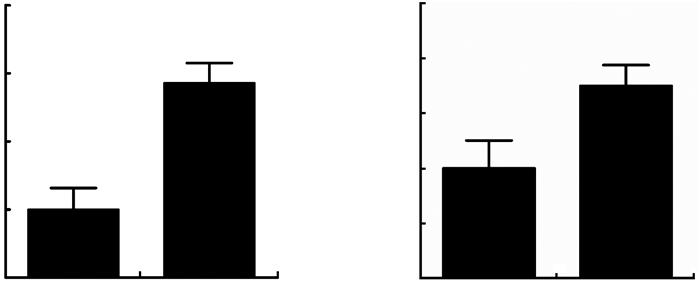
|
| A:荧光定量PCR检测Gm4419在糖尿病肾病小鼠模型肾脏组织中的表达1:正常对照组;2:糖尿病肾病疾病组;B:荧光定量PCR检测Gm4419在系膜细胞中的表达1:低糖组;2:高糖组a: P < 0.01,与正常对照组比较;b: P < 0.01,与低糖组比较 图 1 Gm4419在肾脏组织和系膜细胞中的表达 |
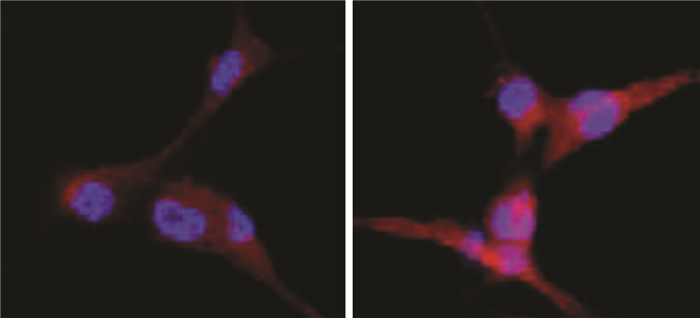
2.2 Gm4419定位于系膜细胞胞质
FISH显示Gm4419主要定位在系膜细胞的细胞质,此外,与高糖组相比,Gm4419在低糖组表达较弱(图 2)。
|
| A:低糖组;B:高糖组 图 2 FISH检测Gm4419(红色)在系膜细胞中的定位(× 800) |
2.3 Gm4419过表达质粒和knockdown的构建及验证
系膜细胞总RNA的反转录PCR产物经1%琼脂糖凝胶电泳检测,可见一大小约1 741 bp的条带,该条带相对分子质量与Gm4419基因扩增长度一致。经BamHⅠ和EcoRⅤ双酶切验证(图 3A)和测序验证(图 3B),Gm4419过表达质粒构建成功。如图 3C所示,荧光定量PCR验证Gm4419过表达质粒能够显著上调Gm4419的表达(P < 0.01)。此外,荧光定量PCR验证3条Gm4419 siRNA,结果显示高糖Gm4419 knockdown 1组沉默效率最佳(P < 0.01), 所以选择高糖Gm4419 knockdown 1组的siRNA进行后续实验(图 3D)。
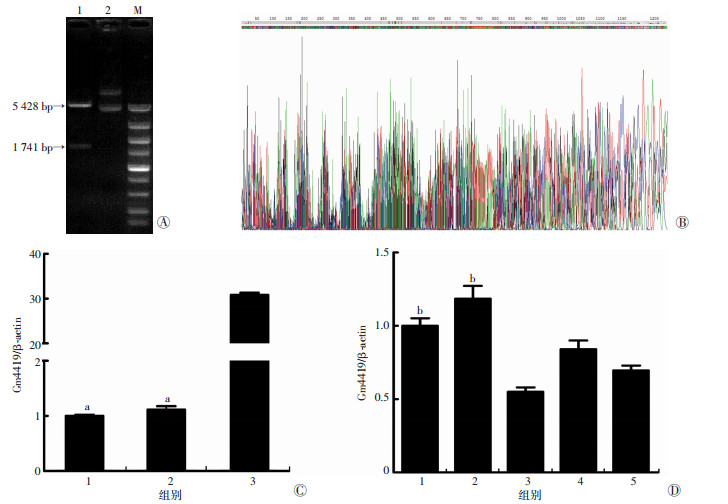
|
| A:酶切电泳结果1:BamHⅠ和EcoRⅤ酶切质粒;2:质粒DNA;M:DNA marker;B:测序图;C:荧光定量PCR检测过表达Gm4419后各组Gm4419的表达1:低糖mock组;2:低糖对照组;3:低糖Gm4419组;a: P < 0.01,与低糖Gm4419组比较;D:荧光定量PCR检测knockdown Gm4419后各组Gm4419的表达1:高糖mock组;2:高糖对照组;3:高糖Gm4419 knockdown 1组;4:高糖Gm4419 knockdown 2组;5:高糖Gm4419 knockdown 3组;b: P < 0.01,与高糖Gm4419 knockdown 1组比较 图 3 Gm4419过表达质粒和knockdown的构建及验证 |
2.4 Gm4419促进系膜细胞增殖
EdU (图 4)显示, 与低糖mock组和低糖对照组比较,低糖Gm4419组细胞增殖被促进;相反,高糖Gm4419 knockdown组细胞增殖与高糖mock组及高糖对照组相比明显被抑制。表明Gm4419对系膜细胞增殖具有促进作用。

|
| 图 4 EdU检测过表达及沉默Gm4419各组系膜细胞增殖能力(×200) |
2.5 Gm4419促进系膜细胞纤维化
如图 5所示,Western blot显示低糖Gm4419组Col.Ⅳ和FN的蛋白水平与低糖mock组及低糖对照组相比均显著升高。反之,与高糖mock组和高糖对照组比较,高糖Gm4419 knockdown组纤维标记蛋白Col.Ⅳ和FN的蛋白水平均显著降低;这说明Gm4419对系膜细胞的纤维化具有促进作用。
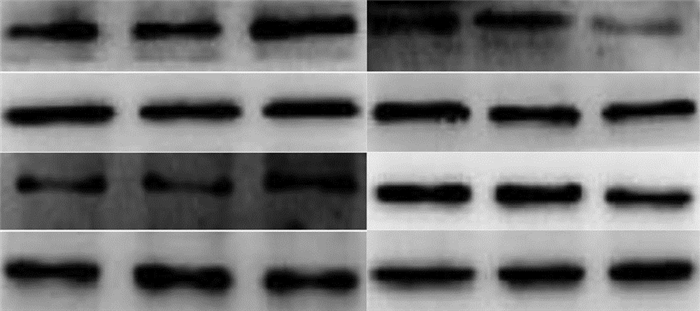
|
| 1:低糖mock组;2:低糖对照组;3:低糖Gm4419组;4:高糖mock组;5:高糖对照组;6:高糖Gm4419 knockdown组 图 5 Western blot检测过表达及沉默Gm4419各组Col.Ⅳ和FN的蛋白表达 |
3 讨论
研究证明微小RNA (microRNA, miRNA)参与了糖尿病肾病的发生、发展[16],但作为复杂调控网络中的新成员lncRNA,在糖尿病肾病领域中的研究尚属起步阶段。近年来研究显示,lncRNA的异常表达参与了糖尿病肾病肾小球系膜纤维化和增生[17-20]。Wang等[17]研究发现lncRNA-ENSMUST00000147869在糖尿病肾脏组织中表达上调,沉默其表达后,系膜细胞增殖和纤维化明显增强。研究还发现lncRNA-CYP4B1-PS1-001在早期糖尿病肾病中显著下调,过表达其表达后,显著抑制了系膜细胞增殖和纤维化[18]。此外, lncRNA-PVT1在高糖处理的人系膜细胞中表达显著上调,同时FN、Col.Ⅳ和TGF-β1的基因和蛋白水平也上升, 然而PVT1敲除显著降低各种细胞外基质(extracellular matrix,ECM)成分的基因和蛋白水平[19-20]。研究提示lncRNA的异常表达在糖尿病肾病系膜增生和纤维化的发生和发展中扮演着重要角色。因此lncRNA是一种非常有前景的新型糖尿病肾病诊断和预后分子生物标志物。
为了进一步研究lncRNA与糖尿病肾病之间的关系,本实验在前期二代测序发现在糖尿病肾病模型小鼠肾脏中异常表达的lncRNAs的基础上,进一步探寻其中在糖尿病肾病模型小鼠肾脏上调水平最高的lncRNA-Gm4419在高糖培养的肾小球系膜细胞中的生物学功能。Gm4419是一个基因间的长链非编码RNA (long intergenic noncoding RNA, lincRNA), 它定位在12号染色体(Chr12: 21417911-21419803),长度为1 730 bp。迄今为止,在任何疾病中均未见到Gm4419的相关报道。本实验运用荧光定量PCR证实了糖尿病肾病小鼠肾脏组织或高糖系膜细胞中lincRNA-Gm4419的表达明显高于正常小鼠肾脏组织或低糖系膜细胞,提示Gm4419与糖尿病肾病的发展密切相关,是一个新的糖尿病肾病相关的lncRNA。
lncRNA发挥不同的功能主要依赖于它的细胞定位,若分布于细胞核,主要参与转录、染色质重塑等过程;若分布于细胞质,主要参与ceRNA (competing endogenous RNAs, ceRNA),与蛋白形成复合物等参与基因调控[21-22]。FISH显示Gm4419主要定位于系膜细胞的胞质,提示Gm4419主要发挥基因调控作用,为后续Gm4419的深入研究提供基础。
随后,我们成功合成Gm4419 siRNA和构建pcDNA 3.1(+)-Gm4419过表达质粒,将Gm4419 siRNA转染至高糖的系膜细胞中,pcDNA3.1(+)-Gm4419过表达质粒转染至低糖的系膜细胞中,荧光定量PCR显示其能在系膜细胞中沉默或高表达Gm4419的表达,为后续功能学研究提供了良好的工具。
本研究进一步运用EdU细胞增殖法检测Gm4419对高低糖系膜细胞增殖能力的调控作用。结果显示,在高糖培养的系膜细胞增殖能力较低糖组高,但沉默Gm4419后其细胞增殖能力显著下降(P < 0.05);反之,在低糖组过表达Gm4419后,其细胞增殖能力明显增高(P < 0.05)。由此提示,Gm4419可调控系膜细胞增殖,可能参与DN的系膜增生。此外,我们运用Western blot检测肾脏纤维化标记蛋白Col.Ⅳ和FN在高低糖系膜细胞中的表达。结果显示,高糖组Col.Ⅳ和FN表达水平均高于低糖组,但沉默Gm4419后其表达水平显著下降(P < 0.05);反之,在低糖组过表达Gm4419后,Col.Ⅳ和FN表达水平均显著增加(P < 0.05)。结果提示,Gm4419可影响系膜细胞纤维化,可能参与DN的肾脏纤维化进程。
综上所述,本研究发现了lincRNA-Gm4419在糖尿病肾病小鼠肾脏组织中异常表达,可调控系膜细胞增殖能力和纤维化标记蛋白的表达,从而引起系膜增生和纤维化等生物学行为,参与糖尿病肾病的发生发展。但其相关机制仍待进一步研究。
| [1] | Sharma K, Zivadeh F N. Hyperglycemia and diabetic kidney disease: The case for transforming growth factor-β as a key mediator[J]. Diabetes,1995, 44 (10) : 1139 –1146. DOI:10.2337/diab.44.10.1139 |
| [2] | Forbes J M, Coughlan M T, Cooper M E. Oxidative stress as a major culprit in kidney disease in diabetes[J]. Diabetes,2008, 57 (6) : 1446 –1454. DOI:10.2337/db08-0057 |
| [3] | Piotrowski D W. Mineralocorticoid receptor antagonists for the treatment of hypertension and diabetic nephropathy[J]. J Med Chem,2012, 55 (18) : 7957 –7966. DOI:10.1021/jm300806c |
| [4] | Wada J, Makino H. Inflammation and the pathogenesis of diabetic nephropathy[J]. Clin Sci,2013, 124 (3) : 139 –152. DOI:10.1042/CS20120198 |
| [5] | Choudhury D, Tuncel M, Levi M. Diabetic nephropathy-a multifaceted target of new therapies[M]. 2010 : 406 -415. |
| [6] | Reidy K, Kang H M, Hostetter T, et al. Molecular mechanisms of diabetic kidney disease[J]. J Clin Invest,2014, 124 (6) : 2333 –2340. DOI:10.1172/jci2271 |
| [7] | Di Gesualdo F, Capaccioli S, Lulli M. A pathophysiological view of the long non-coding RNA world[J]. Oncotarget,2014, 5 (22) : 10976 –10996. DOI:10.18632/Oncotarget.2770 |
| [8] | Zhu M, Chen Q, Liu X, et al. lncRNA H19/miR-675 axis represses prostate cancer metastasis by targeting TGFβ1[J]. FEBS J,2014, 281 (16) : 3766 –3775. DOI:10.1111/febs.12902 |
| [9] | Hirata H, Hinoda Y, Shahryari V, et al. Long Non-coding RNA MALAT1 Promotes Aggressive Renal Cell Carcinoma through Ezh2 and Interacts with miR-205[J]. Cancer Res,2015, 75 (7) : 1322 –1331. DOI:10.1158/0008-5472.CAN-14-2931 |
| [10] | You J, Zhang Y, Liu B, et al. MicroRNA-449a inhibits cell growth in lung cancer and regulates long noncoding RNA nuclear enriched abundant transcript 1[J]. Indian J Cancer,2014, 51 (Suppl 3) : e77 –e81. DOI:10.4103/0019-509X.154055 |
| [11] | Dey B K, Pfeifer K, Dutta A. The H19 long noncoding RNA gives rise to microRNAs miR-675-3p and miR-675-5p to promote skeletal muscle differentiation and regeneration[J]. Genes Dev,2014, 28 (5) : 491 –501. DOI:10.1101/gad.234419.113 |
| [12] | Carter G, Miladinovic B, Patel A A, et al. Circulating long noncoding RNA GAS5 levels are correlated to prevalence of type 2 diabetes mellitus[J]. BBA Clin,2015, 4 : 102 –107. DOI:10.1016/j.bbacli.2015.09.001 |
| [13] | Peng H, Zou L, Xie J, et al. lncRNA NONRATT021972 siRNA Decreases Diabetic Neuropathic Pain Mediated by the P2X3 Receptor in Dorsal Root Ganglia[J]. Mol Neurobiol,2016 . DOI:10.1007/s12035-015-9632-1 |
| [14] | Qiu G Z, Tian W, Fu H T, et al. Long noncoding RNA-MEG3 is involved in diabetes mellitus-related microvascular dysfunction[J]. Biochem Biophys Res Commun,2016, 471 (1) : 135 –141. DOI:10.1016/j.bbrc.2016.01.164 |
| [15] | Li C P, Wang S H, Wang W Q, et al. Long Noncoding RNA-Sox2OT Knockdown Alleviates Diabetes Mellitus-Induced Retinal Ganglion Cell (RGC) injury[J]. Cell Mol Neurobiol,2016 . DOI:10.1007/s10571-016-0380-9 |
| [16] | Kato M, Park J T, Natarajan R. MicroRNAs and the glomerulus[J]. Exp Cell Res,2012, 318 (9) : 993 –1000. DOI:10.1016/J.YEXCR.2012.02.034 |
| [17] | Wang M, Yao D, Wang S, et al. Long non-coding RNA EN-SMUST00000147869 protects mesangial cells from prolife ration and fibrosis induce by diabetic nephropathy[J]. Endocrine,2016 . DOI:10.1007/s12010-016-0950-5 |
| [18] | Wang M, Wang S, Yao D, et al. A novel long non-coding RNA CYP4B1-PS1-001 regulates proliferation and fibrosis in diabetic nephropathy[J]. Mol Cell Endocrinol,2016, 426 : 136 –145. DOI:10.1016/j.mce.2016.02.020 |
| [19] | Alvarez M L, DiStefano J K. Functional characterization of the plasmacytoma variant translocation 1 gene (PVT1) in diabetic nephropathy[J]. PLoS One,2011, 6 (4) : e18671 . DOI:10.1371/journal.pone.0018671 |
| [20] | Alvarez M L, Khosroheidari M, Eddy E, et al. Role of micro RNA 1207-5P and its host gene, the long non-coding RNA Pvt1, as mediators of extracellular matrix accumulation in the kidney: implications for diabetic nephropathy[J]. PLoS One,2013, 8 (10) : e77468 . DOI:10.1371/journal.pone.0077468 |
| [21] | Tsai M C, Manor O, Wan Y, et al. Long noncoding RNA as modular scaffold of histone modification complexes[J]. Science,2010, 329 (5992) : 689 –693. DOI:10.1126/SCIENCE.119-2002 |
| [22] | Martianov I, Ramadass A, Serra Barros A, et al. Repression of the human dihydrofolate reductase gene by a non-coding interfering transcript[J]. Nature,2007, 445 (7128) : 666 –670. DOI:10.1038/nature05519 |



