2. 550004 贵阳,贵州医科大学:儿科学教研室;
3. 550004 贵阳,贵州医科大学:免疫学教研室;
4. 550004 贵阳,贵州医科大学:实验动物中心
2. Department of Pediatrics, Guizhou Medical University, Guiyang, Guizhou Province, 550004, China;
3. Department of Immunology, Guizhou Medical University, Guiyang, Guizhou Province, 550004, China;
4. Laboratory Animal Center, Guizhou Medical University, Guiyang, Guizhou Province, 550004, China
同源盒基因(homeobox gene family)在胚胎发育和造血发育中发挥重要的调节作用,其家族成员hoxb4被认为是造血发育的重要调节因子[1]。已有实验证明hoxb4能够在体内外促进造血干细胞(hematopoietic stem cell,HSC)扩增,增加了HSC自我更新的机率,但又不影响HSC分化成正常的成熟的各系血细胞,但是hoxb4如何调控这一过程,其分子机制并不清楚[2-3]。有研究提示,在爪蟾神经系统中过表达hoxb4可导致rap1基因表达的减弱,下调hoxb4基因使rap1的表达增强,遂得出rap1可能是hoxb4直接调控的下游靶基因[4]。为了进一步明确hoxb4基因是否通过rap1b基因调控胚胎期造血发育,本研究在前期建立的过表达hoxb4转基因斑马鱼[5]上观察rap1b基因的变化,以阐明二者对造血发育的调控作用,为揭示胚胎期造血发育的分子调控机制提供理论依据。
1 材料与方法 1.1 实验动物 1.1.1 饲养方法斑马鱼胚胎置于28.5 ℃的生化培养箱中孵化,每天2次更换egg water,5~7 d开始喂食草履虫,10~14 d开始喂食丰年幼虫。待斑马鱼发育至性成熟,按雌雄3:1比例进行配对,成鱼置于28.5 ℃的自动循环系统饲养,雌雄分开饲养,每日喂食2次丰年幼虫,光照时间为12 h,黑暗12 h,交替进行光照。
1.1.2 鱼系hoxb4转基因斑马鱼系Tg(zLmo2:LDL-hoxb4 -EGFP)为本实验室前期建立的转基因斑马鱼系[5];EGFP转基因斑马鱼系Tg(zLmo2:LDL-EGFP)、Cre转基因斑马鱼系Tg(zLmo2:Cre)由上海交通大学瑞金医院血液病研究所
分为3组:①实验组:为hoxb4转基因斑马鱼系与Cre鱼系交配所得的过表达hoxb4的带有EGFP荧光的胚胎Tg(zLmo2:LDL-hoxb4 -EGFP×zLmo2:Cre)。②实验对照组:为EGFP转基因斑马鱼系与Cre鱼系交配所得的表达EGFP荧光的胚胎Tg(zLmo2:LDL-EGFP×zLmo2:Cre)。③空白对照组:为野生型斑马鱼Tuebingen的胚胎。
1.2 流式分选首先获取实验组和实验对照组(因空白对照组斑马鱼胚胎体内无EGFP荧光,故没有筛选)斑马鱼胚胎受精发育18 h (18 hpf)、24、30、36、48 hpf的胚胎各200枚(未破膜的胚胎要先进行剥膜),将上述胚胎按照不同组不同时相分别研磨,用0.25%的胰酶消化30~40 min,再用FBS终止消化,最后通过BD Falion 40 μm尼龙滤网过滤,制得单细胞悬液,用美国贝克曼库尔特公司的流式细胞分选仪MoFLo XDP在荧光激发下分选出绿色荧光细胞。
1.3 实时荧光定量PCR用TRIzol® Reagent (美国Invitrogen公司)分别提取上述筛选出的两组不同时相细胞的总RNA,将提取的总RNA用First Strand cDNA Synthesis Kit试剂按试剂盒说明书进行反转录合成cDNA。按照IQTM SYBR Green Supermix试剂盒说明的反应体系进行扩增,扩增条件:95 ℃ 15 min;95 ℃ 10 s,59.4 ℃ 20 s,72 ℃ 20 s,40个循环。溶解曲线:每5 s升高0.5 ℃,从65 ℃到95 ℃。以GAPDH、β-actin作为内参基因,对rap1b基因进行相对定量分析。rap1b基因及内参基因GAPDH、β-actin的引物由北京奥维森基因科技公司合成(表 1)。
| 基因 | NCBI序号 | 引物(5′→3′) | 片段长度 (bp) |
| rap1b | ID:321107 | 上游:GCGGGTGGGCACAGAT 下游:GCCGGACCAGGTCATAGAAA |
189 |
| GAPDH | NM_001115114 | 上游:ACCCGTGCTGCTTTCTTGAC 下游:GACCAGTTTGCCGCCTTCT |
91 |
| β-actin | NM_131031 | 上游:ATGCCCCTCGTGCTGTTTT 下游:TCTGTCCATGCCAACCAT |
87 |
1.4 制备rap1b基因的反义mRNA探针
rap1b基因mRNA序列根据UCSC Genome Browser (http://genome.ucsc.edu)检索,并加入EcoRⅠ、BamHⅠ酶切位点以及保护碱基序列,用Primer 5.0软件设计引物,由北京奥维森基因科技有限公司合成,引物序列上游:5′-CGGGATCCATGCGTGAATACAAG-3′,下游:5′-CGGAATTCGAGCAACTGGCAGGT-3′。PCR扩增条件:95 ℃预变性2 min;95 ℃变性30 s,59 ℃退火30 s,72 ℃延伸1 min,共30个循环;最后延伸72 ℃ 10 min,PCR产物大小为554 bp,得到克隆的斑马鱼rap1b基因片段,将得到的rap1b基因片段用EcoRⅠ以及BamHⅠ双酶切后和用同样两种酶切的pCS2+质粒进行T4 DNA连接酶连接重组,然后用测序的方法鉴定重组质粒pCS2+-rap1b,序列比对正确后,将质粒pCS2+-rap1b经EcoRⅠ单酶切线性化,最后体外转录合成地高辛标记的rap1b基因的反义mRNA探针,冻存-80 ℃备用。
1.5 胚胎整体原位杂交收集3组18、24、30、36、48 hpf的胚胎进行原位杂交,每管约30枚胚胎(24 hpf以后的胚胎需用含0.003%PTU的egg water培养,防止色素生成)。使用Fix液固定胚胎,再用甲醇脱水,1×PBST清洗胚胎后用Protease K使胚胎通透,用Hybe (-)杂交液进行预杂交,后加入上述制备的rap1b基因的反义mRNA探针放于65 ℃杂交炉内过夜。用不同浓度梯度的SSC液洗去多余的探针,后加入地高辛抗体过夜,最后加入BCIP/NBT染液进行染色,后将胚胎移入新的EPP管中,再用1×PBST洗涤后用4%的多聚甲醛1 mL固定,在成像系统下采集图像保存。
1.6 统计学分析将Bio-Rad CFX manager 2.0软件自动生成的数据使用SPSS Statistics 20.0进行统计分析,计量资料先进行正态性检验,样品呈正态分布时,采用x±s表示,两两比较使用t检验,检验水准α=0.05。
2 结果 2.1 流式分选细胞选取细胞相对集中的区域进行分析,目的是除去细胞碎片和死亡细胞,图 1A所示R1所圈取的细胞占总细胞数量的63.52%;然后分选出EGFP荧光信号较强的细胞(图 1B),用此方案分别分选出实验组和实验对照组18、24、30、36、48 hpf的细胞,用于后续的实验。
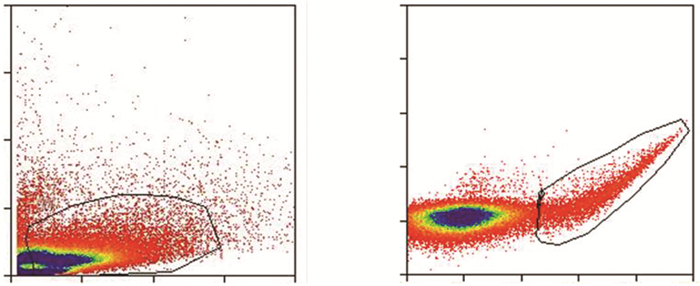
|
| A:细胞内颗粒的大小和多少,R1区域所圈取的细胞用于图B的筛选;B:信号强度,R2所圈取的就是分选出的细胞 图 1 斑马鱼胚胎的单细胞悬液分选图 |
2.2 各组斑马鱼胚胎中的rap1bmRNA的定量分析
斑马鱼β-actin、GAPDH、rap1b基因的溶解曲线均为单峰曲线,说明所扩增的目的基因引物设计良好,在使用所选择的最适温度时,无非特异性产物生成;并且扩增曲线光滑、连续,多次重复,结果较好。由图 2可知实验组和对照组rap1b基因的mRNA表达量在18~36 hpf期间随着胚胎的发育而逐渐增加,在36hpf增加比较明显;48 hpf的rap1b基因的mRNA表达量较前一时相明显减少;同时实验组的30、36、48 hpf斑马鱼胚胎rap1b基因的mRNA表达量均高于对照组(P < 0.05),且36 hpf的差异明显。
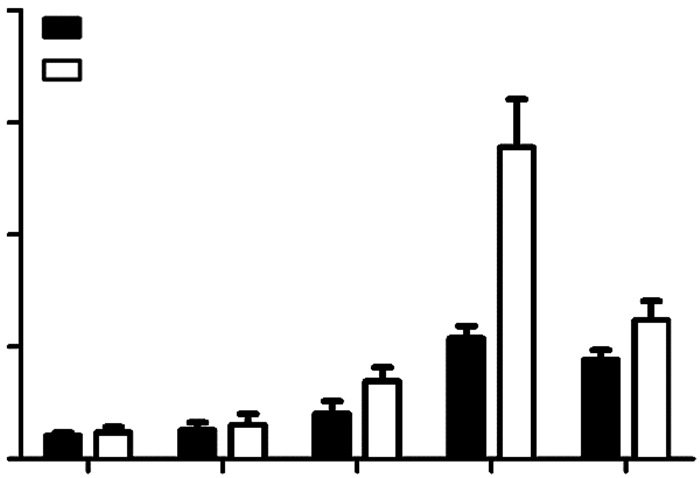
|
| a:P < 0.05,与实验对照组比较 图 2 各组不同时相的斑马鱼rap1b基因mRNA表达变化 |
2.3 斑马鱼rap1b基因PCR结果
将rap1b基因PCR产物经凝胶电泳鉴定,在500~800 bp可见一条特异扩增条带,大小与预期相符(图 3)。

|
| 1:DNA Marker Ⅲ;2:rap1b基因PCR产物 图 3 rap1b基因片段PCR扩增产物电泳鉴定结果 |
2.4 重组质粒pCS2+-rap1b酶切和测序鉴定结果
将重组质粒pCS2+-rap1b经EcoRⅠ以及BamHⅠ双酶切后凝胶电泳,可见两条带,大小分别是554、4 654 bp,与重组质粒pCS2+-rap1b双酶切产物和质粒pCS2+双酶切产物大小相符(图 4)。重组质粒pCS2+-rap1b测序结果与在UCSC上检索到的rap1b基因的mRNA序列完全一致。

|
| 1:DNA Marker Ⅲ;2:质粒pCS2+-rap1b双酶切产物;3:质粒pCS2+双酶切产物 图 4 重组质粒pCS2+-rap1b双酶切产物鉴定结果 |
2.5 斑马鱼早期胚胎发育过程中rap1b的时空表达
采用上述制备的探针对斑马鱼的胚胎进行整体原位杂交,结果见图 5。在18 hpf斑马鱼胚胎中发现rap1b主要在胚胎的中后脑边缘、中间细胞群(intermediate cell mass, ICM)、尾芽表达;在24 hpf斑马鱼胚胎中发现rap1b的表达与18 hpf斑马鱼胚胎中的表达部位相同。随着胚胎的发育,rap1b的表达部位也有所改变,在30 hpf斑马鱼胚胎中发现rap1b的表达主要在后脑边缘、脊索神经系统、后部血岛(posterior blood island, PBI);在36 hpf斑马鱼胚胎中发现rap1b在后脑边缘、脊索神经系统、PBI区有表达,并且在后脑边缘区、脊索神经系统各组之间无显著差异,但在PBI区,过表达hoxb4的斑马鱼胚胎杂交信号明显比对照组增强,在48 hpf斑马鱼胚胎中发现rap1b表达在耳蜗、脊索神经系统、PBI区。

|
| 3组18~48 hpf的斑马鱼胚胎中rap1b基因的原位杂交信号用箭头指出(神经系统用绿色箭头,血液系统用红色箭头);在36 hpf时,实验组造血部位的杂交信号范围和强度明显强于对照组 图 5 各组不同时相的斑马鱼rap1b基因整体胚胎原位杂交结果(FISH ×30 ×40) |
3 讨论
20世纪90年代斑马鱼作为模式生物逐渐被科学研究者所重视,相比较于其他模式生物,其优势在于:体外受精,胚胎透明,繁殖力强(每周可产胚胎200枚左右),在受精后24 h主要器官原基基本形成,成鱼体长3~4 cm,繁殖一代周期2~3个月,经济适用;并且发现斑马鱼基因与人类基因保守度约85%。斑马鱼基因组测序已基本完成,而且胚胎通体透明便于观察,因此斑马鱼常被作为研究造血发育的模式生物[6-8]。
过表达hoxb4能加强HSC的自我更新和增殖的能力,而且未导致血液系统的恶性肿瘤[2],本实验室前期的实验结果也证明了这一点[5]。但关于hoxb4如何平衡HSC的增殖和分化,其中的分子机制先前的报道并未阐述。以往的基因研究分析在不同的发育系统,与hoxb4有关的调控基因有所不同,然而这些研究所确定调控基因有一部分的重叠。本实验就是探究在造血发育过程中与hoxb4相关的调控基因。
rap1是一个很小的GTP结合蛋白(guanosine triphosphatase,GTPase),是Ras超家族中的一员,携带有和Ras相类似的作用区。rap1和其他GTPase一样,与GTP结合后被激活,发挥作用后以无活性的状态存在。作为一个进化保守的蛋白质,研究表明rap1可以通过第二信使在调节细胞的黏连、细胞迁移,细胞极性和细胞的增殖与分化方面都发挥着重要的作用[9-10]。在低等生物体内,仅有一个同源基因rap1在细胞极性的发育中起重要作用,在高等生物体内,同时存在两个高度同源的rap1基因:rap1a和rap1b,这两个编码的亚型基因已经被分离出[11]。敲除其中一个亚型可能会出现局部出血和部分胚胎的死亡,然而敲除其中一个亚型并不影响实验动物的生存寿命,但在免疫应答[12]和造血发育方面有一定缺陷,rap1b基因可以影响心血管的功能[13]、血小板的黏附作用[14]、血管的发生[15],以及血管平滑肌的收缩和血管张力[16]。Gore等[17]研究显示,在内皮细胞连接形成阶段,如果单独敲除rap1b基因,会引起颅内出血;Chrzanowska-Wodnicka等[18]指出rap1a缺陷的小鼠没有明显变化,但是在rap1b缺陷的情况下,小鼠会出现视网膜新生血管的缺失,而且因rap1b缺陷所引起的血管内皮生长因子的下调,导致小鼠体内基底膜基质的入侵和主动脉瓣环的发育缺陷;Dong等[9]用反义寡核苷酸抑制斑马鱼胚胎中的rap1b的表达,胚胎出现心脏的缺陷、躯干弯曲及尾鳍的缺陷、颅内出血。这些实验都证明了rap1b对造血发育有一定的调控作用,但rap1b与hoxb4在造血发育方面的关系并未有报道。
本实验首先通过流式细胞分选技术将斑马鱼胚胎中带有EGFP荧光的细胞分选出来,对过表达hoxb4斑马鱼系和正常表达hoxb4斑马鱼系中的rap1b基因进行相对定量检测。qRT-PCR结果显示实验组和对照组rap1b基因的mRNA表达量在18~36 hpf期间随着胚胎的发育而逐渐增加,在36 hpf增加比较明显,48 hpf的rap1b基因的mRNA表达量较前一时相明显减少;30、36、48 hpf斑马鱼胚胎rap1b基因的mRNA表达量实验组均高于对照组(P < 0.05),且36 hpf的差异明显。然后对3组斑马鱼胚胎以rap1b基因反义mRNA探针整体胚胎原位杂交后,通过显微镜观察,18、24、30 hpf原位杂交信号在中间细胞团和后部造血岛区域都能观测到。这些都是斑马鱼胚胎在造血发育过程主要的造血区域,且原位杂交图片显示36hpf实验组斑马鱼rap1b基因杂交信号在后部造血岛,其表达范围及表达量较其他两对照组明显增多,这都提示rap1b参与了斑马鱼的造血发育,并且在此过程中与hoxb4基因的表达有关。由以上结果可以推论,rap1b基因不仅参与了斑马鱼造血过程的调控,同时它在造血系统中的表达情况与hoxb4基因表达有关。
本实验初步研究了在18~48 hpf期间rap1b基因表达部位与斑马鱼造血发育过程中的造血部位高度一致,并且在过表达hoxb4转基因斑马鱼中rap1b基因表达有明显的升高趋势,提示rap1b基因与hoxb4基因可能共同参与调节早期造血发育过程,这就为进一步研究在造血发育过程中rap1b作为hoxb4下游靶基因的可能性及其相互作用奠定了充实的基础。
| [1] | Yasunaga S, Ohno Y, Shirasu N, et al. Role of Geminin in cell fate determination of hematopoietic stem cells (HSCs)[J]. Int J Hematol,2016, 104 (3) : 324 –329. DOI:10.1007/s12185-016-2060-9 |
| [2] | Jackson M, Ma R, Taylor A H, et al. Enforced Expression of HOXB4 in Human Embryonic Stem Cells Enhances the Production of Hematopoietic Progenitors but Has No Effect on the Maturation of Red Blood Cells[J]. Stem Cells Transl Med,2016, 5 (8) : 981 –990. DOI:10.5966/sctm.2015-0324 |
| [3] | Xin C, Zhao C, Yin X, et al. Bioinformatics analysis of molecular mechanism of the expansion of hematopoietic stem cell transduced by HOXB4/HOXC4[J]. Hematology,2016, 21 (8) : 462 –469. DOI:10.1080/10245332.2015.1101978 |
| [4] | Morsi El-Kadi A S, in der Reiden P, Durston A, et al. The small GTPase Rap1 is an immediate downstream targetfor Hoxb4 transcriptional regulation[J]. Mech Dev,2002, 113 (2) : 131 –139. DOI:10.1016/S0925-4773(02)00047-3 |
| [5] | Shu L P, Zhou Z W, Zhou T, et al. Ectopic expression of Hoxb4a in hemangioblasts promotes hematopoietic development in early embryogenesis of zebrafish[J]. Clin Exp Pharmacol Physiol,2015, 42 (12) : 1275 –1286. DOI:10.1111/1440-1681.12483 |
| [6] | He J H, Gao J M, Huang C J, et al. Zebrafish models for assessing developmental and reproductive toxicity[J]. Neurotoxicol Teratol,2014, 42 : 35 –42. DOI:10.1016/j.ntt.2014.01.006 |
| [7] | Zhang C, Patient R, Liu F. Hematopoietic stem cell development and regulatory signaling in zebrafish[J]. Biochim Biophys Acta,2013, 1830 (2) : 2370 –2374. DOI:10.1016/j.bbagen.2012.06.008 |
| [8] | Rastegar S, Strahle U. The Zebrafish as Model for Deciphering the Regulatory Architecture of Vertebrate Genomes[J]. Adv Genet,2016, 95 : 195 –216. DOI:10.1016/bs.adgen.2016.04.003 |
| [9] | Dong W, Yang Z, Yang F, et al. Suppression of Rap1 impairs cardiac myofibrils and conduction system in zebrafish[J]. PLoS One,2012, 7 (11) : e50960 . DOI:10.1371/journal.pone.0050960 |
| [10] | Azoulay-Alfaguter I, Strazza M, Mor A. Chaperone-mediated specificity in Ras and Rap signaling[J]. Crit Rev Biochem Mol Biol,2015, 50 (3) : 194 –202. DOI:10.3109/10409238.2014.989308 |
| [11] | Zhang H, Chang Y C, Brennan M L, et al. The structure of Rap1 in complex with RIAM reveals specificity determinants and recruitment mechanism[J]. J Mol Cell Biol,2014, 6 (2) : 128 –139. DOI:10.1093/jmcb/mjt044 |
| [12] | Kumar S, Xu J, Kumar R S, et al. The small GTPase Rap1b negatively regulates neutrophil chemotaxis and transcellular diapedesis by inhibiting Akt activation[J]. J Exp Med,2014, 211 (9) : 1741 –1758. DOI:10.1084/jem.20131706 |
| [13] | Chrzanowska-Wodnicka M, White G C 2nd, Quilliam L A, et al. Small GTPase Rap1 Is Essential for Mouse Development and Formation of Functional Vasculature[J]. PLoS One,2015, 10 (12) : e0145689 . DOI:10.1371/journal.pone.0145689 |
| [14] | Szklanna P B, Foy M, Wynne K, et al. Analysis of the proteins associated with platelet detergent resistant membranes[J]. Proteomics,2016, 16 (17) : 2345 –2350. DOI:10.1002/pmic.201500309 |
| [15] | Lakshmikanthan S, Sobczak M, Chun C, et al. Rap1 promotes VEGFR2 activation and angiogenesis by a mechanism involving integrin αvβ3[J]. Blood,2011, 118 (7) : 2015 –2026. DOI:10.1182/blood-2011-04-349282 |
| [16] | Lakshmikanthan S, Zieba B J, Ge Z D, et al. Rap1b in smooth muscle and endothelium is required for maintenance of vascular tone and normal blood pressure[J]. Arterioscler Thromb Vasc Biol,2014, 34 (7) : 1486 –1494. DOI:10.1161/ATVBAHA.114.303678 |
| [17] | Gore A V, Lampugnani M G, Dye L, et al. Combinatorial interaction between CCM pathway genes precipitates hemorrhagic stroke[J]. Dis Model Mech,2008, 1 (4/5) : 275 –281. DOI:10.1242/dmm.000513 |
| [18] | Chrzanowska-Wodnicka M, Kraus A E, Gale D, et al. Defective angiogenesis, endothelial migration, proliferation, and MAPK signaling in Rap1b-deficient mice[J]. Blood,2008, 111 (5) : 2647 –2656. DOI:10.1182/blood-2007-08109710 |



