下尿路症状(lower urinary tract symptoms,LUTS)是泌尿外科的常见临床病症,由于病种多样化、发病原因较复杂,其病理生理学基础尚有待进一步探索。为此,实验动物研究可为进一步认识LUTS的发病机制提供理想的平台[1]。由于啮齿类、灵长类及哺乳类动物的尿路解剖结构及神经支配与人类的泌尿系统具有相似性,在现有研究中已有广泛的运用[2-6]。
对各种LUTS动物模型实施干预后需通过尿动力学及电生理的手段进行检测,主要方法包括:储尿期与排尿期的膀胱压力测定(cystometrography,CMG)、漏尿点压测定(leak point pressure,LPP)及肌电图记录(electromyography,EMG)等[7]。其中,大鼠的CMG与尿道外括约肌肌电图(external urethral sphincter electromyography,EUS EMG)的同步测定是常用检测方法之一,优势在于可同时反映逼尿肌与括约肌的收缩与舒张功能[8]。而小鼠受体积小、手术操作难度高、术后存活率低等因素的影响,这一实验技术尚无研究报道。但小鼠是研究基因敲除与变异的理想动物,并已在LUTS的研究中有广泛涉及[9-10]。因此,在小鼠上建立此方法有着重要的意义。本研究利用小鼠建立膀胱内测压与EUS EMG同步测定的实验方法,并验证该方法的可行性与可靠性。为未来LUTS的实验研究以小鼠作为动物模型奠定基础。
1 材料与方法所有小鼠的使用及手术操作已取得第二军医大学实验动物保护伦理委员会的资格认证。将12只雌性C57BL/6小鼠(年龄约6个月,体质量18~20 g,由第二军医大学实验动物中心提供)麻醉后,通过耻骨上膀胱置管进行CMG和LPP测定,并同步记录EUS EMG信号。完毕后离断双侧阴部神经,再次重复CMG、LPP及EUS EMG测定,以检测肌电图信号的准确性。实验完毕后,通过心脏内注射0.1 mL戊巴比妥使小鼠安乐死。
1.1 双侧阴部神经的识别与离断使用吸入式的2%异氟醚将小鼠完全麻醉后置于俯卧位,备皮、消毒后,在立体显微镜下,用手术刀片在其背部骶髓节段做一长0.5~1.0 cm的正中纵向切口,钝性分离皮下组织,暴露左侧髂骨与骶骨,并用止血钳撑开两者之间的间隙。暴露阴部神经束,用钝头显微分离钳小心将其游离后,用显微解剖剪刀完全剪断阴部神经束。以同样的方法离断右侧阴部神经后,彻底止血并逐层缝合皮下组织与皮肤。
1.2 耻骨上膀胱造瘘为方便而准确地进行膀胱内压力测定,需要进行耻骨上膀胱造瘘,虽然其大致操作步骤与大鼠的造瘘方法相似,但操作更为精细[11]。首先,将处于麻醉状态下的小鼠置于平卧位,备皮、消毒后,用手术刀片在其中下腹部做1 cm的纵行正中切口,逐层分离并暴露膀胱。用显微解剖剪刀在膀胱的顶壁剪开一0.1~0.2 cm的缺口,并置入聚乙烯导管(PE-10)。然后,使用6-0的丝线进行荷包缝合固定导管并封闭缺口。导管的另一头经皮下隧道从小鼠背部穿出,并缝合固定于皮肤。
1.3 CMG、LPP与EUS EMG的测定为保证实验中能检测到高质量的EMG生物信号,实验者需要在一独立、安静而相对封闭的房间内操作,生物信号采集系统应远离其他大功率仪器设备,以免产生电子干扰,若在实验过程中记录到异常信号,则立即停止实验,寻找原因,待完全排除干扰后再继续进行实验。将小鼠中下腹的切口向尾端延长,暴露并用剪刀离断耻骨联合后,暴露尿道。膀胱造瘘的导管远端连接一个压力传感器(P300,Grass Instruments,West Warwick)和1个注射器泵(Model 200,KD Scientific)用于CMG测定。将一铂金平行双击电极(FHC,Bowdoin)小心的放置于尿道外括约肌的位置,并将电极连接至一个生物信号放大系统(Dash 8X,Astro-Med,Inc.)来进行同步尿道外括约肌肌电图的测定。在CMG和EUS EMG的整个测定过程中,移除异氟醚的吸入麻醉,代之以腹腔注射1.2 g/kg的尿烷,以维持排尿与控尿的基本反射[12]。在1 mL/h的室温生理盐水的充盈速度下,通过3~4个自然排尿周期计算出膀胱平均充盈时间,即上一次排尿结束到下一次排尿开始之间的时间间隔(每次排尿后,通过用棉花棒经腹部按压膀胱来清空残余尿以保证每个排尿周期起始时的膀胱内压一致)[13]。LPP测定方法:在平均充盈时间一半的时候,用棉花棒在下腹部给予一个缓慢增加的外界压力,以缓慢增加膀胱内压力,当观察到生理盐水从尿道口漏出的瞬间,迅速撤离此外界给予的压力,导致一个相应的快速降低的膀胱内压[14]。LPP 测试在每只小鼠上重复3~4次,并通过用漏尿瞬间的顶点膀胱压减去基础膀胱压来计算出每个LPP的值。
CMG测定时需记录的参数包括:排尿时的最大膀胱压、排尿收缩的持续时间及最大膀胱容量。对于在排尿过程中所出现的特有的“间断性扑动”EUS EMG信号还需要记录扑动信号的振幅与频率、单次扑动的持续时间及2个扑动信号之间的间隔时间[15]。在LPP检测以及排尿过程中的EUS EMG信号分析方法为:截取测压过程中相对应的EMG数据片段(单个片段时长为0.1 s)用于后续定量分析,将原始数据导入LabChart 7软件(ADInstruments),并依次经过稳定EMG信号的基线,滤过60 Hz和120 Hz的干扰以及一个15 μV临界线的处理,最终得到在基础和顶点膀胱压处的EUS EMG 的平均振幅和频率。
1.4 统计学分析为避免对实验结果产生偏倚,所有数据由实验参与者在不知道实验分组的情况下进行分析的。计量资料数据以x±s表示,采用配对t检验,P<0.05为差异有统计学意义。
2 结果在LPP检测过程中,EUS EMG的振幅[(38.9±8.4 ) vs (111.7±19.4) μV,P<0.001]和频率[(37.6±9.5) vs (142.6±15.0) Hz,P<0.001]较基础膀胱压时有明显的提升,此为小鼠正常防御反射的表现(图 1A)。而EUS EMG信号与防御反射表现在双侧阴部神经离断后几乎完全不能检测到(图 1B),说明所检测到的肌电图信号的真实性。

|
| 灰色长方形分别代表在基础膀胱压与顶点膀胱压处截取的两个1s的数据片段,用于分析该处的压力与EMG信号强度 图 1 双侧阴部神经离断前(A)和离断后(B)的漏尿点压与尿道外括约肌肌电图的同步测定 |
LPP与顶点膀胱压在正常小鼠分别为(16.4±1.2)cmH2O和(26.7±1.7)cmH2O,离断双侧阴部神经后两者显著降低为[(7.4±0.7)cmH2O和(15.9±1.1)cmH2O,P<0.001],而LPP检测前的基础膀胱压力在神经损伤前后差异无统计学意义(P>0.05,图 2A)。
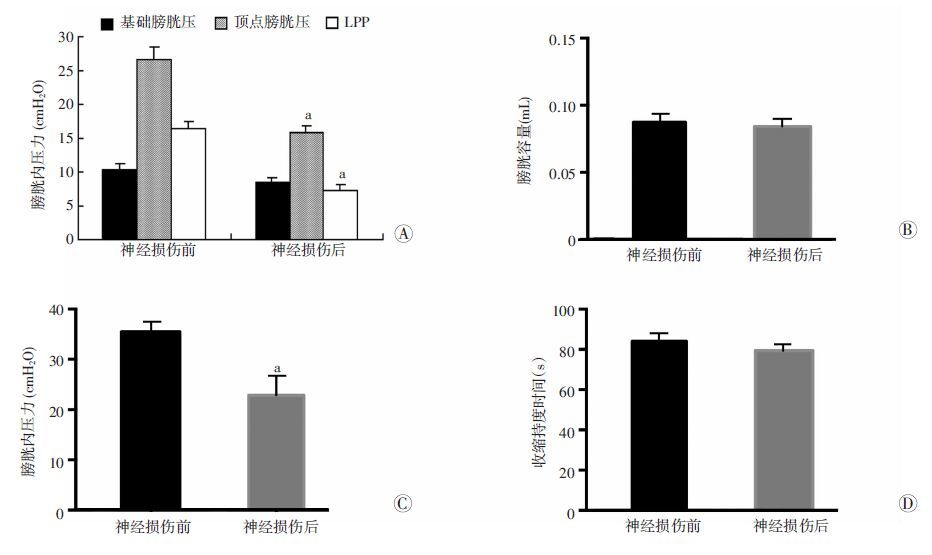
|
| a: P<0.05,与神经损伤前比较 图 2 小鼠双侧阴部神经损伤前后平均漏尿点压(A)、膀胱容量(B)、排尿时的最大膀胱压(C)及排尿收缩持续时间(D)变化 |
将神经损伤前后的相关尿动力学指标做定量分析和比较,发现排尿时的最大膀胱压有显著的降低[从(35.5±2.0)cmH2O下降至(22.8±1.1)cmH2O,P<0.001],但阴部神经离断并未对膀胱容量[损伤前:(0.09±0.01)mL,损伤后:(0.08±0.01)mL,P=0.39]与排尿收缩的持续时间[损伤前:(84.1±4.0) s,损伤后:(79.4±3.1) s,P=0.26]产生明显的影响(图 2B~D)。
在小鼠的排尿期记录到“EUS EMG间断性扑动”的特殊表现(图 3A)。定量分析结果显示,扑动信号的振幅与频率分别为(70.4±15.2)μV 和 (393.8±118.9)Hz,单次扑动的持续时间(85.60±6.2)ms,两个扑动信号之间的间隔时间(222.0±44.2)ms。而这些表现在离断双侧阴部神经后几乎完全不能检测到(图 3B),同样说明所测到的EUS EMG信号的准确性。
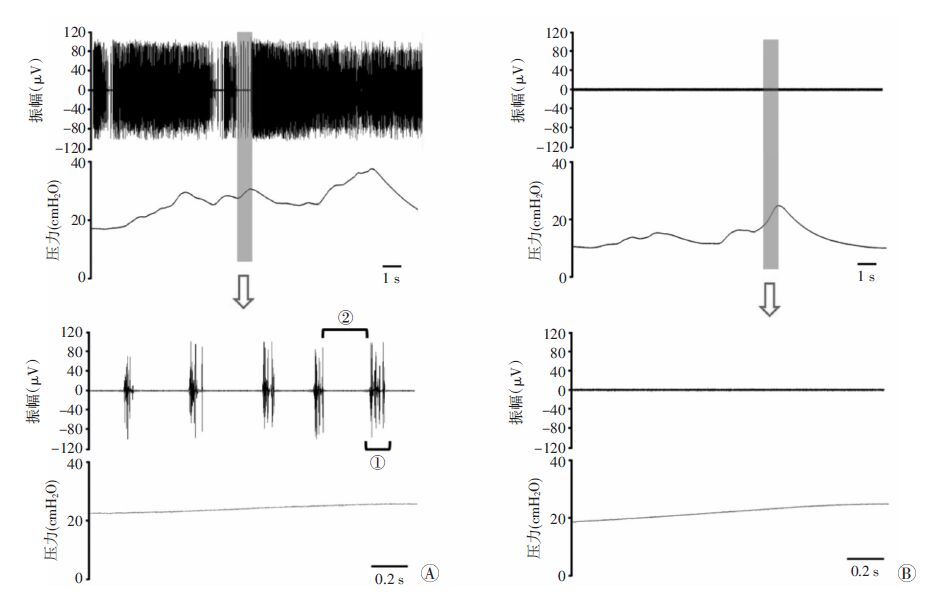
|
| ①:单次扑动信号的持续时间; ②:两个扑动信号之间的间隔时间; 下图为上图灰色长方形区域的放大 图 3 双侧阴部神经离断前(A)和离断后(B)小鼠排尿期出现的EUS EMG“间断性扑动”的现象 |
3 讨论
动物模型研究可有助于进一步认识LUTS的发生机制,并指导和改进其临床诊断及治疗方法。因此,它既是基础研究,更是临床转化研究。在LUTS的动物模型中,以大鼠为基础可建立起脊髓损伤下尿路功能障碍模型、膀胱过度活动症模型、间质性膀胱炎模型及压力性尿失禁模型等[16-21]。在基因改造与疾病相关性研究热门的今天,小鼠的应用尤为重要。为探索1型和2型糖尿病所引起的下尿路功能障碍,现已建立了MON、NZO和ob/ob等基因敲除小鼠模型[3]。另外,小鼠尿路上皮神经生长因子过表达模型可增加膀胱传入神经兴奋性、增加排尿次数并导致储尿期逼尿肌不稳定收缩,而通过敲除香草素受体Ⅰ型基因可缓解逼尿肌不稳定收缩并提高膀胱容量[9]。除此之外,敲除小鼠的尿空斑蛋白基因也可导致储尿期的膀胱逼尿肌不稳定收缩,并增加了残余尿量[22]。这些都说明了基因变异小鼠模型在LUTS的研究中有着广阔的运用前景。
在现有国内外研究中,仅报道了小鼠模型的膀胱压力测定方法,而尚未对其实现膀胱压力与EUS EMG的同步测定,可能的原因是由于小鼠体积小,在手术分离尿道并对其准确定位等方面存在困难[7]。而膀胱压力与EUS EMG的同步测定是LUTS大鼠模型研究中的常用方法之一。它的优点在于能同时反映膀胱逼尿肌与尿道外括约肌的功能、神经支配及协调性。本研究显示,在熟知小鼠解剖结构,并配备显微镜和显微外科手术器械的条件下,能够准确定位并分离小鼠的阴部神经束、膀胱及尿道。因此,我们用小鼠建立了两者同步测定的方法,并通过阴部神经离断术对所检测到电生理信号进行了验证。其机理是尿道外括约肌受阴部神经的支配,离断双侧神经能使小鼠的控尿防御反射减弱,进而导致了漏尿点压降低,EUS EMG减弱或消失[23]。
本实验结果显示,在阴部神经损伤前,尿道外括约肌在储尿期有较强的EMG信号,表现为正常的控尿神经反射,而在离断双侧阴部神经后,尿道外括约肌由于失去了神经支配,EMG信号几乎完全消失,证明检测到了准确的、无明显干扰的EUS EMG信号。另外,在膀胱测压过程中我们发现排尿时的逼尿肌压在双侧阴部神经离断后显著降低,与大鼠模型研究中的结果相近[8]。与大鼠相比较,小鼠的最大膀胱容量较小,但排尿期逼尿肌收缩的持续时间较长[8]。
LPP测定是临床诊断SUI的经典方法,通过咳嗽或Valsalva动作增加患者的腹压,观察尿道口是否有尿液漏出,以了解其控尿能力。在小鼠模型实验中,我们也模拟了这一检查过程,并且在过去的研究中发现对小鼠进行阴道扩张后,LPP出现了显著的降低,说明其控尿功能被削弱[4]。本实验显示,发现与正常小鼠相比,在双侧阴部神经离断后,LPP有显著的减弱,说明阴部神经在维持小鼠的控尿功能中有着重要的作用[23]。同时对正常小鼠进行LPP测定时,EUS EMG信号也随之增强,此为正常防御反射的表现,而在神经损伤后,EMG信号几乎完全消失。这一方面反映了阴部神经支配对小鼠尿道外括约肌收缩力的影响,另一方面也说明了所检测到的EUS EMG信号的真实性。
现有研究描述了大鼠排尿期出现的EUS EMG“间断性扑动”的现象,在英文文献中也被称为“EUS EMG bursting activity”[15]。研究认为它的出现标志着大鼠排尿期膀胱的有效排空,同时也反映了排尿反射中各组成部分的功能完整性[15]。而这一特殊的排尿期EMG表现在双侧神经损伤或脊髓损伤后出现了显著的减弱[15, 24]。本研究中,我们在正常小鼠的排尿期也定量记录到了类似的EUS EMG信号,而在双侧阴部神经离断后,该信号完全消失,提示所检测到的EUS EMG信号的可靠性。对比现有的大鼠模型研究可发现,我们所记录到的小鼠排尿期EUS EMG信号扑动的振幅较大鼠的高,持续时间和两次扑动之间的间隔时间均较大鼠的长[15]。说明虽然我们记录到了近似大鼠排尿期的EUS EMG特殊信号,但两动物品种之间的细节参数存在明显的区别。
本实验主要采用了膀胱内测压与肌肉电生理测定相结合的方法模拟出了临床尿动力学检测的过程。但以大、小鼠为代表的啮齿类动物的盆底与膀胱支撑结构与人类有所区别,比如,小鼠膀胱的主要支撑组织为前腹壁,而在人类则是肛提肌[25]。除此之外,在功能学检测中,为了实验的顺利进行,需要对实验动物使用麻醉药物,可能不能完全真实的反映其在清醒状态下的下尿路功能[26]。但是,小鼠的尿道外括约肌的神经支配及防御反射的原理与人类的具有相似性,且本实验结果也证明了在小鼠实现膀胱压力与EUS EMG同步测定的可行性。
本实验建立了一种在小鼠模型上的膀胱压力与EUS EMG同步测定的方法,通过双侧阴部神经离断术前与术后定量参数的统计学比较,验证了该方法的可靠性。这种新的方法在未来各种小鼠LUTS模型的研究中具有广泛的运用前景,并有助于探索临床LUTS的发生机制和潜在的预防及治疗方法。
| [1] | Fry C H, Daneshgari F, Thor K, et al. Animal models and their use in understanding lower urinary tract dysfunction[J]. Neurourol Urodyn,2010, 29 (4) : 603 –608. DOI:10.1002/nau.20903 |
| [2] | Damaser M S, Brzezinski K, Longhurst P A. Filling mechanics of obstructed and de-obstructed rat urinary bladders[J]. Neurourol Urodyn,1999, 18 (6) : 659 –671. DOI:10.1002/(ISSN)1520-6777 |
| [3] | Daneshgari F, Leiter E H, Liu G, et al. Animal models of diabetic uropathy[J]. J Urol,2009, 182 (6 Suppl) : S8 –13. DOI:10.1016/j.juro.2009.07.084 |
| [4] | Jiang H H, Pan H Q, Gustilo-Ashby M A, et al. Dual simulated childbirth injuries result in slowed recovery of pudendal nerve and urethral function[J]. Neurourol Urodyn,2009, 28 (3) : 229 –235. DOI:10.1002/nau.20632 |
| [5] | Kruse M N, Belton A L, de Groat W C. Changes in bladder and external urethral sphincter function after spinal cord injury in the rat[J]. Am J Physiol,1993, 264 (6 Pt 2) : R1157 –R1163. |
| [6] | 吴刚, 谷宝军. 动物模型在下尿路功能障碍中的应用进展[J]. 临床泌尿外科杂志,2011, 26 (3) : 235 –238. DOI:10.3969/j.issn.1001-1420.2011.03.026 |
| [7] | Andersson K E, Soler R, Füllhase C. Rodent models for urodynamic investigation[J]. Neurourol Urodyn,2011, 30 (5) : 636 –646. DOI:10.1002/nau.21108 |
| [8] | Peng C W, Chen J J, Chang H Y, et al. External urethral sphincter activity in a rat model of pudendal nerve injury[J]. Neurourol Urodyn,2006, 25 (4) : 388 –396. DOI:10.1002/nau.20229 |
| [9] | Frias B, Charrua A, Avelino A, et al. Transient receptor potential vanilloid 1 mediates nerve growth factor-induced bladder hyperactivity and noxious input[J]. BJU Int,2012, 110 (8 Pt B) : E422 –E428. DOI:10.1111/j.1464-410X.2012.11187.x |
| [10] | Schnegelsberg B, Sun T T, Cain G, et al. Overexpression of NGF in mouse urothelium leads to neuronal hyperinnervation, pelvic sensitivity, and changes in urinary bladder function[J]. Am J Physiol Regul Integr Comp Physiol,2010, 298 (3) : R534 –R547. DOI:10.1152/ajpregu.00367.2009 |
| [11] | Pan H Q, Kerns J M, Lin D L, et al. Dual simulated childbirth injury delays anatomic recovery[J]. Am J Physiol Renal Physiol,2009, 296 (2) : F277 –F283. DOI:10.1152/ajprenal.90602.2008 |
| [12] | Cannon T W, Damaser M S. Effects of anesthesia on cystometry and leak point pressure of the female rat[J]. Life Sci,2001, 69 (10) : 1193 –1202. DOI:10.1016/S0024-3205(01)01182-1 |
| [13] | Lin Y H, Liu G, Daneshgari F. A mouse model of simulated birth trauma induced stress urinary incontinence[J]. Neurourol Urodyn,2008, 27 (4) : 353 –358. DOI:10.1002/nau.20509 |
| [14] | Lee U J, Gustilo-Ashby A M, Daneshgari F, et al. Lower urogenital tract anatomical and functional phenotype in lysyl oxidase like-1 knockout mice resembles female pelvic floor dysfunction in humans[J]. Am J Physiol Renal Physiol,2008, 295 (2) : F545 –F555. DOI:10.1152/ajprenal.00063.2008 |
| [15] | Jiang H H, Gustilo-Ashby A M, Salcedo L B, et al. Electrophysiological function during voiding after simulated childbirth injuries[J]. Exp Neurol,2009, 215 (2) : 342 –348. DOI:10.1016/j.expneurol.2008.10.024 |
| [16] | de Groat W C. Mechanisms underlying the recovery of lower urinary tract function following spinal cord injury[J]. Paraplegia,1995, 33 (9) : 493 –505. DOI:10.1038/sc.1995.109 |
| [17] | Cannon T W, Wojcik E M, Ferguson C L, et al. Effects of vaginal distension on urethral anatomy and function[J]. BJU Int,2002, 90 (4) : 403 –407. DOI:10.1046/j.1464-410x.2002.02918.x |
| [18] | 李佳, 夏六兵, 张腾, 等. 4-PBA抑制内质网应激降低间质性膀胱炎大鼠膀胱兴奋性[J]. 第三军医大学学报,2016, 38 (11) : 1270 –1275. DOI:10.16016/j.1000-5404.201601180 |
| [19] | 胡洋, 楼叶琳, 吴海啸, 等. 静脉输注骨髓间充质干细胞对脊髓损伤后大鼠下尿路功能的影响[J]. 中华器官移植杂志,2015, 36 (3) : 135 –140. DOI:10.3760/cma.j.issn.0254-1785.2015.03.002 |
| [20] | 陈宇东, 宋波, 金锡御, 等. 下尿路梗阻对大鼠逼尿肌肌条自发性收缩影响的实验研究[J]. 实验动物科学与管理,2001, 18 (2) : 26 –28. DOI:10.3969/j.issn.1006-6179.2001.02.008 |
| [21] | 林斌, 董兴有, 赵江, 等. 二甲基亚砜通过降低炎症和氧化应激改善鱼精蛋白诱导的大鼠膀胱炎[J]. 第三军医大学学报,2015, 37 (6) : 505 –509. DOI:10.16016/j.1000-5404.201410047 |
| [22] | Aboushwareb T, Zhou G, Deng F M, et al. Alterations in bladder function associated with urothelial defects in uroplakin II and IIIa knockout mice[J]. Neurourol Urodyn,2009, 28 (8) : 1028 –1033. DOI:10.1002/nau.20688 |
| [23] | Jiang H H, Salcedo L B, Damaser MS. Quantification of neurological and other contributors to continence in female rats[J]. Brain Res,2011, 1382 : 198 –205. DOI:10.1016/j.brainres.2011.01.094 |
| [24] | Cheng C L, de Groat W C. The role of capsaicin-sensitive afferent fibers in the lower urinary tract dysfunction induced by chronic spinal cord injury in rats[J]. Exp Neurol,2004, 187 (2) : 445 –454. DOI:10.1016/j.expneurol.2004.02.014 |
| [25] | Gill B C, Moore C, Damaser M S. Postpartum stress urinary incontinence: lessons from animal models[J]. Expert Rev Obstet Gynecol,2010, 5 (5) : 567 –580. DOI:10.1586/eog.10.48 |
| [26] | Yoshiyama M, Roppolo J R, Takeda M, et al. Effects of urethane on reflex activity of lower urinary tract in decerebrate unanesthetized rats[J]. Am J Physiol Renal Physiol,2013, 304 (4) : F390 –F396. DOI:10.1152/ajprenal.00574.2012.6 |



