Zheng Hongting, E-mail:fnf7703@hotmail.com
糖尿病溃疡(diabetes ulcers,DUs)慢性迁延不愈,是导致糖尿病患者截肢的重要因素之一。创口愈合是一个复杂的精细的过程,主要分为四个阶段:止血期,炎症期,增殖期和组织重塑期[1]。各阶段由多种组织和细胞通过迁移和增殖的交互作用来闭合创缘[2-3]。在这些细胞中,成纤维细胞在愈合的各个阶段都发挥着至关重要的作用,其正常的增殖和迁移对维持皮肤正常的结构和生理功能具有重要意义[4-5]。与正常创口相比,DUs患者长期处于高血糖的状态,已有研究表明该因素或为溃疡处各种细胞的行为学功能发生显著变化的因素之一[6]。在人皮肤中,间质细胞如真皮成纤维细胞为表皮角质细胞的功能发挥提供重要的微环境[7]。
我们前期研究表明,DUs创缘皮肤处于高氧化应激损伤状态,高糖会使机体氧化与抗氧化反应失衡,导致体内活性氧簇(reactive oxygen species,ROS)增多,从而影响细胞功能。核因子E2相关因子(nuclear factor erythroid 2-related factor,NRF2)是氧化还原敏感转录因子,通过调控其下游数十种抗氧化酶和Ⅱ相解毒酶表达,中和过多的ROS,维持细胞氧化还原平衡[8]。激活NRF2可改善高糖导致的氧化应激损伤,有助于糖尿病溃疡愈合[9]。
几个世纪以来,桂皮一直作为中药或者香料被广泛使用,其主要活性成分是肉桂醛(cinnamic aldehyde,CA)。许多研究报道CA具有广泛生物和药理活性,可显著改善糖尿病[10-11]及糖尿病肾病[12]。我们的前期研究已经证实,CA作为一种NRF2激动剂,显著促进角质细胞迁移,促进糖尿病鼠创口愈合[9]。另一方面,成纤维细胞在高糖情况下的迁移能力受损[13],迄今为止激活NRF2对成纤维细胞的影响尚无研究报道。本研究拟观察CA对高糖条件下皮肤成纤维细胞功能的影响,并分析NRF2在其中的作用,为CA应用于DUs治疗提供进一步实验依据。
1 材料与方法 1.1 主要材料与试剂人皮肤成纤维细胞系HS27由亚利桑那癌症中心Dr. Tim Bowden教授惠赠,DMEM培养基、胰酶(HyClone 公司);Hanks平衡盐溶液(Hanks balanced salt solution,HBSS)(Gibico);发光液(Minipore,No.WBKLS0500);胎牛血清(FBS,Gibico公司);CA、2′,7′-二氯荧光素二醋酸(2′,7′-dichlorofluorescein diacetate,DCF)、D-glucose(G8270)均购自Sigma公司(St. Louis,MO);抗体NRF2,HO-1,P53,P21、β-actin及结合辣根过氧化物酶(HRP)购自Santa Cruz 公司;Con siRNA(1027281)和NRF2 siRNA (S100657937)及所用转染试剂购自Qiagen公司(Valencia ,CA)。
1.2 HS27细胞培养与分组HS27细胞置于含10% FBS的正常糖(NG,5.5 mmol/L)DMEM培养液中于 37°C,5% CO2 孵箱中培养。实验前,细胞于正常糖无血清培养基中饥饿培养24 h,然后分别在正常糖或高糖(HG,30 mmol/L)含10%FBS的DMEM中培养2天。实验分为5组:①正常对照组(NG组):培养基含5.5 mmol/L D-glucose;②高糖组(HG组):培养基含30 mmol/L D-glucose;③高 糖+肉桂醛(HG+CA):培养基含30 mmol/L D-glucose和20 μmol/L CA;④高糖+Con siRNA(HG+Con siRNA): 培养基含30 mmol/L D-glucose和Con siRNA;⑤高糖+NRF2 siRNA:培养基含30 mmol/L D-glucose和NRF2 siRNA。
1.3 细胞迁移能力检测HS27细胞在NG或HG中培养2天后,HG组加入20 μmol/L CA干预24 h后移去聚二甲基硅氧烷(polydimethylsiloxane,PDMS)膜形成宽度为1 mm的空间检测HS27细胞的迁移能力。使用 PDMS膜从而以对细胞损伤最小的方式制造细胞迁移空间,具体迁移实验步骤如文献所述[14]。将紫外消毒的PDMS膜(1 mm×2 cm)置于6孔板中间,确保膜的底部和培养板底面紧贴,避免留有空隙。将对数生长期的HS27细胞以1×105个/孔接种于6孔板中,待单层细胞融合后,用镊子移除PDMS膜即可产生1 mm宽度的划痕。PBS洗净脱落细胞后分别加入NG和HG培养基,每24 h换液并予CA干预,拍照收集图片分析实验结果。将Con siRNA或NRF2 siRNA干扰(详见后)后的HS27细胞以1×105个每孔细胞密度接种于6孔板中,干扰48 h后细胞融合形成单层,如上述方法,观察细胞72 h迁移情况。
1.4 Western Blot检测蛋白表达。用1×上样缓冲液[50 mmol/L Tris-HCl pH 6.8,2% 十二烷基硫酸钠(sodium dodecyl sulfate,SDS),10% 甘油,100 mmol/L十二烷基硫酸钠(dithiothreitol,DTT),0.1% 溴酚蓝]提取干预后的HS27细胞蛋白,沸水煮5 min后经细胞超声粉碎仪裂解细胞蛋白,行聚丙烯酰胺凝胶(5%浓缩胶和8%分离胶)电泳,经电转膜仪将蛋白转移至PVDF膜上,以5%脱脂牛奶封闭,敷一抗(NRF2、HO-1、P53、P21、β-actin)及二抗进行免疫印迹检测,运用发光液在曝光仪(FUSION FX5S)上曝光,得到蛋白灰度图像后分析目的蛋白相对表达水平。
1.5 HS27细胞内ROS水平检测细胞内活性氧(ROS)检测采用DCF非标记的氧化敏感荧光探针。细胞接种于NG或HG培养基,20 μmol/L CA每隔24 h干预一次,48 h后,细胞经HBSS液洗涤2次后,换用含10 μg/mL DCF的HBSS液在37°培养箱避光孵育30 min。然后HBSS液洗涤3次后置于荧光显微镜(Zeiss Observer.Z1)下采用激光和放射波长为485 nm 和 530 nm之间检测荧光强度。采用Slidebook 5.0软件分析荧光图像。运用Image J software分析每组随机3个区域的相对荧光强度从而代表细胞内ROS的水平。
1.6 siRNA转染技术按照产品说明书,运用HiPerfect转染试剂盒(Qiagen)将非特异性的Con siRNA或NRF2 siRNA转染至HS27细胞中。简单概述如下,细胞分别在NG和HG培养基中培养2 d,然后分别转染Con siRNA和NRF2 siRNA后进行下一步实验。拟行ROS检测的HS27细胞先于NG环境中分别转染Con siRNA和NRF2 siRNA,24 h后将细胞转为HG环境中培养并实施预定干预。另外,拟行迁移能力检测的HS27细胞,转染Con siRNA和NRF2siRNA 48 h后移去PDMS膜,于高糖条件下培养,每24小时观察细胞迁移情况。
1.7 统计学处理上述实验均重复3次,数据以x±s形式记录。使用SPSS 10.0进行了统计检验。运用非配对t检验分析两组平均值。2组以上组间比较采用单因素方差分析和Tukey post hoc test检验。
2 结果 2.1 CA对高糖条件下皮肤成纤维细胞迁移的影响迁移实验所示,NG组,HG组和HG+CA组培养的HS27细胞在前24 h的迁移并无明显差异。然而,48 h时,与NG组相比,HG组HS27细胞迁移显著受阻[(0.410±0.053)vs(0.642±0.020),P<0.05,图 1],给予CA干预后,HG+CA组HS27细胞迁移得到显著改善[(0.642±0.020)vs(0.443±0.053),P<0.05,图 1 ]。60 h时,与NG组相比,HG组HS27细胞迁移显著受阻[(0.068±0.052)vs(0.467±0.023),P<0.05,图 1]。观察至72 h,NG组已完全愈合,HG组仅约70%的愈合率,HG+CA组几乎完全愈合。上述结果表明,CA可显著改善高糖对HS27迁移的抑制作用。

|
| 图 1 光镜实时观察各组HS27细胞的迁移变化 |
2.2 CA对HS27细胞NRF2、HO-1及增殖和凋亡相关蛋白P21和P53表达水平的影响
Western blot结果显示,与HG组相比,HG+CA组NRF2及其下游靶蛋白HO-1表达水平显著升高(图 2),表明CA可显著激活HG环境下成纤维细胞的NRF2通路,并上调HO-1表达。此外,与HG组相比,HG+CA组HS27细胞的P21和P53表达水平并无显著改变。表明CA激活高糖条件下HS27细胞的NRF2通路,但并不影响细胞增殖和凋亡相关蛋白P21、P53的表达水平。
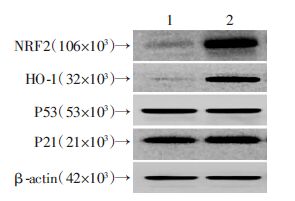
|
| 1:HG组;2:HG+CA组 图 2 Western blot检测HS27细胞NRF2、HO-1、P53、P21表达 |
2.3 CA对高糖条件下HS27细胞ROS水平的影响
采用DCF法检测HS27细胞内ROS水平,经定量分析,HG组和HG+CA组的相对荧光强度均以NG组平均荧光强度值作为标准对比分析。与NG组相比,HG组ROS水平显著升高[(1 378 513±154 544)vs(4 360 935±1 445 723),P<0.05,图 3],而在HG+CA组ROS水平较HG组显著减弱[(4 360 935±1 445 723)vs(1 982 673±208 109),P<0.05,图 3],提示CA可以抑制高糖诱导HS27细胞的ROS水平升高。
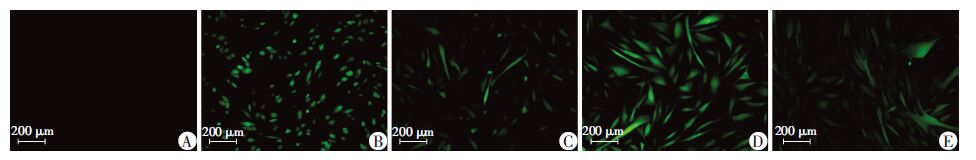
|
| A:阴性对照;B:阳性对照;C:NG组;D:HG组;E:HG+CA组 图 3 DCF法检测各组HS27细胞内ROS水平 |
2.4 干扰NRF2对HS27细胞增殖和凋亡相关蛋白P21和P53表达水平的影响
NRF2 siRNA和Con siRNA和转染至HS27细胞后,提取细胞蛋白检测NRF2、HO-1、P53及P21等蛋白的表达水平。Western blot结果显示,与HG +Con siRNA组相比,HG +NRF2 siRNA组NRF2、HO-1的表达显著降低,增殖和凋亡相关蛋白P21和P53表达水平并无改变(图 4)。表明阻断NRF2通路,并不影响细胞增殖和凋亡相关蛋白P21和P53的表达水平。

|
| 1:HG+Con siRNA组;2:HG+NRF2 siRNA组 图 4 Western blot 检测HS27细胞NRF2、HO-1、P53、P21表达 |
2.5 干扰NRF2对HS27细胞ROS水平的影响
DCF法检测HG+NRF2 siRNA组和HG+Con siRNA组ROS水平,与HG+Con siRNA相比,HG+NRF2 siRNA组ROS水平显著升高[(2 368 438±313 669)vs(3 310 108±658 351),P<0.05,图 5,]提示NRF2通路是调节高糖所致ROS增加的重要因素。

|
| A:HG+Con siRNA组;B: HG+NRF2 siRNA组 图 5 DCF法检测干扰NRF2对高糖情况下HS27细胞内ROS 水平的影响 |
2.6 干扰NRF2对成纤维细胞迁移能力的影响
迁移实验显示,前48 h HG+NRF2 siRNA组与HG+Con siRNA组HS27细胞迁移并无显著差异,60 h时,与HG+Con siRNA组相比,HG+NRF2 siRNA组HS27细胞迁移显著减弱[(0.046±0.018)vs(0.318±0.032),P<0.05,图 6]。72 h时,HG+Con siRNA组完全愈合,HG+NRF2 siRNA组愈合率仅约24%,提示阻断NRF2通路抑制成纤维细胞迁移。
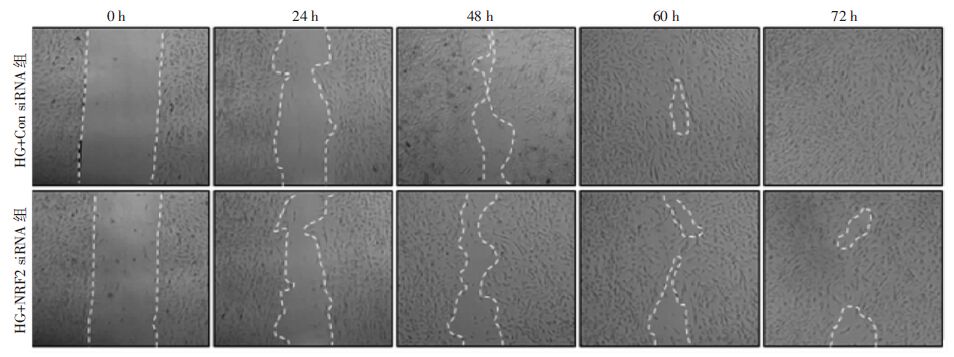
|
| 图 6 光镜实时观察各组HS27细胞的迁移变化 |
3 讨论
DUs是糖尿病的重要并发症,是导致非创伤性截肢的主要因素之一,严重影响患者的生活质量。创口愈合的各个时期并不能严格区分,大致可分为止血期、炎症期、增殖-迁移期(包括细胞外基质沉积)和重塑 期[15]。各时期彼此重叠,需要 多种细胞参与进程,包括 上皮层(角质上皮细胞、黑色素细胞、朗格汉斯细胞)、真皮层(成纤维细胞和肌成纤维母细胞)、血管、附件结构及皮下脂肪层[16]。糖尿病所致的体内代谢紊乱、血管神经病变及炎症反应使上述参与创口愈合的多种细胞行为学功能紊乱,包括成纤维细胞的增殖和迁移受阻,导致DUs愈合延迟[5, 17]。体外多项实验表明,高糖环境可显著抑制角质细胞及成纤维细胞的迁移[5, 9, 18-20]。本研究亦证实了HG培养人皮肤成纤维细胞(HS27 cells),与NG组相比,人皮肤成纤维细胞的迁移能力明显降低。并且HG组HS27细胞ROS堆积,而经CA干预激活NRF2通路后细胞内ROS水平降低,细胞迁移能力显著增强。提示CA可望通过改善成纤维细胞的行为学功能促进糖尿病溃疡愈合。
糖尿病溃疡作为糖尿病的主要并发症之一,慢性迁延不愈,有着不同于一般溃疡的特有的病理生理机制。既往研究亦证实,高糖抑制细胞迁移其机制之一为ROS堆积导致氧化应激损伤[21]。有研究表明,对比高糖(HG,30 mmol/L)与正常糖(NG,5.5 mmol/L)培养的人原代包皮成纤维细胞(HSFs),HG组ROS生成增多,细胞迁移能力受损,经bFGF(basic fibroblast growth factor)干预降低ROS水平后,成纤维细胞迁移能力得以改善[20],这与本研究采用高糖(HG,30 mmol/L)培养人皮肤成纤维细胞(HS27 )发现其ROS水平较正常糖(NG,5.5 mmol/L)培养的HS27细胞显著升高相一致。此外,本课题组近期研究发现,糖尿病溃疡患者创缘处皮肤较非糖尿病患者创缘处皮肤氧 化应激损伤更严重,NRF2通路代偿性激活;进一步,在STZ诱导的糖尿病溃疡动物模型中,通过CA和SF(Sulforaphane)激活NRF2通路显著促进糖尿病创口愈合[9],表明NRF2通路在糖尿病溃疡中有重要作用。深 入研究发现,高糖导致角质细胞内ROS堆积,经NRF2特异性激动剂SF和CA干预后,其ROS水平明显下降,细胞迁移能力得到显著改善[9]。在此研究基础上,本研究进一步证实了ROS对成纤维细胞迁移的影响:CA,一种NRF2的特异性激动剂,干预成纤维细胞48 h后可使得高糖条件下细胞内增高的ROS水平明显降低,迁移能力增强。进一步,阻断成纤维细胞中的NRF2通路后,ROS水平进一步升高,成纤维细胞迁移的抑制效应加剧。提示,高糖环境下成纤维细胞胞内ROS水平可能与迁移能力负相关。因此,本研究发现激活NRF2通路可明显缓解高糖对成纤维细胞迁移能力的影响,进一步充实了NRF2激动剂应用于糖尿病溃疡治疗的科学依据。
此外,成纤维细胞的增殖、凋亡同样参与创口闭合过程。高糖(30 mmol/L和60 mmol/L)处理HSFs细胞72 h后,细胞损伤相关蛋白P53,c-Caspase-3,TNF-α和PAI-1水平显著升高,但并不影响细胞的增殖活性[20]。P21抑制细胞周期蛋白cyclin/CDK家族的活性,并且过表达P21抑制人皮肤成纤维细胞增殖[22-23]。P53的水平改变诱导细胞活性丧失进而导致细胞凋亡[24]。因此,我们检测了CA干预后成纤维 细胞P21和P53的表达水平,发现P21和P53的表达水平并无显著改变。鉴于成纤维细胞的增殖与多种因素相关,如丝裂原活化蛋白激酶p42mapk和p44mapk[25]、 TGF-β1[26]等成纤维细胞增殖的重要调节因子。因此,CA对成纤维细胞增殖和凋亡有无影响尚不明确,仅提示CA并不影响P21或 P53相关增殖或凋亡的信号通路,但对其他因素有无作用尚未可知,需进一步通过其他方法检测不同时间点细胞增殖情况并进一步探讨其他相关信号通路的影响。
另一方面,为进一步阐释NRF2及ROS水平在调控成纤维细胞迁移、增殖及凋亡中的重要作用,本研究还发现阻断NRF2通路后成纤维细胞的ROS水平进一步增加,迁移能力严重受损,而增殖和凋亡相关蛋白表达并无明显改变。故此,继发现NRF2在糖尿病肾病[12, 27]、糖尿病肌萎缩[28]、糖尿病心肌病[29]及糖尿病溃疡(角质细胞)[9]等糖尿病并发症中的重要作用,本研究证实了NRF2在糖尿病溃疡中对成纤维细胞的重要保护作用,进一步丰富了氧化应激参与调控糖尿病及其并发症发生发展的重要理论。
未来进一步的研究应该包括敲除NRF2后进一步观察CA对成纤维细胞的影响,以探讨CA促进成纤维细胞迁移是否完全依赖于NRF2通路。此外,成纤维细胞是间质细胞的主要类型,参与细胞外基质(ECM)的沉积[30],那么CA对成纤维细胞高糖条件下ECM表达水平的调节是否有利,尚值得进一步探讨。
综上所述,本研究证实了CA降低高糖诱导的皮肤成纤维细胞内ROS水平,改善高糖对皮肤成纤维细胞迁移的抑制作用,进一步探索其可能机制,发现CA经由NRF2通路调节高糖条件下皮肤成纤维细胞的功能,为CA应用于DUs的临床治疗提供了实验依据。
| [1] | Game F L, Jeffcoate W J. Dressing and Diabetic Foot Ulcers: A Current Review of the Evidence[J]. Plast Reconstr Surg,2016, 138 (3 Suppl) : 158S –164S. DOI:10.1097/PRS.dsjydxxb-39-5-42302681 |
| [2] | Hata S, Okamura K, Hatta M, et al. Proteolytic and non-proteolytic activation of keratinocyte-derived latent TGF-β1 induces fibroblast differentiation in a wound-healing model using rat skin[J]. J Pharmacol Sci,2014, 124 (2) : 230 –43. DOI:10.1254/jphs.13209FP |
| [3] | Martin P. Wound healing--aiming for perfect skin regeneration[J]. Science,1997, 276 (5309) : 75 –81. DOI:10.1126/science.276.5309.75 |
| [4] | Almeida M E, Monteiro K S, Kato E E, et al. Hyperglycemia reduces integrin subunits alpha v and alpha 5 on the surface of dermal fibroblasts contributing to deficient migration[J]. Mol Cell Biochem,2016, 1-2 (421) : 19 –28. DOI:10.1007/s11010-016-2780-4 |
| [5] | Shi H, Cheng Y, Ye J, et al. bFGF Promotes the Migration of Human Dermal Fibroblasts under Diabetic Conditions through Reactive Oxygen Species Production via the PI3K/Akt-Rac1- JNK Pathways[J]. Int J Biol Sci,2015, 11 (7) : 845 –859. DOI:10.7150/ijbs.11921 |
| [6] | Blakytny R, Jude E. The molecular biology of chronic wounds and delayed healing in diabetes[J]. Diabet Med,2006, 23 (6) : 594 –608. DOI:10.1111/j.1464-5491.2006.01773.x |
| [7] | Blanpain C, Fuchs E. Epidermal homeostasis: a balancing act of stem cells in the skin[J]. Nat Rev Mol Cell Biol,2009, 10 (3) : 207 –217. DOI:10.1038/nrm2636 |
| [8] | Denicola G M, Karreth F A, Humpton T J, et al. Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis[J]. Nature,2011, 475 (7354) : 106 –109. DOI:10.1038/nature10189 |
| [9] | Long M, Rojo D L V M, Wen Q, et al. An Essential Role of NRF2 in Diabetic Wound Healing[J]. Diabetes,2016, 65 (3) : 780 –793. DOI:10.2337/db15-0564 |
| [10] | Koivisto A, Hukkanen M, Saarnilehto M, et al. Inhibiting TRPA1 ion channel reduces loss of cutaneous nerve fiber function in diabetic animals: Sustained activation of the TRPA1 channel contributes to the pathogenesis of peripheral diabetic neuropathy[J]. Pharmacol Res,2012, 65 (1) : 149 –158. DOI:10.1016/j.phrs.2011.10.006 |
| [11] | Anderson R A. Chromium and polyphenols from cinnamon improve insulin sensitivity[J]. Proc Nutr Soc,2008, 67 (01) : 48 –53. DOI:10.1017/S0029665108006010 |
| [12] | Zheng H, Whitman S A, Wu W, et al. Therapeutic Potential of Nrf2 Activators in Streptozotocin-Induced Diabetic Nephropathy[J]. Diabetes,2011, 60 (11) : 3055 –3066. DOI:10.2337/db11-0807 |
| [13] | Lamers M L, Almeida M E, Vicente-Manzanares M, et al. High glucose-mediated oxidative stress impairs cell migration[J]. PLoS One,2011, 6 (8) : e22865 . DOI:10.1371/journal.pone.0022865 |
| [14] | Anon E, Serra-Picamal X, Hersen P, et al. Cell crawling mediates collective cell migration to close undamaged epithelial gaps[J]. Proc Natl Acad Sci U S A,2012, 109 (27) : 10891 –10896. DOI:10.1073/pnas.1117814109 |
| [15] | Falanga V. Wound healing and its impairment in the diabetic foot[J]. The Lancet,2005, 366 (9498) : 1736 –1743. DOI:10.1016/S0140-6736(05)67700-8 |
| [16] | Zielins E R, Atashroo D A, Maan Z N, et al. Wound healing: an update[J]. Regen Med,2014, 9 (6) : 817 –830. DOI:10.2217/rme.14.54 |
| [17] | Sundaram G M, Common J E A, Gopal F E, et al. ‘See-saw’ expression of microRNA-198 and FSTL1 from a single transcript in wound healing[J]. Nature,2013, 495 (7439) : 103 –106. DOI:10.1038/nature11890 |
| [18] | Lan C C, Liu I H, Fang A H, et al. Hyperglycaemic conditions decrease cultured keratinocyte mobility: implications for impaired wound healing in patients with diabetes. 2008: 159, 1103-1115: DOI: 10.1111/j.1365-2133.2008.08789.x: DOI: 10.1111/j.1365-2133.2008.08789.x. |
| [19] | Fadini G P, Albiero M, Menegazzo L, et al. The Redox Enzyme p66Shc Contributes to Diabetes and Ischemia-Induced Delay in Cutaneous Wound Healing[J]. Diabetes,2010, 59 (9) : 2306 –2314. DOI:10.2337/db09-1727 |
| [20] | Xuan Y H, Huang B B, Tian H S, et al. High-glucose inhibits human fibroblast cell migration in wound healing via repression of bFGF-regulating JNK phosphorylation[J]. PLoS One,2014, 9 (9) : e108182 . DOI:10.1371/journal.pone.0108182 |
| [21] | Xiao H, Gu Z, Wang G, et al. The Possible Mechanisms Underlying the Impairment of HIF-1α Pathway Signaling in Hyperglycemia and the Beneficial Effects of Certain Therapies[J]. Int J Med Sci,2013, 10 (10) : 1412 –1421. DOI:10.7150/ijms.5630 |
| [22] | Xiong Y, Hannon G J, Zhang H, et al. p21 is a universal inhibitor of cyclin kinases[J]. Nature,1993, 366 (6456) : 701 –704. DOI:10.1038/366701a0 |
| [23] | Serrano M, Hannon G J, Beach D. A new regulatory motif in cell-cycle control causing specific inhibition of cyclin D/CDK4[J]. Nature,1993, 366 (6456) : 704 –707. DOI:10.1038/366704a0 |
| [24] | Yonish-Rouach E, Resnitzky D, Lotem J, et al. Wild-type p53 induces apoptosis of myeloid leukaemic cells that is inhibited by interleukin-6[J]. Nature,1991, 352 (6333) : 345 –347. DOI:10.1038/352345a0 |
| [25] | G Pagès P L G L. Mitogen-activated protein kinases p42mapk and p44mapk are required[J]. Proc Natl Acad Sci U S A,1993, 18 (90) : 8319 –8323. |
| [26] | Li H, Yang L, Zhang Y, et al. Kaempferol inhibits fibroblast collagen synthesis, proliferation and activation in hypertrophic scar via targeting TGF-β receptor type I[J]. Biomed Pharmacother,2016, 83 : 967 –974. DOI:10.1016/j.biopha.2016.08.011 |
| [27] | Jiang T, Huang Z, Lin Y, et al. The Protective Role of Nrf2 in Streptozotocin-Induced Diabetic Nephropathy[J]. Diabetes,2010, 59 (4) : 850 –860. DOI:10.2337/db09-1342 |
| [28] | Whitman S A, Long M, Wondrak G T, et al. Nrf2 modulates contractile and metabolic properties of skeletal muscle in streptozotocin-induced diabetic atrophy[J]. Exp Cell Res,2013, 319 (17) : 2673 –2683. DOI:10.1016/j.yexcr.2013.07.015 |
| [29] | Bai Y, Cui W, Xin Y, et al. Prevention by sulforaphane of diabetic cardiomyopathy is associated with up-regulation of Nrf2 expression and transcription activation[J]. J Mol Cell Cardiol,2013, 57 : 82 –95. DOI:10.1016/j.yjmcc.2013.01.008 |
| [30] | Driskell R R, Lichtenberger B M, Hoste E, et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair[J]. Nature,2013, 504 (7479) : 277 –281. DOI:10.1038/nature12783 |



