目前认为2型糖尿病发病的中心环节是胰岛素抵抗和胰岛素分泌不足[1]。因此现有的糖尿病药物大多通过改善这两个因素来发挥降血糖作用,如二甲双胍、罗格列酮等药物主要通过改善胰岛素敏感性发挥作用[2],而磺脲类药物、二肽基肽酶抑制剂的作用环节主要在促进胰岛素分泌[3]。但是比较遗憾的是目前尚缺乏具有明确的同时改善以上两个环节的药物。
骨形态发生蛋白7(bone morphogenetic protein 7,BMP7)是TGFβ超家族成员之一,研究发现BMP7除参与肾脏的胚胎发育[4]、骨骼形成与骨折愈合[5]等病理生理过程外,还可诱导棕色脂肪的形成[6]、减少摄食、增加能量消耗、降低体质量[7]。鉴于肥胖在胰岛素抵抗发生中的重要作用,BMP7可能通过降低体质量改善机体的胰岛素抵抗。而且我们在前期研究中发现人血清BMP7水平与空腹胰岛素和胰岛素分泌指数呈明显正相关[8]。在进一步的细胞研究中,我们发现BMP7可促进其胰岛素分泌[9]。以上研究结果提示,BMP7有潜力成为同时改善胰岛素抵抗和胰岛素分泌的药物治疗靶点。本研究以2型糖尿病小鼠模型为研究对象,观察BMP7对其血糖、血脂、胰岛素抵抗和胰岛素分泌相关指标的影响,并初步探索BMP7改善胰岛素分泌的机制,以期为2型糖尿病的临床治疗提供新的线索和靶点。
1 材料与方法 1.1 材料 1.1.1 动物8周龄雄性C57BL/6小鼠24只,体质量18~24 g,购自第三军医大学实验动物中心,饲养于22 ℃室温,相对湿度60%的环境中。
1.1.2 试剂重组人骨形态发生蛋白7(rhBMP7)(PROSPEC,以色列)。链脲佐菌素(STZ,Sigma,美国),临用前溶解在10 mmol/L的柠檬酸缓冲液,调节pH至4.5。小鼠胰岛素检测试剂盒(Mercodia,瑞典)。PKD1抗体购自Santa Cruz公司,phospho-PKD1(Ser916)抗体购自Cell Signaling公司,Tubulin抗体购自Beyotime公司。
1.2 方法 1.2.1 2型糖尿病小鼠模型的建立采用小剂量STZ腹腔注射联合高脂高糖饮食建立2型糖尿病小鼠模型:注射STZ前后均采用高脂饮食(10.0% 猪油,20.0% 蔗糖,2.5% 胆固醇,1.0%胆酸盐,66.5% 常规饲料配制)[10],然后一次性给予STZ 40 mg/kg腹腔内注射。STZ注射3 d后尾静脉采血测定血糖,随机血糖大于16.7 mmol/L证明造模成功。
1.2.2 动物分组及处理造模过程中4只小鼠死亡,将造模成功的小鼠20只,分为4组,每组5只:①2型糖尿病模型组;②PBS对照组;③BMP7小剂量组:给予rhBMP7剂量为100 μg/kg,隔日腹腔注射;④BMP7大剂量组:给予rhBMP7剂量为200 μg/kg,隔日腹腔注射。每周检测血糖。4周后,进行相关指标检测和分析。
1.2.3 血生化指标、胰岛素的测定小鼠空腹12 h 后,收集血标本,用全自动生化分析仪测定血糖、总胆固醇(TC)、甘油三酯(TG),胰岛素含量应用相应的试剂盒,按照说明书进行检测。计算胰岛素分泌指数HOMA-β和胰岛素抵抗指数HOMA-IR:HOMA-β(%)=20×空腹胰岛素水平(mIU/L)/。HOMA-IR=空腹血糖水平(mmol/L)×空腹胰岛素水平(mIU/L)/22.5。
1.2.4 Western blot检测取胰腺组织约100 mg加入0.5 mL预冷的蛋白裂解液(含有蛋白酶抑制剂和磷酸酶抑制剂),匀浆,离心并收集上清。BCA法测定蛋白浓度。取30 μg上样,以SDS-PAGE凝胶电泳,然后100 V恒压湿转至PVDF膜上,5%BSA溶液室温封闭2 h,分别用PKD1、phospho-PKD1和Tubulin一抗4 ℃摇床孵育过夜。孵育完后以TBST洗膜3次,加入相应二抗于室温孵育1 h。TBST洗膜3次,最后加入化学发光底物于室温反应2 min,将PVDF膜放入凝胶成像仪中采集图像结果。
1.3 统计学方法计量资料以x±s表示,采用SPSS 19.0 统计软件,不同组别之间的比较采用t检验。
2 结果在造模过程中,共有4只糖尿病小鼠死亡,可能与血糖过高导致的糖尿病并发症有关。
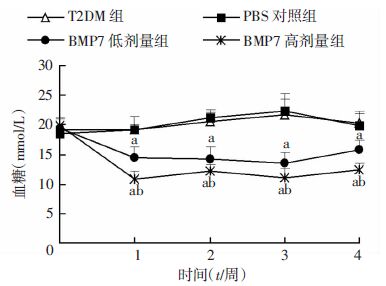
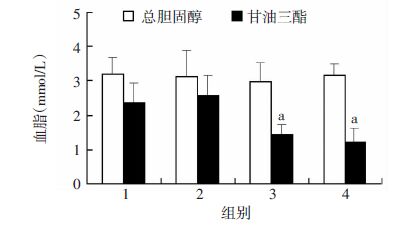
2.1 BMP7降低2型糖尿病小鼠的血糖、血脂与PBS对照组相比,1周后BMP7低剂量组和高剂量组的空腹血糖均明显降低(P<0.05),其降血糖效应一直持续至4周实验观察结束时。并且BMP7高剂量组血糖低于低剂量组(P<0.05),提示BMP7的降血糖作用呈现出剂量依赖性(图 1)。通过检测各组的甘油三酯和胆固醇后发现,低剂量和高剂量的BMP7腹腔注射均可以降低小鼠的甘油三酯水平(P<0.05),但是BMP7对小鼠的胆固醇水平无明显影响(P>0.05,图 2)。
|
| a:P<0.05,与PBS对照组比较;b:P<0.05,与BMP7低剂量组比较 图 1 BMP7对各组2型糖尿病小鼠血糖的影响 (n=5,x±s) |
|
| 1:T2DM组;2:PBS对照组;3:BMP7低剂量组;4:BMP7高剂量组 a:P<0.05,与PBS对照组比较 图 2 BMP7对各组2型糖尿病小鼠血脂的影响 (n=5,x±s) |
2.2 BMP7促进2型糖尿病小鼠的胰岛素分泌
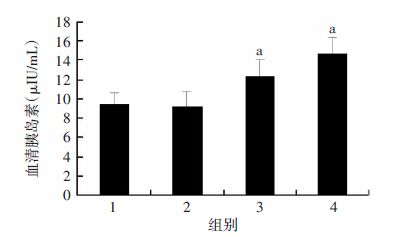
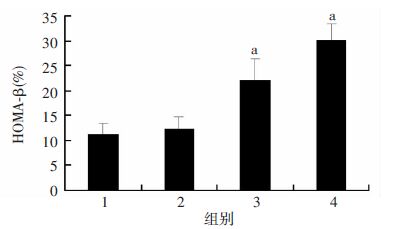
如图 3所示,与PBS对照组相比,BMP7低剂量组和高剂量组的空腹胰岛素水平明显升高(P<0.05)。通过计算胰岛素分泌指数HOMA-β后,BMP7处理组的HOMA-β指数显著高于PBS对照组(P<0.05,图 4)。
|
| 1:T2DM组;2:PBS对照组;3:BMP7低剂量组;4:BMP7高剂量组 a:P<0.05,与PBS对照组比较 图 3 BMP7对各组2型糖尿病小鼠胰岛素浓度的影响 (n=5,x±s) |
|
| 1:T2DM组;2:PBS对照组;3:BMP7低剂量组;4:BMP7高剂量组 a: P<0.05,与PBS对照组比较 图 4 BMP7对各组2型糖尿病小鼠HOMA-β 指数的影响 (n=5,x±s) |
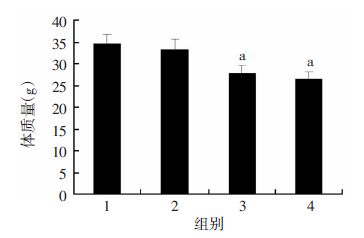
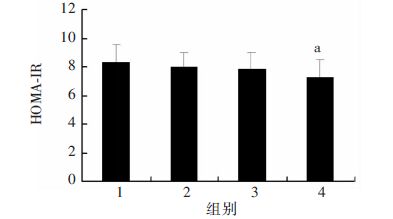
2.3 BMP7降低2型糖尿病小鼠的体质量和胰岛素抵抗指数
BMP7处理组小鼠体质量明显低于对照组(P<0.05,图 5)。体质量的下降可能导致胰岛素敏感性增加。我们通过计算HOMA-IR指数来反映小鼠的胰岛素抵抗情况。结果发现,BMP7高剂量组HOMA-IR显著低于对照组(P<0.05),但BMP7低剂量组的HOMA-IR与对照组相比差异无统计学意义(P>0.05,图 6)。
|
| 1:T2DM组;2:PBS对照组;3:BMP7低剂量组;4:BMP7高剂量组 a:P<0.05,与PBS对照组比较 图 5 BMP7对各组2型糖尿病小鼠体质量的影响 (n=5,x±s) |
|
| 1:T2DM组;2:PBS对照组;3:BMP7低剂量组;4:BMP7高剂量组 a:P<0.05,与PBS对照组比较 图 6 BMP7对各组2型糖尿病小鼠HOMA-IR的影响 (n=5,x±s) |
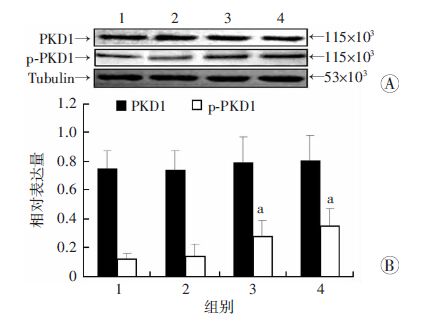
2.4 BMP7增加小鼠胰岛磷酸化PKD1的表达
前期细胞研究中我们发现BMP7的促胰岛素分泌作用不依赖于钙离子内流,而PKD1的表达调控是非钙离子内流的促胰岛素分泌的重要途径。我们检测了BMP7处理后小鼠胰岛PKD1的表达。结果发现,处理前后,PKD1表达无明显变化,但BMP7处理组磷酸化PKD1(p-PKD1)的表达明显增加(P<0.05)。提示BMP7的促胰岛素分泌作用可能通过PKD1的表达调控实现(图 7)。
|
| A:Western blot检测;B:相对表达量(n=5,x±s);1:T2DM组;2:PBS对照组;3:BMP7低剂量组;4:BMP7高剂量组 a:P<0.05,与PBS对照组比较 图 7 Western blot检测BMP7对各组2型糖尿病小鼠PKD1及p-PKD1表达的影响 |
3 讨论
胰岛素分泌不足和胰岛素抵抗是导致2型糖尿病发病的两大根本因素。在前期的细胞实验中,我们已经发现BMP7可以促进MIN6胰岛细胞的胰岛素分泌。但是在体实验中,BMP7是否能够发挥相似的作用而达到降糖疗效尚不清楚。由于BMP7是一种细胞因子,其在组织中分泌后,可以直接进入血液中,发挥生物学效应。因此,我们采用重组人BMP7蛋白腹腔注射,观测其对小鼠血糖的影响。结果发现BMP7注射1周后,2型糖尿病小鼠的血糖就明显下降,以后血糖一直维持在比较稳定的水平,直到4周实验观察期结束,证明BMP7有显著的降糖效果。进一步检测2型糖尿病小鼠的血浆胰岛素水平后发现,BMP7注射可以使血浆胰岛素水平显著上升,并且反映胰岛素分泌能力的HOMA-β指数也明显升高。证实不管是在体中还是离体中,BMP7均可以促进胰岛细胞胰岛素分泌。
胰岛素分泌的调控是一个很复杂的过程,但总体来讲,主要分近端步骤和末端步骤,其中近端步骤主要受Ca2+内流调节,而末端步骤除了Ca2+浓度依赖调节外,还存在非Ca2+依赖的调节机制。在前期研究中,我们检测了BMP7处理的MIN6细胞的Ca2+内流情况,结果发现,重组人BMP7处理后,MIN6细胞内的钙离子浓度并无明显变化[9],提示BMP7调控胰岛素分泌的机制可能在非Ca2+浓度依赖的胞吐环节。有研究发现,PKD1 是介导反式高尔基体网(TGN)胰岛素囊泡分裂,从而导致非Ca2+浓度依赖胞吐的关键分子[11]。因此我们检测了BMP7对胰岛细胞PKD1表达的影响,结果发现,BMP7并未增加PKD1蛋白的表达,但是BMP7组PKD1的磷酸化水平显著增加,提示BMP7可能通过增加PKD1的磷酸化从而达到促进胰岛素分泌的作用。
有研究发现,BMP7可以促进小鼠前体细胞向棕色脂肪细胞分化,从而提高机体中棕色脂肪细胞的含量[12]。而棕色脂肪细胞中含有大量的线粒体,线粒体内膜解偶联蛋白(UCP)1 活性较高,有利于氧化呼吸链解偶联,使ATP 转化为热能,将储存的能量以热能形式消耗掉[13-14]。因此增加棕色脂肪的数量或功能被认为是防治肥胖及代谢综合征的有效手段[15]。鉴于BMP7在促棕色脂肪形成中的关键作用,BMP7水平有可能与代谢综合征及肥胖相关。我们前期研究中发现,血清BMP7水平与女性体质量指数呈负相关[16]。本研究中,我们观察了重组人BMP7对2型糖尿病小鼠血脂和体质量指数的影响,结果发现BMP7组小鼠的甘油三酯水平明显下降,而胆固醇水平与对照组无明显差异。提示BMP7可能通过增加棕色细胞的脂肪酸氧化能力而发挥降血脂作用。进一步实验发现,BMP7可以降低2型糖尿病小鼠的体质量,这与Tseng等[17]报道的一致。而体质量的降低可能会导致胰岛素敏感性的改善。我们的实验也发现,BMP7高剂量组的胰岛素抵抗指数HOMA-IR显著低于PBS对照组。
综上所述,BMP7可以促进2型糖尿病小鼠的胰岛素分泌和改善其胰岛素敏感性,从而降低血糖。由于BMP7是一种存在于血液中的细胞因子,因此其在2型糖尿病的治疗中具有广阔的应用前景。
| [1] | Dimas A S, Lagou V, Barker A, et al. Impact of type 2 diabetes susceptibility variants on quantitative glycemic traits reveals mechanistic heterogeneity[J]. Diabetes,2014, 63 (6) : 2158 –2171. DOI:10.2337/db13-0949 |
| [2] | Zhao W, Li A, Xin F, et al. Metformin and resveratrol ameliorate muscle insulin resistance through preventing lipolysis and inflammation in hypoxic adipose tissue[J]. Cell Signal,2016, 28 (9) : 1401 –1411. DOI:10.1016/j.cellsig.2016.06.018 |
| [3] | 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华内分泌代谢杂志,2014, 30 (10) : 893 –942. |
| [4] | Oxburgh L, Brown A C, Muthukrishnan S D, et al. Bone morphogenetic protein signaling in nephron progenitor cells[J]. PediatrNephrol,2014, 29 (4) : 531 –536. DOI:10.1007/s00467-013-2589-2 |
| [5] | Morison Z, Vicente M, Schemitsch E H, et al. The treatment of atrophic, recalcitrant long-bone nonunion in the upper extremity with human recombinant bone morphogenetic protein-7 (rhBMP-7) and plate fixation: A retrospective review[J]. Injury,2016, 47 (2) : 356 –363. DOI:10.1016/j.injury.2015.11.035 |
| [6] | Zheng L, Liu J M, Wang J X, et al. Effect of bone morphogenetic protein 7 on differentiation of adipose derived mesenchymal stem cells into brown adipocytes in rats[J]. Zhongguo Yi XueKeXue Yuan XueBao,2014, 36 (6) : 654 –659. DOI:10.3881/j.issn.1000-503X.2014.06.018 |
| [7] | Townsend K L, Suzuki R, Huang T L, et al. Bone morphogenetic protein 7 (BMP7) reverses obesity and regulates appetite through a central mTOR pathway[J]. FASEB J,2012, 26 (5) : 2187 –2196. DOI:10.1096/fj.11-199067 |
| [8] | Zeng J, Jiang Y, Xiang S, et al. Serum bone morphogenetic protein 7, insulin resistance, and insulin secretion in non-diabetic individuals[J]. Diabetes Res ClinPract,2011, 93 (1) : e21 –e24. DOI:10.1016/j.diabres.2011.03.010 |
| [9] | 姜友昭, 曾俊, 陈兵. 骨形态发生蛋白7对胰岛素分泌的影响及机制研究[J]. 第三军医大学学报,2012, 34 (9) : 879 –882. DOI:10.16016/j.1000-5404.2012.09.007 |
| [10] | 戚韵雯, 何选丽, 朱丽娟, 等. 糖尿病小鼠认知功能及不同时相点硫化氢的表达[J]. 第三军医大学学报,2013, 35 (24) : 2625 –2629. DOI:10.16016/j.1000-5404.2013.24.009 |
| [11] | Goginashvili A, Zhang Z, Erbs E, et al. Insulin granules. Insulin secretory granules control autophagy in pancreatic beta cells[J]. Science,2015, 347 (6224) : 878 –882. DOI:10.1126/science.aaa2628 |
| [12] | Saini S, Duraisamy A J, Bayen S, et al. Role of BMP7 in appetite regulation, adipogenesis, and energy expenditure[J]. Endocrine,2015, 48 (2) : 405 –409. DOI:10.1007/s12020-014-0406-8 |
| [13] | Lee P, Bova R, Schofield L, et al. Brown Adipose Tissue Exhibits a Glucose-Responsive Thermogenic Biorhythm in Humans[J]. Cell Metab,2016, 23 (4) : 602 –609. DOI:10.1016/j.cmet.2016.02.007 |
| [14] | Shan T, Xiong Y, Zhang P, et al. Lkb1 controls brown adipose tissue growth and thermogenesis by regulating the intracellular localization of CRTC3[J]. Nat Commun,2016, 7 : 12205 . DOI:10.1038/ncomms12205 |
| [15] | Oliverio M, Schmidt E, Mauer J, et al. Dicer1-miR-328-Bace1 signalling controls brown adipose tissue differentiation and function[J]. Nat Cell Biol,2016, 18 (3) : 328 –336. DOI:10.1038/ncb3316 |
| [16] | 曾俊, 姜友昭, 陈兵. 血清骨形成蛋白-7浓度与女性肥胖的相关性研究[J]. 第三军医大学学报,2011, 33 (8) : 857 –860. DOI:10.16016/j.1000-5404.2011.08.004 |
| [17] | Tseng Y H, Kokkotou E, Schulz T J, et al. New role of bone morphogenetic protein 7 in brown adipogenesis and energy expenditure[J]. Nature,2008, 454 (7207) : 1000 –1004. DOI:10.1038/nature07221 |



