肾细胞癌(renal cell carcinoma,RCC)又称肾癌,是起源于肾实质泌尿小管上皮系统的恶性肿瘤,占肾脏恶性肿瘤的80%~90%,占成人恶性肿瘤的3%[1]。 而在我国泌尿系统恶性肿瘤中,发病率仅低于膀胱癌。肾透明细胞癌(clear cell renal cell carcinoma,CCRCC) 是最常见的肾癌病理亚型,占肾癌的60%~85%[2-3]。肾癌主要治疗方式仍然是手术切除,但转移性肾癌无法行根治性手术;且根治性手术后患者在短期内仍有可能发生复发、转移。约40%的肾细胞癌患者都会经历病情进展与转移[4]。转移性肾癌通常对化疗和放疗不敏感,免疫治疗也仅对15%~20%的患者有效[5]。因此通过寻找一种新的靶标开展新的治疗方法来治疗转移性肾癌是十分必要的。
氮酶调节因子2(nitrogen permease regulator 2-like,NPRL2)是一种新发现的抑癌基因,NPRL2亦称为肿瘤抑制候选基因4(tumor suppressor candidate4,TUSC4),是Lerman等[6]利用基因组测序和生物信息学技术筛选并寻找定位于人染色体3p21.3区域的肿瘤抑制基因。有研究表明在人类的多种肿瘤中都发现此区域的纯合性缺失,NPRL2作为抑癌基因在多种肿瘤的发生、发展中起重要作用[7-8]。Tang等[9]通过免疫组化的方法检测了78例肾透明细胞癌患者癌组织与癌旁组织,发现肾癌组织中NPRL2呈低表达且与肾癌分期、分级密切相关,表明NPRL2基因与肾癌的发生、发展存在密切关系。
上皮间质转化(epithelial-mesenchymal transition,EMT)是上皮细胞在形态学上发生向间(充)质细胞表型的转变并获得迁移的能力。在肿瘤的恶性演变过程中,EMT使得肿瘤细胞得以浸润和转移到远处部位。近年来研究发现,肾癌发生、发展过程中与EMT存在密切关系[10]。胞浆转导肽(cytoplasmic transduction peptide,CTP)可高效携带蛋白质穿透胞膜并专性定位于胞浆,以胞吞-非依赖性机制发挥转导功能。本实验采用CTP介导原核表达的NPRL2蛋白进入肾癌原代细胞内,观察其对肾癌原代细胞迁移侵袭能力的影响,并检测EMT相关标志物的表达水平,并初步探讨NPRL2改变肾癌原代细胞EMT过程的可能分子机制。
1 材料与方法 1.1 实验材料 1.1.1 肾癌组织肾癌标本取自重庆医科大学附属第一医院泌尿外科手术室,且经患者知情同意,术后病理检查证实为肾透明细胞癌。
1.1.2 实验试剂胎牛血清购自美国Gemini公司;RPMI 1640细胞培养基和0.25%胰酶购自HyClone公司;胶原酶Ⅳ购自Sigma公司;1×PBS粉剂购自北京鼎国生物技术公司;一次性25 cm2细胞培养瓶购自美国Corning公司;CO2培养箱购自美国Thermo公司;大肠杆菌菌种BL21、DH5α由重庆医科大学分子医学与肿瘤实验室赠送;氨苄青霉素、DMSO购自Biosharp公司;异丙基-β-D-硫代半乳糖苷(isopropyl beta-D-thiogalactopyranoside,IPTG);His-tag蛋白纯化磁珠购自Beaver公司;超声波细胞粉碎机购自中国新芝公司;酶标仪购自美国Thermo公司;BCA蛋白定量试剂盒、SDS-PAGE凝胶试剂盒购自碧云天公司;兔抗 NPRL2一抗、兔抗6×His-tag、Raptor、GAPDH、E-cadherin、 Fibronectin一抗和羊抗兔二抗购自Proteintech公司;SYBR Green PCR 试剂盒、逆转录试剂盒、蛋白Marker购自Thermo公司;PVDF膜购自Solarbio公司;羊抗兔FITC荧光标记二抗购自美国Abbkine公司;Transwell小室购自美国康宁公司;兔抗人CK18、CK8、EMA、Vimentin 一抗购自沈阳万类生物科技公司;大肠杆菌DH5α、BL21菌株由本室保存;免疫组化法(S-P)通用试剂盒、DAB显色试剂盒购自北京中杉金桥公司;pET15b-CTP-NPRL2与pET15b-NPRL2质粒购自北京鼎国生物公司。
1.2 实验方法 1.2.1 肾癌原代细胞培养取10 mL无血清1640培养基于50 mL离心管内,放入冰盒,随后带入手术室,标本自手术台取下后,观察包膜是否完整,用无菌敷料蘸干表面血迹,使用无菌手术刀沿纵面小心剖开标本,取肿瘤中心一小块淡黄色或金黄色鱼肉样癌组织,放入离心管内,使无血清培养基淹没肾癌组织块。快速放入冰盒内,带回实验室。
采用胶原酶Ⅳ消化肾癌组织块,减少对肾癌细胞的伤害。将装有标本的离心管放入提前用紫外照射30 min的超净台内,把组织块倒入无菌培养皿内,用4 ℃预冷的PBS清洗5遍,使用眼科剪与眼科镊小心将组织块剪成1 mm3的小块,去除组织上的血管等组 织,用PBS冲洗3~5遍,转入新的离心管内,加入10倍 体积的胶原酶,37 ℃水浴消化90 min,每隔10 min振荡1次,使组织块充分消化。消化完毕后,将组织悬液通过200目筛网过滤,收集细胞悬液,1 000 r/min,5 min 离心弃上清,完全培养基重悬,转移到细胞培养瓶内,放入细胞培养箱内培养。原代细胞接种后48 h内尽量减少挪动细胞次数,48 h后第1次换液,需1~2周细胞融合度才能达到70%以上。原代细胞成团生长,每个细胞团都由最初的一两个贴壁细胞增殖而来,细胞融合度通常不能达到100%。当细胞融合度达到80%时即可进行第1次传代。原代培养主要的干扰细胞是成纤维细胞,成纤维贴壁较快、贴壁较紧。传代的同时可利用差速贴壁法进行原代细胞的纯化,取1 mL胰酶加入到细胞培养瓶内,室温下消化2 min,加入2 mL 完全培养基终止消化,轻轻吹打培养瓶瓶底,使大部分细 胞脱落下来,将细胞悬液转移到离心管内,1 000 r/min 离心5 min,弃去上清,加入完全培养基重悬,将细胞悬液转移到6孔板内,放入37 ℃、5%CO2培养箱内培养20 min,小心取出培养板,吸取细胞悬液,加入到第2孔内,继续培养20 min,重复此步骤 3~4次,将细胞悬液转移到细胞培养瓶内,放入CO2培养箱内继续培养。
1.2.2 原代细胞鉴定流式细胞仪检测细胞DNA含量,按正常消化方法收获细胞,PBS洗3次,加入70%乙醇4 ℃固定24 h以上。离心弃去乙醇,4 ℃预冷的冰PBS洗3次,加入RNase 37 ℃消化1 h,加入PI染液室温避光染色30 min,上流式细胞仪检测。
S-P检测抗原,按正常方法消化细胞,制成细胞悬液,接种到24孔板内,每孔加入500 μL完全培养基,放入CO2培养箱内培养。待细胞长到合适密度后,取出培养板,弃去培养基,冰PBS洗3遍,加入4%多聚甲醛室温固定20 min,PBS洗3遍,0.1%Triton X-100室温下打孔通透20 min,PBS洗3遍,正常山羊血清室温封闭20 min,弃去血清,各个孔依次加入CK8、CK18、Vimentin、EMA、CD118一抗(1 :100),4 ℃隔夜孵育,弃去一抗,PBS洗3遍,每次5 min,余下步骤按照S-P试剂盒和DAB显色试剂盒说明操作,显色结束后,在倒置显微镜下观察结果并拍照记录。
1.2.3 Western blot验证融合蛋白表达取含有质粒PET15b-CTP-NPRL2、PET15b-NPRL2的大肠杆菌E.coli DH5α 1 :100接种到新鲜LB培养基里(氨苄青霉素浓度50 μg/mL)37 ℃ 200 r/min隔夜摇菌,4 ℃ 6 000 r/min 离心10 min,收集菌体,提取质粒转化感 受态E.coli BL21,37 ℃ 200 r/min摇菌1 h,3 000 r/min 离心5 min,去上清,加1 mL新鲜LB培养基重悬,涂LB琼脂平板(氨苄青霉素浓度50 μg/mL)。37 ℃隔夜培养,挑单克隆菌落,37 ℃ 200 r/min隔夜摇菌,1 :100 转接加入新鲜LB培养基200 mL(氨苄浓度50 μg/mL),37 ℃ 200 r/min摇菌至光密度值为0.5~1.0,加入IPTG使终浓度为0.5 mmol/L,28 ℃ 150 r/min 诱导10 h,4 ℃ 6 000 r/min 离心10 min,PBS洗2遍,加入10 mL 超声裂解液,冰浴超声,超声条件:功率200 W,超声 5 s,间歇5 s,共20 min。4 ℃ 10 000 r/min离心15 min 收集上清,融合蛋白以天然、可溶的形式存在于上清中。因pET15b作为载体所表达的基因工程重组蛋白 在其N端带有1个由6个组氨酸组成的标签(His-tag),使用His-tag标签蛋白纯化磁珠进行亲和层析纯化。取纯化好的融合蛋白,BCA测蛋白浓度,调节上样量为50 μg,10%SDS-PAGE电泳跑胶。跑胶结束后,使用PVDF膜转膜,5%脱脂奶粉室温封闭1.5 h,兔抗人NPRL2一抗(1 :1 000)4 ℃隔夜孵育。去除一抗,TBST洗3遍。加入羊抗兔二抗(1 :5 000),室温孵育 1 h。TBST洗3遍,使用ECL发光液试剂盒显影,使用Bio-Rad显影仪显影拍照。
1.2.4 免疫荧光观察融合蛋白在亚细胞中的定位将肾癌原代细胞以每孔1×105接种到6孔板里,分为BLANK组、NPRL2组和CTP-NPRL2组。待细胞融合度达到80%时,分别加入100 μL完全培养基,100 μL 10 μmol/L NPRL2与10 μmol/L CTP-NPRL2融合蛋白,细胞培养箱里培养12 h。弃去培养基,用 PBS浸洗3次,每次3 min。每孔加入200 μL的4%多聚甲醛固定15 min,PBS浸洗3次,每次3 min。0.5%Triton X-100室温通透20 min,PBS浸洗3次,每次3 min。每孔加入200 μL山羊血清,室温封闭30 min。 吸掉多余的封闭液,每孔加入200 μL兔抗6×His-tag一抗(1 :100),4 ℃过夜孵育。吸去一抗,PBST洗3次,每次3 min。每孔加入200 μL FITC荧光标记二抗(1 :100),37 ℃避光孵育1 h。吸出多余二抗,PBST浸洗3次,每次3 min。每孔加入200 μL DAPI染液,避光染色5 min。吸出多余染液,PBST洗3次,每次3 min,使用荧光显微镜观察荧光并拍照。
1.2.5 Transwell检测肾癌原代细胞侵袭能力用50 mg/L Matrigel 1 :8稀释液包被Transwell小室底部膜的上室面,4 ℃风干。吸出培养板中残余液体,每孔加入50 μL含10 g/L BSA的无血清培养液,37 ℃、30 min,吸出残余液体。消化细胞,终止消化后离心弃去培养液,用PBS洗1~2遍,用含BSA的无血清培养基重悬。取细胞悬液200 μL加入Transwell小室,实验分组同1.2.4,每组独立重复3次。24孔板内下室加入500 μL含10%胎牛血清的完全培养基。37 ℃、5%CO2培养12 h。用棉签擦去基质胶和上室内的细胞,使用0.1%结晶紫溶液染色,在显微镜下观察并进行细胞计数。
1.2.6 Transwell检测肾癌原代细胞迁移能力Transwell测迁移能力时不使用基质胶,其他方法步骤同Transwell侵袭实验。
1.2.7 Real-time PCR检测 Raptor、E-cadherin、Vimentin、Fibronectin的表达量实验分组同1.2.4,使用TRIzol提取各组细胞总RNA。分别收集各组细胞,PBS漂洗2 遍,TRIzol提取总RNA,逆转录合成cDNA,以cDNA 为模板进行Real-time PCR。PCR引物如下:E-cadherin上游:5′-ACCATTAACAGGAACACAGG-3′,下游:5′-CAGTCACTTTCAGTGTGGTG-3′;Raptor上游:5′-GCCATTACGGACACGATTGC-3′,下游:5′-CCATGA-TGGCGCTGACAATG-3′;Vimentin上游:5′-GACCTCTA-CGAGGAGGAGAT-3′,下游:5′-TTGTCAACATCCTGTC- TGAA-3′;GAPDH上游:5′-ACCACAGTCCATGCCATCA- C-3′,下游:5′-TCCACCACCCTGTTGCTGTA-3′;Fibronectin 上游:5′-ACAAGCATGTCTCTCTGCCA-3′,下游:5′-TT-TGCATCTTGGTTGGCTGC-3′。PCR循环条件为:95 ℃预变性10 min,95 ℃ 变性15 s,60 ℃退火45 s,72 ℃ 延伸30 s,共40 个循环,72 ℃延伸10 min,实验重复3次。
1.2.8 Western blot检测Raptor、E-cadherin、Vimentin、Fibronectin的表达量将肾癌原代细胞接种到6孔板内,实验分组同1.2.4,分别加入100 μL完全培养基,100 μL 10 μmol/L NPRL2与10 μmol/L CTP- NPRL2融合蛋白,细胞培养箱 里培养24 h。弃去培养基,使用4 ℃预冷的PBS洗2遍。每孔加入150 μL RIPA 裂解液,冰上静置20 min。用细胞刮迅速挂下细胞,温和地转移到离心管内,4 ℃ 12 000 r/min离心10 min。收集上清,BCA测蛋白浓度。调节每孔上样量30 μg,上样跑胶电泳。电泳结束后,使用PVDF膜转膜。5%脱脂奶粉室温封闭1.5 h,兔抗人Raptor、E-cadherin、Vimentin、Fibronectin、GAPDH一抗(1 :1 000)4 ℃隔夜孵育。吸净一抗,TBST洗3遍,每次8min。加入羊抗兔二抗(1 :5 000),室温孵育1 h。TBST洗3遍,每次8 min。使用ECL发光液试剂盒发光,使用Bio-Rad显影仪显影拍照。
1.3 统计学分析数据处理采用Graphpad Prism 5统计软件进行分析,结果以x±s表示,组间均数比较采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 肾癌原代培养通过胶原酶Ⅳ消化后过200目筛网可培养出原代细胞,通过差速贴壁法与多次传代纯化肾癌细胞,观察细胞形态,可见典型的上皮样细胞(图 1)。

|
| A:原代培养2 d;B:原代培养5 d;C:原代培养8 d 图 1 肾癌原代细胞的生长情况 (LM ×100) |
2.2 原代细胞的鉴定
流式细胞术检测细胞周期与细胞DNA含量,G2/G1= 1.80为亚三倍体细胞,细胞周期符合肿瘤细胞的特征。免疫细胞化学检测结果显示,CK8(+)、CK18(+)、Vimentin(+)、EMA(+)、CD117(-),与肾癌标本术后免疫组化结果一致(图 2)。

|
| A:CK8(+);B:CK18(+);C:Vimentin(+);D:EMA(+);E:CD117(-) 图 2 肾癌原代细胞的免疫细胞化学染色(LM×100) |
2.3 Western blot验证融合蛋白表达
原核表达的目的蛋白NPRL2和CTP-NPRL2经纯化后,进行Western blot验证。Western blot检测结果显示在43×103与46×103处有条带,分别是NPRL2和CTP-NPRL2融合蛋白(图 3),证明质粒构建成功且可正常表达目的蛋白。

|
| 1:CTP-NPRL2组;2:NPRL2组 图 3 Western blot验证融合蛋白表达 |
2.4 免疫荧光检测融合蛋白在肾癌原代细胞中的亚细胞定位情况
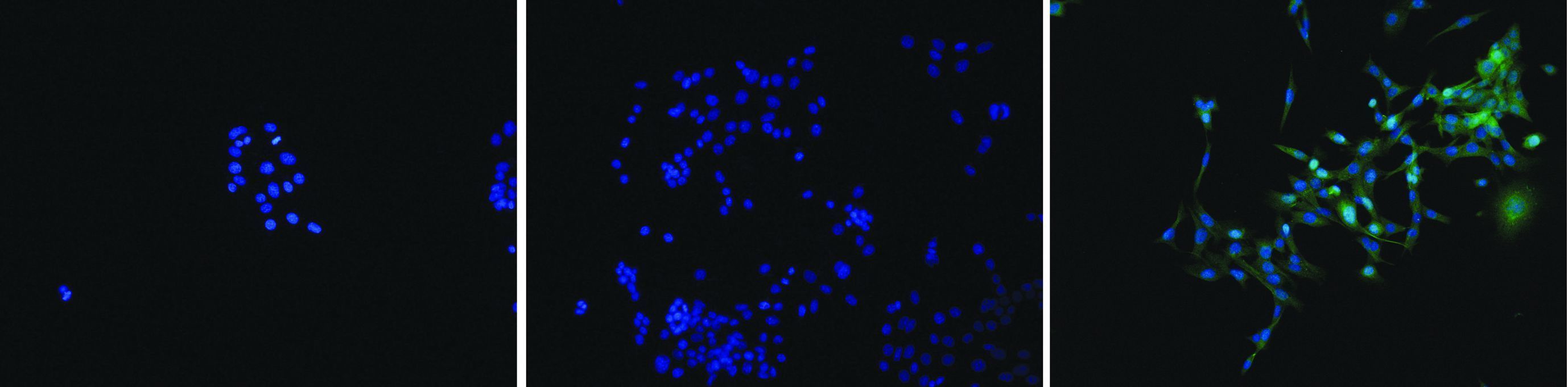
免疫荧光检测结果显示,CTP-NPRL2组可见明显的绿色荧光,证明CTP可介导NPRL2蛋白进入细胞且定位于胞浆。NPRL2组与BLANK组未见明显绿色荧光(图 4)。
|
| A:BLANK组;B:NPRL2组;C:CTP-NPRL2组 图 4 免疫荧光检测融合蛋白的亚细胞定位 (荧光显微镜 ×100) |
2.5 Transwell侵袭实验结果
Transwell侵袭实验后对各组细胞计数,方差分析结果显示3组之间差异有统计学意义(F=153.9,P<0.05),CTP-NPRL2组细胞数(266.00±38.49)同BLANK组(816.67±43.17)与NPRL2组(821.33±24.11)比较,差异有统计学意义(P<0.05)。结果表明CTP-NPRL2转导入细胞后,肾癌细胞侵袭能力明显下降(图 5)。

|
| A:BLANK组;B:NPRL2组;C:CTP-NPRL2组 图 5 Transwell侵袭实验检测各组侵袭细胞数目变化(LM) |
2.6 Transwell迁移实验结果
Transwell迁移实验后对各组细胞计数,方差分析结果显示,3组之间差异有统计学意义(F=521,P<0.05),CTP-NPRL2组细胞数(285.00±21.41)同BLANK组(893.33±25.22)与NPRL2组(859.45±15.83)比较,差异有统计学意义(P<0.05),NPRL2组与BLANK组比较,差异无统计学意义(P>0.05)。结果表明CTP-NPRL2转导入细胞后,肾癌细胞迁移力明显下降(图 6)。

|
| A:BLANK组;B:NPRL2组;C:CTP-NPRL2组 图 6 Transwell迁移实验检测各组侵袭细胞数目变化 (LM) |
2.7 Real-time PCR检测E-cadherin、Vimentin、Fibronectin和Raptor的表达量
Real-time PCR检测结果显示,CTP-NPRL2组与另外2组相比,E-cadherin表达量明显增加(P<0.05),Vimentin、Raptor、Fibronectin表达量明显下降(P<0.05,表 1)。
| 组别 | E-cadherin | Vimentin | Fibronectin | Raptor |
| BLANK组 | 1.015±0.222 | 1.006±0.136 | 1.037±0.355 | 1.017±0.036 |
| NPRL2组 | 1.091±0.023 | 0.923±0.014 | 0.962±0.136 | 1.063±0.029 |
| CTP-NPRL2组 | 1.936±0.023a | 0.152±0.213a | 0.623±0.026a | 0.446±0.005a |
| a:P<0.05,分别与BLANK组和NPRL2组比较 | ||||
2.8 Western blot检测E-cadherin、Vimentin、Fibronectin和Raptor的表达量
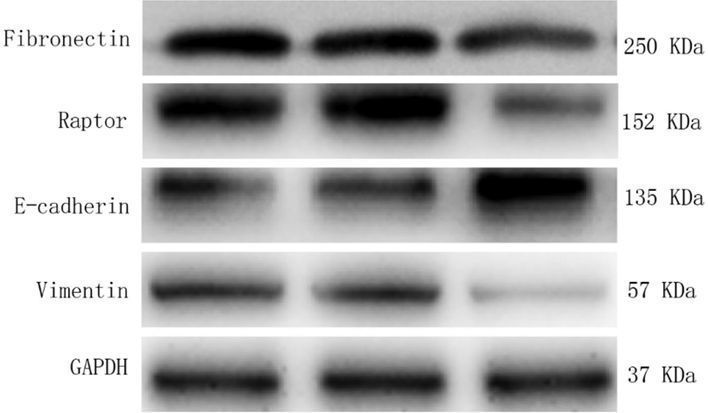
Western blot检测结果显示,CTP-NPRL2组与另外2组相比E-cadherin表达量增加,Vimentin、Fibronectin和Raptor表达量下降(图 7)。
|
| 1:BLANK组;2:NPRL2组;3:CTP-NPRL2组 图 7 Western blot检测E-cadherin、Vimentin、Fibronectin和Raptor蛋白的表达 |
3 讨论
目前针对肾透明细胞癌已建立了多种细胞系,但细胞系在建立过程中经过了多次传代,而经过体外多次传代的细胞为适应体外的生存环境,细胞形态、遗传物质同体内的肾癌细胞相比都发生了变化,即使是不同的肾透明细胞癌细胞系之间也有差别。直接用原代癌细胞进行体外实验,更能反映不同肿瘤的个体差异,在肿瘤临床诊断和治疗监测方面具有重要的意义。Perego等[11]培养了14例肾细胞癌原代细胞,并通过免疫组化、2-DE、Western blot、质谱分析比较了肾癌原代细胞与对应的肾癌组织蛋白表达谱的变化,结果表明短期的原代培养的细胞蛋白质表型与相应肾癌组织极为相似,因此证明利用原代培养对进行蛋白质相关方面的研究具有重要意义。本研究通过胶原酶消化肾癌组织块,过200目筛网后种植培养,成功培育出肾癌原代细胞,并通过免疫细胞化学鉴定。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种丝/苏氨酸蛋白激酶,在细胞生长、增殖、分化、细胞周期调控等多个方面起到重要作用。近年来发现mTOR相关的信号通路复杂且涉及面广泛,其中某些因素的调控与肿瘤的发生、发展密切相关。mTOR在生物体中的存在形式为mTORC1(mTOR complex 1)与mTORC2(mTOR complex 2),其中mTORC1由mTOR、Raptor、GβL、PRAS40组成。mTORC1现在被认为与肾细胞癌的病因有关,60%~85%的肾透明细胞癌中mTORC1表现活跃[12-13]。Kwak等[14]通过研究发现NPRL2可以通过与Raptor相互作用影响mTORC1的活性,进而改变细胞的多项功能。
上皮-间质转化的概念最初是在1982年Greenburg等[15]发现晶状体上皮细胞可以在胶原凝胶中转化为间质细胞样形态而被提出的。EMT是一种基本的生理病理现象,是胚胎发育中及形态发生过程中的 重要组成部分。EMT不仅在多细胞生物胚胎发育过程中起作用,而且在肿瘤迁移侵袭中也起着重要作用[16]。在肿瘤EMT过程中,上皮标志物E-cadherin表达下调,间质标志物Vimentin、N型钙粘蛋白(N-cadherin)、 Fibronectin等表达上调,表现为上皮源性的肿瘤细胞失去细胞极性,细胞间的连接变得疏松,肿瘤细胞的粘附能力下降,迁移侵袭能力增强;同时抵抗凋亡的能力增强,使得肿瘤细胞易于离开原有位置,发生原位浸润或者随血行、淋巴等途径转移到体内其他器官或组织[17]。侵袭性与转移能力是癌细胞区别于正常细胞的最基本特征,越来越多的证据表明,EMT是肿瘤侵袭和转移的一个早期标志[18]。Sugimoto等[19]发现在73例肾透明细胞癌中E-cadherin低表达,而Vimentin呈高表达,说明肾癌发生、发展过程中与EMT存在密切关系。Piva等[10]探讨了EMT在肾细胞癌中可能的分子机制,并指出EMT可以作为肾癌治疗的潜在靶点。Gulhati等[20]发现mTORC1和mTORC2可以通过RhoA和Rac1信号通路调节EMT,改变结直肠癌的转移能力,他们使用雷帕霉素抑制mTORC1和mTORC2的活性,减弱了结直肠细胞迁移侵袭能力。这一发现使通过药物作用于mTOR通路相关因子来抑制肿瘤细胞的迁移侵袭能力成为可能。
本实验通过构建PET15b-CTP-NPRL2与PET15b-NPRL2原核表达质粒,转入E.coli BL21菌株内,成功表达重组蛋白CTP-NPRL2与NPRL2,并通过Western blot验证目的蛋白的表达。同时利用CTP可以介导蛋白质大分子进入细胞并定位于胞浆的特性[21],成功将CTP-NPRL2融合蛋白导入肾癌原代细胞内,并通过免疫荧光确认重组蛋白定位于胞浆中。将重组蛋白导入肾癌细胞后,Transwell迁移侵袭实验发现肾癌细胞迁移和侵袭能力下降。Real-time PCR检测mTORC1关键因子Raptor和EMT相关标志物E-cadherin、Vimentin、Fibronectin的表达水平变化,并通过Western blot验证相关蛋白的表达量,结果显示将CTP-NPRL2融合蛋白转入肾癌细胞内后,CTP-NPRL2组Raptor因子与Vimentin、 Fibronectin的mRNA、蛋白表达水平与NPRL2 组和BLANK组相比明显降低(P<0.05);CTP-NPRL2组E-cadherin的mRNA、蛋白表达水平与NPRL2组和BLANK组相比明显升高(P<0.05)。结果说明NPRL2可以通过调节Raptor影响mTORC1的活性,进而调节EMT相关蛋白E-cadherin、Vimentin、Fibronectin的表达量,降低肾癌细胞的迁移侵袭能力。
综上所述,本研究利用CTP将NPRL2蛋白转入肾癌原代细胞内,降低了肾癌细胞的迁移侵袭能力,原因可能是通过mTORC1影响了EMT进程,为今后转移性肾癌的治疗提供了一个新的靶点和方向。
| [1] | Siegel R L, Miller K D, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin,2016, 66 (1) : 7 –30. DOI:10.3322/caac.21332 |
| [2] | Ljungberg B, Bensalah K, Canfield S, et al. EAU guidelines on renal cell carcinoma: 2014 update[J]. Eur Urol,2015, 67 (5) : 913 –924. DOI:10.1016/j.eururo.2015.01.005 |
| [3] | Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin,2016, 66 (2) : 115 –132. DOI:10.3322/caac.21338 |
| [4] | Alonso A H, García M C, Enguita C G. Is there a role for systemic targeted therapy after surgical treatment for metastases of renal cell carcinoma?[J]. World Journal of Nephrology,2015, 4 (2) : 254 –262. DOI:10.5527/wjn.v4.i2.254 |
| [5] | Najjar Y G, Rini B I. Novel agents in renal carcinoma: a reality check[J]. Ther Adv Med Oncol,2012, 4 (4) : 183 –194. DOI:10.1177/1758834012443725 |
| [6] | Lerman M I, Minna J D. The 630-kb Lung Cancer Homozygous Deletion Region on Human Chromosome 3p21.3: Identification and Evaluation of the Resident Candidate Tumor Suppressor Genes[J]. Cancer Research,2000, 60 (21) : 6116 –6133. |
| [7] | Li J, Wang F, Haraldson K, et al. Functional characterization of the candidate tumor suppressor gene NPRL2/G21 located in 3p21.3C[J]. Cancer Res,2004, 64 (18) : 6438 –6443. DOI:10.1158/0008-5472.CAN-03-3869 |
| [8] | Ji L, Nishizaki M, Gao B, et al. Expression of several genes in the human chromosome 3p21.3 homozygous deletion region by an adenovirus vector results in tumor suppressor activities in vitro and in vivo[J]. Cancer Res,2002, 62 (9) : 2715 –2720. |
| [9] | Tang Y, Jiang L, Tang W. Decreased expression of NPRL2 in renal cancer cells is associated with unfavourable pathological, proliferation and apoptotic features[J]. Pathol Oncol Res,2014, 20 (4) : 829 –837. DOI:10.1007/s12253-014-9761-2 |
| [10] | Piva F, Giulietti M, Santoni M, et al. Epithelial to Mesenchymal Transition in Renal Cell Carcinoma: Implications for Cancer Therapy[J]. Mol Diagn Ther,2016, 20 (2) : 111 –117. DOI:10.1007/s40291-016-0192-5 |
| [11] | Perego R A, Bianchi C, Corizzato M, et al. Primary cell cultures arising from normal kidney and renal cell carcinoma retain the proteomic profile of corresponding tissues[J]. J Proteome Res,2005, 4 (5) : 1503 –1510. DOI:10.1021/pr050002o |
| [12] | Pantuck A J, Seligson D B, Klatte T, et al. Prognostic relevance of the mTOR pathway in renal cell carcinoma: implications for molecular patient selection for targeted therapy[J]. Cancer,2007, 109 (11) : 2257 –2267. DOI:10.1002/cncr.22677 |
| [13] | Robb V A, Karbowniczek M, Klein-Szanto A J, et al. Activation of the mTOR signaling pathway in renal clear cell carcinoma[J]. J Urol,2007, 177 (1) : 346 –352. DOI:10.1016/j.juro.2006.08.076 |
| [14] | Kwak S S, Kang K H, Kim S, et al. Amino acid-dependent NPRL2 interaction with Raptor determines mTOR Complex 1 activation[J]. Cell Signal,2016, 28 (2) : 32 –41. DOI:10.1016/j.cellsig.2015.11.008 |
| [15] | Greenburg G, Hay E D. Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells[J]. J Cell Biol,1982, 95 (1) : 333 –339. DOI:10.1083/jcb.95.1.333 |
| [16] | Thiery J P, Acloque H, Huang R Y, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell,2009, 139 (5) : 871 –890. DOI:10.1016/j.cell.2009.11.007 |
| [17] | Kalluri R, Neilson E G. Epithelial-mesenchymal transition and its implications for fibrosis[J]. J Clin Invest,2003, 112 (12) : 1776 –1784. DOI:10.1172/JCI20530 |
| [18] | Thiery J P. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer,2002, 2 (6) : 442 –454. DOI:10.1038/nrc822 |
| [19] | Sugimoto M, Kohashi K, Itsumi M, et al. Epithelial to Mesenchymal Transition in Clear Cell Renal Cell Carcinoma with Rhabdoid Features[J]. Pathobiology,2016, 83 (6) : 277 –286. DOI:10.1159/000445752 |
| [20] | Gulhati P, Bowen K A, Liu J, et al. mTORC1 and mTORC2 regulate EMT, motility, and metastasis of colorectal cancer via RhoA and Rac1 signaling pathways[J]. Cancer Res,2011, 71 (9) : 3246 –3256. DOI:10.1158/0008-5472.CAN-10-4058 |
| [21] | Kim D, Jeon C, Kim J H, et al. Cytoplasmic transduction peptide (CTP): new approach for the delivery of biomolecules into cytoplasm in vitro and in vivo[J]. Exp Cell Res,2006, 312 (8) : 1277 –1288. DOI:10.1016/j.yexcr.2005.12.029 |



