2. 610083 成都, 成都军区总医院心血管内科
2. Department of Cardiovascular Diseases, General Hospital of Chengdu Military Command, Chengdu, Sichuan Province, 610083, China
Yang Dachun, E-mail: yangdachun2010@126.com
糖尿病是当前威胁全球人类健康的最重要的非传染性疾病(non communicable diseases,NCD)之一。根据国际糖尿病联盟IDF 统计 2015年全球糖尿病患者人数已达4.15亿,严重威胁着人类的生命安全和健康[1]。文献[2]报道,糖尿病患者罹患心血管疾病的风险远高于正常人,其中67.1%伴有血脂异常,并且血脂异常被证实是导致这一现象的主要原因。因此有必要研究高糖尤其是高脂状态下心肌易损性的机制与防范措施。
神经萎缩症蛋白1(optical atrophy-1,OPA1)是线粒体塑形蛋白家族的成员,通过不同位点的剪接,形成多种亚型,参与线粒体内膜融合,对线粒体形态结构有着重要的作用[3]。最近的研究表明其与心血管疾病密切相关。其中,文献[4-5]报道OPA1水平的降低会导致活性氧簇(reactive oxygen species,ROS)生成增加从而加重病理性心肌肥厚;并且,OPA1的动态失衡会加重心力衰竭的发生、发展。然而,OPA1在糖尿病心肌损伤中的表达情况以及功能研究较少。本实验通过模拟高糖尤其是高脂状态,旨在研究糖尿病心肌细胞中OPA1的作用及其相关机制,为糖尿病心肌损伤的防治提供新的理论依据和治疗靶点。
1 材料与方法 1.1 材料 1.1.1 细胞小鼠心肌细胞系(MCM,中国医学科学院基础医学研究所细胞资源中心),分为3组:高糖+0 μmol/L 软脂酸钠组、高糖+200 μmol/L软脂酸钠组、高糖+400 μmol/L软脂酸钠组,并分别干预8 h和16 h。而后,采用siRNA敲低心肌OPA1表达,进一步将400 μmol/L软脂酸钠组分为:对照组、OPA1 siRNA干预组、Scra siRNA干预组、OPA1 siRNA+NAC干预组。
1.1.2 试剂高糖型(4 500 mg/L)DMEM培养基(HyClone公司);胎牛血清(Sigma公司);TRIzol(美国Invitrogen公司);反转录及PCR检测试剂盒(TaKaRa公司);q-PCR引物(成都擎科梓熙生物技术有限公司);胰酶(Sigma公司);凋亡试剂盒(美国BD公司);Dihydroethidium超氧化物阴离子荧光探针(碧云天公司);ROS ELISA试剂盒(贝塞维斯公司);OPA1 siRNA及scra siRNA来源(Santa Cruz Biotechnology);抗氧化剂N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC,碧云天公司)。
1.2 方法 1.2.1 高糖高脂心肌细胞的培养细胞在高糖培养基(4 500 mg/L)中生长融合至80%~90%时,用0.25%不含EDTA胰蛋白酶消化,按1:2将细胞悬液接种于培养瓶中,置于5% CO2、37 ℃培养箱中培养。选择生长良好的对数生长期细胞,按细胞数为1×105/mL,接种于6孔培养板中,给予不同浓度软脂酸钠培养基培养并按分组进行实验。
1.2.2 q-PCR检测心肌细胞OPA1表达水平采用TRIzol提取小鼠心肌细胞的总RNA,再逆转录为cDNA,采用q-PCR法进行基因扩增测量OPA1表达量。GADPH为内参基因,用2-ΔΔCt处理数据。
1.2.3 Western blot检测心肌细胞OPA1含量取50 μg蛋白样品,用SDS-PAGE电泳分离,然后转至PVDF膜上,于5%牛奶中室温封闭1 h。再用抗OPA1抗体 (1:200),抗GAPDH抗体(1:3 000)孵育,于4 ℃过夜。洗膜后再用二抗孵育(37 ℃,1 h),然后发光并分析结果。
1.2.4 流式细胞仪检测心肌细胞凋亡水平用0.25%不含EDTA的胰酶消化收集细胞,用预冷PBS洗涤后Binding Buffer重悬细胞,加入Annexin V-FITC混匀后,室温避光孵育15 min,检测前5 min 再加入PI染液,流式细胞仪检测细胞凋亡,Flowjo软件分析数据。
1.2.5 心肌细胞转染细胞培养生长融合至70%左右,按照试剂盒说明通过转染试剂以50 nmol/L OPA1 siRNA或Scrambled siRNA (SANTA CRUZ BIOTECHNOLOGY)对心肌细胞进行转染。
1.2.6 ELISA试剂盒测定细胞培养基上清中ROS的表达按说明书操作。
1.2.7 DHE染色实验将DHE 荧光探针按5 μmol /L 浓度用培养基稀释后加入到各组细胞培养基中,各重复3孔,37 ℃避光孵育30 min,采用倒置荧光显微镜检测DHE 荧光水平。
1.3 统计学处理采用SPSS 17.0统计软件,计量资料以x±s表示,采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 高脂增加心肌细胞凋亡通过对心肌细胞采取不同浓度软脂酸钠干预后,在不同的时间节点经流式细胞术发现:心肌细胞凋亡水平随着软脂酸钠的浓度增加及干预时间的延长而增加(P<0.05,图 1)。结果表明,在同样高糖环境下,脂浓度的增加会加剧心肌的凋亡。
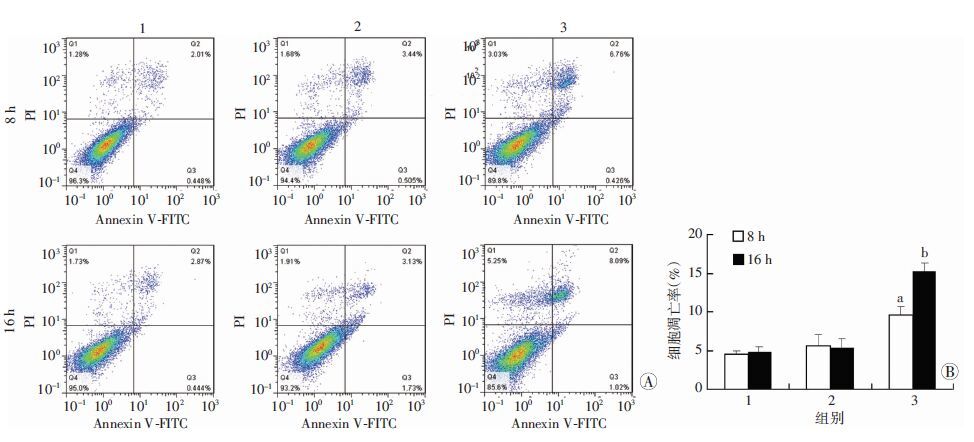
|
| 1:高糖+0 μmol/L软脂酸钠组;2:高糖+200 μmol/L软脂酸钠组;3:高糖+400 μmol/L软脂酸钠组; A:流式细胞仪检测结果;B:各组细胞凋亡率比较 a:P<0.05,与8 h高糖+0 μmol/L软脂酸钠组比较; b:P<0.05,与8 h高糖+400 μmol/L软脂酸钠组比较 图 1 流式细胞仪检测高脂对心肌细胞凋亡的影响 |
2.2 高脂降低心肌细胞OPA1表达
在对心肌细胞高糖高脂干预16 h的基础上,通过q-PCR检测发现脂浓度在400 μmol/L时,OPA1表达水平明显减少(P<0.05,图 2A),与Western blot检测结果一致(图 2B)。上述结果提示,较之单纯的高糖环境,高脂环境下心肌细胞OPA1表达水平有明显下降,表明OPA1可能介导了高糖高脂对心肌细胞的损伤作用。
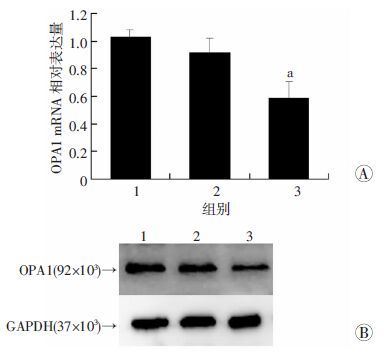
|
| 1:高糖+0 μmol/L软脂酸钠组;2:高糖+200 μmol/L软脂酸钠组;3:高糖+400 μmol/L软脂酸钠组;A:q-PCR检测结果 a :P<0.05,与高糖+0 μmol/L软脂酸钠组比较;B:Western blot检测结果 图 2 OPA1在高糖高脂干预的心肌细胞中的表达 |
2.3 高脂增加心肌细胞ROS生成
为进一步探索心肌细胞在高糖、高脂环境中的损伤情况及其机制,本实验采用了DHE染色及ELISA试剂盒对高糖高脂干预下心肌细胞进行了检测。结果发现,与单纯高糖对照组相比,高糖叠加高脂组ROS水平显著升高(P<0.05,图 3),提示OPA1的降低可能是导致心肌细胞中氧化应激反应增强的原因所在。
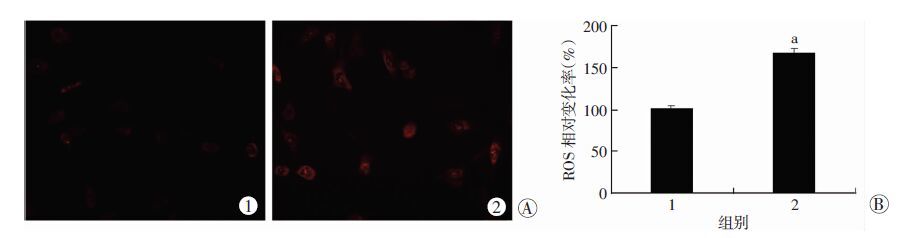
|
| 1:高糖+0 μmol/L软脂酸钠;2:高糖+400 μmol/L软脂酸钠;A:DHE染色结果(×200);B:ELISA检测结果 a :P<0.05,与高糖+0 μmol/L软脂酸钠组比较 图 3 高脂对心肌细胞ROS生成的影响 |
2.4 下调OPA1加重心肌细胞的凋亡及ROS的产生
为了验证OPA1在高糖高脂环境下对心肌细胞的作用,采用OPA1 siRNA敲低了心肌细胞中OPA1的水平。通过q-PCR和Western blot检测明确了OPA1的敲低效率(P<0.05,图 4A、B),表明成功抑制了心肌中OPA1的表达。经流式细胞仪及ELISA试剂盒检测发现,OPA1降低明显地增加了细胞凋亡与ROS含量(P<0.05,图 4C、D)。这些结果提示,OPA1是高糖、高脂环境下心肌细胞不可缺少的保护性分子。
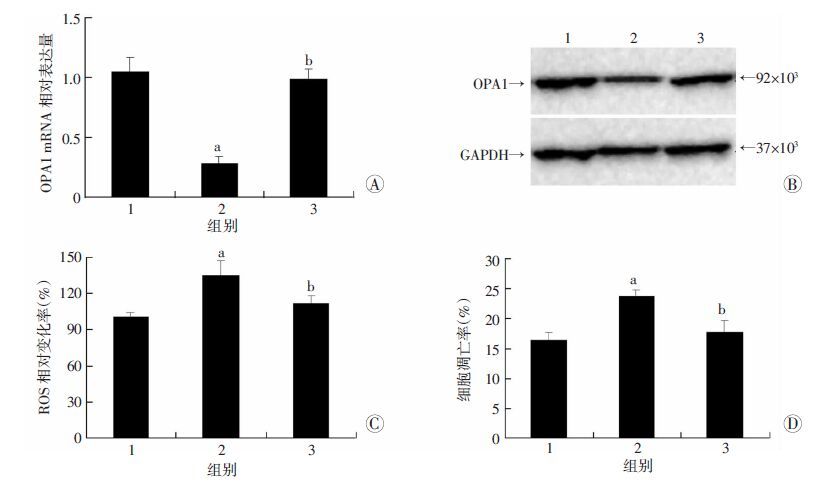
|
| 1:对照组;2:OPA1 siRNA干预组;3:Scra siRNA干预组;a :P<0.05 ,与对照组比较; b:P<0.05,与OPA1 siRNA干预组比较 A:q-PCR检测结果;B:Western blot检测结果;C:ELISA检测结果;D:流式细胞仪检测结果 图 4 OPA1降低对心肌细胞凋亡及ROS产生的影响 |
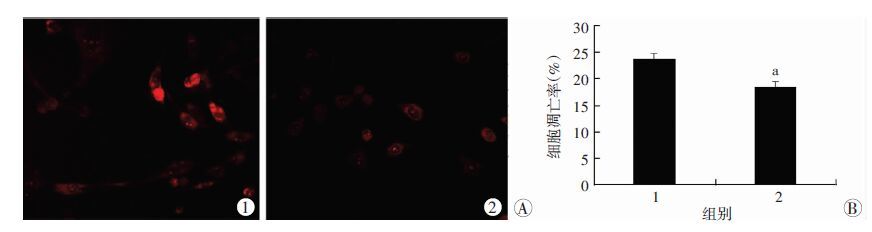
2.5 NAC逆转OPA1下调导致的心肌损伤
DHE染色及流式细胞仪检测发现,用OPA1 siRNA 干扰后的细胞,在加用抗氧化剂NAC(5 mmol/L)干预6 h后,心肌细胞超氧阴离子水平及细胞凋亡明显减少(P<0.05,图 5A、B)。表明OPA1通过抑制氧化应激发挥了心肌保护作用。
|
| 1:OPA1 siRNA干预组;2:OPA1 siRNA+NAC干预组;A:DHE染色结果(×200);B:流式细胞仪检测结果 a :P<0.05 ,与OPA1 siRNA干预组比较 图 5 NAC对OPA1降低所致的心肌凋亡的影响 |
3 讨论
糖尿病不仅给患病个体带来了肉体和精神上的损害并导致寿命的缩短,还给个人和国家带来了沉重的经济负担。糖尿病患者罹患心血管疾病的风险远高于非糖尿病患者,并且有研究表明67.1%的糖尿病患者都伴有血脂异常[6-7]。并且,大量研究表明,血脂异常是糖尿病及其并发症发生、发展的主要因素[8-9]。因此,深入研究高糖高脂状态下心血管损伤的干预靶点和治疗措施是很有必要的。研究发现在很多心血管疾病中OPA1均明显下调,如病理性心肌肥厚,心力衰竭等[10-11]。这些结果均说明OPA1可能在心血管疾病中发挥着作用。但目前糖尿病心肌损伤的研究中,OPA1在糖尿病心肌病中的表达水平及其在疾病发生、发展的机制鲜有报道。
为了适应不同的压力状态,线粒体一直处于融合和分裂的动态变化中,而这些变化大多由一些功能蛋白所介导[12]。Mfn1/2和OPA1可以导致线粒体融合,相反,Drp1,Fis及MFF被认为与线粒体分裂有关[13-14]。OPA1在线粒体膜间隙及内膜聚集,是调控线粒体融合的关键蛋白,当其功能受损时,会导致线粒体融合与分裂的动态平衡能力下降,最终引起细胞能量代谢紊乱细胞凋亡[15]。现有研究发现,线粒体动态的紊乱与心血管疾病密切相关,包括:心肌肥厚,心肌缺血再灌注损失和心力衰竭等[10-11]。而导致这一系列疾病的原因中,ROS生成的增加起着不可忽视的作用[16]。其中,值得注意的是,文献[4]报道在病理性心肌肥厚中,当线粒体融合蛋白OPA1受损时,其可以导致线粒体的功能障碍,从而增加ROS的生成。与此同时,在经谷氨酸盐处理的H22细胞系中,ROS增加的同时会导致OPA1释放到胞质,并伴有细胞色素c的释放,最终导致细胞的死亡[5]。然而,OPA1在糖尿病心肌损失中的作用尚少见报道。我们的研究发现:高糖高脂能够通过增加ROS的生成从而导致心肌细胞凋亡水平的上升,这些结果与早前的研究一致[17-18]。此外,在高糖高脂干预的心肌细胞中,线粒体融合蛋白OPA1的水平明显下降,提示其可能介导了糖尿病所致的心肌损失。而导致这一现象的机制可能与糖尿病心肌损伤所介导的线粒体功能蛋白功能和形态异常有关,从而使线粒体融合蛋白OPA1的表达量出现明显的下降。为了进一步阐明OPA1在其中的作用,我们给予心肌细胞特异性siRNA来降低心肌线粒体OPA1水平。我们的研究发现,降低OPA1会加重心肌细胞的凋亡及ROS的产生。然而,通过应用抗氧化剂NAC后,上述现象都能发生很大程度的逆转。本研究主要在细胞实验上开展,缺少动物实验方面的数据,在后期的研究中,我们将完善这一部分的内容,从而进一步阐明OPA1在糖尿病心肌病中的作用。
综上所述,本研究结果显示,OPA1可以通过抑制氧化应激,从而减少高糖高脂诱导的心肌细胞凋亡。这为糖尿病患者的心血管防护提供了新的理论基础,有利于开发新的干预靶点和治疗措施。
| [1] | Lien A S, Jiang Y D. Integration of Diffusion of Innovation Theory into Diabetes Care[J]. J Diabetes Investig,2016 . DOI:10.1111/jdi.12568 |
| [2] | Yan L, Xu M T, Yuan L, et al. Prevalence of dyslipidemia and its control in type 2 diabetes: A multicenter study in endocrinology clinics of China[J]. J Clin Lipidol,2016, 10 (1) : 150 –160. DOI:10.1016/j.jacl.2015.10.009 |
| [3] | Kushnareva Y, Seong Y, Andreyev A Y, et al. Mitochondrial dysfunction in an Opa1Q285STOP mouse model of dominant optic atrophy results from Opa1 haploinsufficiency[J]. Cell Death Dis,2016, 7 (7) : e2309 . DOI:10.1038/cddis.2016.160 |
| [4] | Li J, Qi M, Li C, et al. Tom70 serves as a molecular switch to determine pathological cardiac hypertrophy[J]. Cell Res,2014, 24 (8) : 977 –993. DOI:10.1038/cr.2014.94 |
| [5] | Sanderson T H, Raghunayakula S, Kumar R. Release of mitochondrial Opa1 following oxidative stress in HT22 cells[J]. Mol Cell Neurosci,2015, 64 : 116 –122. DOI:10.1016/j.mcn.2014.12.007 |
| [6] | Goldberg I J. Clinical review 124: Diabetic dyslipidemia: causes and consequences[J]. J Clin Endocrinol Metab,2001, 86 (3) : 965 –971. DOI:10.1210/jcem.86.3.7304 |
| [7] | Uusitupa M I, Niskanen L K, Siitonen O, et al. 5-year incidence of atherosclerotic vascular disease in relation to general risk factors, insulin level, and abnormalities in lipoprotein composition in non-insulin-dependent diabetic and nondiabetic subjects[J]. Circulation,1990, 82 (1) : 27 –36. DOI:10.1161/01.CIR.82.1.27 |
| [8] | Cusi K. The role of adipose tissue and lipotoxicity in the pathogenesis of type 2 diabetes[J]. Curr Diab Rep,2010, 10 (4) : 306 –315. DOI:10.1007/s11892-010-0122-6 |
| [9] | DeFronzo R A. Insulin resistance, lipotoxicity, type 2 diabetes and atherosclerosis: the missing links. The Claude Bernard Lecture 2009[J]. Diabetologia,2010, 53 (7) : 1270 –1287. DOI:10.1007/s00125-010-1684-1 |
| [10] | Koshiba T, Detmer S A, Kaiser J T, et al. Structural basis of mitochondrial tethering by mitofusin complexes[J]. Science,2004, 305 (5685) : 858 –862. DOI:10.1126/science.1099793 |
| [11] | Cipolat S, Martins de Brito O, Dal Zilio B, et al. OPA1 requires mitofusin 1 to promote mitochondrial fusion[J]. Proc Natl Acad Sci U S A,2004, 101 (45) : 15927 –15932. DOI:10.1073/pnas.0407043101 |
| [12] | Ozcan C, Palmeri M, Horvath T L, et al. Role of uncoupling protein 3 in ischemia-reperfusion injury, arrhythmias, and preconditioning[J]. Am J Physiol Heart Circ Physiol,2013, 304 (9) : H1192 –H1200. DOI:10.1152/ajpheart.00592.2012 |
| [13] | Teshima Y, Akao M, Jones S P, et al. Uncoupling protein-2 overexpression inhibits mitochondrial death pathway in cardiomyocytes[J]. Circ Res,2003, 93 (3) : 192 –200. DOI:10.1161/01.RES.0000085581.60197.4D |
| [14] | Youle R J, van der Bliek A M. Mitochondrial fission, fusion, and stress[J]. Science,2012, 337 (6098) : 1062 –1065. DOI:10.1126/science.1219855 |
| [15] | Liesa M, Palacín M, Zorzano A. Mitochondrial dynamics in mammalian health and disease[J]. Physiol Rev,2009, 89 (3) : 799 –845. DOI:10.1152/physrev.00030.2008 |
| [16] | Pei H, Yang Y, Zhao H, et al. The Role of Mitochondrial Functional Proteins in ROS Production in Ischemic Heart Diseases[J]. Oxid Med Cell Longev,2016, 2016 : 5470457 . DOI:10.1155/2016/5470457 |
| [17] | Ji L, Liu Y, Zhang Y, et al. The antioxidant edaravone prevents cardiac dysfunction by suppressing oxidative stress in type 1 diabetic rats and in high-glucose-induced injured H9c2 cardiomyoblasts[J]. Can J Physiol Pharmacol,2016, 94 (9) : 996 –1006. DOI:10.1139/cjpp-2015-0587 |
| [18] | Dal S, Jeandidier N, Seyfritz E, et al. Featured Article: Oxidative stress status and liver tissue defenses in diabetic rats during intensive subcutaneous insulin therapy[J]. Exp Biol Med,2015, 241 (2) : 184 –192. DOI:10.1177/1535370215603837 |



