维生素A (vitamin A, VA)是一类脂溶性必需微量营养素,包括视黄醇、视黄醛和视黄酸(retinoic acid, RA)。其作用主要通过活性代谢产物视黄酸特异性识别核受体后发挥调节靶基因,参与免疫、视觉、生长发育及中枢神经系统发育等多种生理功能。成年脑组织是RA含量较高的组织之一,尤其是海马RA含量居全脑首位[1],海马与学习记忆功能密切相关,海马组织主要表达视黄酸受体(retinoic acid receptor, RAR)α和RARγ[2],本课题组前期研究证实孕期开始维生素A缺乏(vitamin A deficiency, VAD)影响子代的学习记忆功能[3-4], 子代海马组织中RARα表达水平降低[4-5]。同时我们还发现,随着大鼠大脑的发育、突触的形成及神经功能的完善,海马组织中RARα蛋白表达呈现胞核向胞浆转位的现象[6],这种转位的发生是否与神经元突触可塑性密切相关,进而影响机体的学习记忆功能呢?为此,本研究利用大鼠模型探讨RARα的胞浆定位表达与大鼠学习记忆功能的关系,利用PC12细胞经NGF诱导向神经元成熟分化模型探讨胞浆RARα的表达与神经元突触可塑性间的关系。
1 材料与方法 1.1 实验材料及主要试剂清洁级5周龄Sprague-Dawley (SD)大鼠购自重庆医科大学实验动物中心,体质量105~125 g,雌雄不限,饲养于重庆医科大学附属儿童医院动物中心。肾上腺嗜铬细胞瘤细胞(pheochromocytoma cell line,PC12细胞系)购买于中国科学院上海细胞生物研究所细胞库,PC12细胞属于类神经细胞,经NGF诱导后其在形态、生理功能方面更接近成熟神经元[7-8],PC12细胞向神经元成熟分化的过程用作大鼠学习记忆功能加强的体外模型。主要实验试剂:RARα腺相关病毒(上海和元生物);mRNA提取试剂盒、RIPA裂解液(变性型)和BCA蛋白浓度测定试剂盒(中国Bioteke公司);胞浆胞核蛋白提取试剂盒(美国thermo公司);RARα一抗羊抗大鼠和GluR1一抗兔抗大鼠(英国abcam公司);二抗兔抗羊和二抗羊抗兔(中国中杉金桥公司);NGF (美国Promega公司);DAPI (美国sigma-alorich公司);ECL发光液和PVDF膜(美国millipore公司)。
1.2 实验方法 1.2.1 大鼠海马定位注射RARα腺相关病毒序列:RARα shRNAs,上游:5′-GATCCCCCCAAGGAG-TCGGTGCGAAA CTCGAGTTTCGCACCGACTCCTTGGTT-TTT-3′,下游:5′-tcgaaaaaaCCAAGGAGTCGGTGCGAAA-CTCGAGTTTCGCACCGACTCCTTGGGGG-3′;shRNA control,上游:5′-GATCCCCTTCTCCGAACGTGTCACGTTT-CAAGAGAACGTGACACGTTCGGAGAATTTTTTGTAC-3′,下游:5′-aaaaaaTTCTCCGAACGTGTCACGTTCTCTTG-AAACGTGACACGTTCGGAGAAGGG-3′。将普通7周龄大鼠完全随机化分为AAV-control shRNA组(n=8)和AAV-RARα shRNAs组(n=9),苯巴比妥(0.4 mg/100 g)腹腔注射麻醉大鼠后固定,暴露前囟,注射位置定于前囟后3.5 mm、左右侧开1.7 mm,含有相同病毒滴度和体积的微量注射泵自注射位置垂直进针3.7 mm,注射完毕后停针2 min,待病毒吸收完毕后退针,缝合伤口。
1.2.2 组织冰冻切片及病毒自带荧光观察大鼠病毒注射2周后麻醉,手术迅速暴露心脏行PBS灌注、4%多聚甲醛固定,取出完整脑组织用含30%蔗糖的4%多聚甲醛进行后固定、冰冻、切片(厚度15 μm),胞核染色(DAPI)后封片,荧光显微镜下观察。
1.2.3 水迷宫(MWM)训练及测试水迷宫训练实验将普通7周龄大鼠完全随机化分为对照组(n=6)和水迷宫训练组(n=6);水迷宫测试实验则分别测试病毒注射2周后的AAV-control shRNA组和AAV-RARα shRNAs组大鼠。圆柱形水池(直径180 cm, 高60 cm)水深40 cm,水温(22.0±0.5)℃,水池平均分成4个象限,平台(直径10 cm)固定于其中一个象限的中心位置,水池正上方的摄像头追踪大鼠轨迹。(1)适应训练:第1天将大鼠分别从4个象限的入水点放入水中游行60 s,熟悉平台位置。(2)定位航行实验:第2天到第5天,平台置于水下1.5 cm,将大鼠依次从4个象限的入水点放入水中,记录其在60 s内找到平台的时间,若60 s内找到平台,则立即停止计时并将其取出;若60 s后未找到平台,则人为引导大鼠上平台并使其在平台上停留30 s,每次训练间隔15~30 min。(3)空间探索实验:第6天,撤走平台,将大鼠从平台所在象限的对侧象限入水点放入水池,记录60 s内大鼠在平台象限所待的时间及穿越平台所在区域的次数。
1.2.4 PC12细胞培养PC12细胞在含有10%马血清,5%胎牛血清,100 U/mL青霉素,100 g/L链霉素的1640培养基中培养,置于37 ℃、5% CO2细胞培养箱中进行常规培养和传代。实验分为对照组和NGF (50 ng/mL)诱导组。
1.2.5 细胞免疫荧光将PC12细胞按2.5×103/孔接种于24孔板中,于第7天进行细胞免疫荧光实验。固定(甲醇:冰乙酸为3:1)、打孔(0.2% Triton X-100)、封闭(5% BSA),RARα一抗(1:50)4 ℃孵育过夜,荧光二抗(1:100)室温避光孵育1 h,DAPI避光染核,荧光显微镜观察。
1.2.6 qPCR检测水迷宫训练组和未训练组大鼠及病毒海马定位注射2周后的大鼠分别进行海马组织总RNA提取,将2 μg总RNA逆转录成cDNA,以cDNA为模板进行实时荧光定量核酸扩增反应。引物序列:RARα上游:5′-ATTGCCGACCAGATTACC-3′,下游:5′-AAAGCCAGCGTTGTGC-3′;GAPDH上游:5′-CCTGGAGAAACCTGCCAAG-3′,下游:5′-CACAGGA-GACAACCTGGTCC-3′。
1.2.7 Western blot水迷宫训练组和未训练组大鼠海马组织、病毒海马定位注射2周后的大鼠海马组织及NGF诱导组和对照组的PC12细胞分别进行总蛋白(RIPA试剂盒)和胞浆蛋白、胞核蛋白(胞浆胞核蛋白提取试剂盒)的提取。40 μg蛋白样本采用8% SDS-PAGE恒压电泳后转至PVDF膜、5% BSA封闭,一抗4 ℃孵育过夜,二抗室温孵育1 h,ECL发光法检测目的蛋白条带,Image J软件对目的蛋白条带进行灰度值分析。
1.2.8 钙影像PC12细胞以2×103/孔接种于35 mm培养皿中,于第7天进行钙影像检测,HBSS清洗细胞2次,fluo-4 am避光孵育30 min后HBSS洗2次,不含Mg2+的HBSS溶液孵育5 min后上机检测细胞内钙离子的震荡效应,CCD (CoolSNAP HQ2, USA)每1 s拍照1次,持续1 min,每2 s拍照1次,持续4 min,全程记录340 nm和380 nm两个波段的荧光,最开始10 s为基线测定,10 s后加适量ATP刺激液,记录所测时间点上每个待测细胞的F340 nm/F380 nm荧光强度比值作为跨细胞Ca2+浓度,峰值同基线的差异值作为细胞Ca2+震荡效应。
1.2.9 细胞膜片钳PC12细胞以2×103/孔接种于6孔板内8 mm×8 mm的玻片上,于第7天进行全细胞膜片钳检测,贴有细胞的玻片孵育在含有细胞外液的暗槽中,毛细玻璃管制成的1 μm的微电极内加入电极内液,采用高阻抗封接、负压打孔的技术形成全细胞钳制,AXOPATCH 200B和Digidata 1322 interface进行信息采集。
1.3 统计学方法采用GraphPad Prizm 5.0统计软件,计量资料用x±s表示,两组间采用t检验,检验水准α=0.05。
2 结果 2.1 Morris水迷宫训练对大鼠海马组织RARα和GluR1表达水平的影响PCR结果显示训练组大鼠海马RARα mRNA表达水平(0.011 1±0.000 8)较未训练组(0.008 1±0.000 2)显著升高(P < 0.01),Western blot结果表明训练组RARα和GluR1的总蛋白表达水平显著增加,且以胞浆蛋白升高明显,RARα胞核蛋白表达水平降低。蛋白条带灰度值量化分析结果显示,训练组与未训练组差异具有统计学意义(P < 0.01,图 1)。
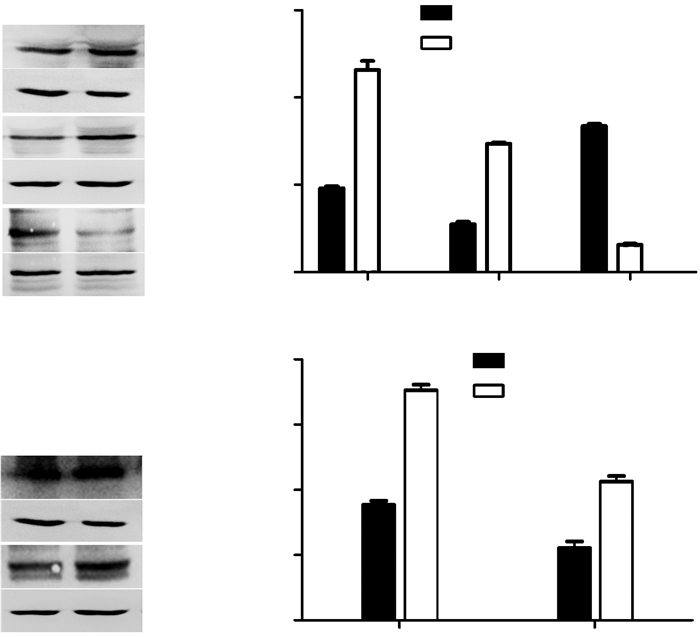
|
| A、C:RARα、GluR1 Western blot检测结果(n=3);B、D:RARα、GluR1半定量分析结果;1:未训练组;2:训练组;a:P < 0.01,与未训练组比较 图 1 水迷宫训练后大鼠海马组织RARα和GluR1的表达水平变化 |
2.2 海马定位注射腺相关病毒RARα shRNA对大鼠学习记忆功能的影响
冰冻切片观察示海马组织有大量绿色荧光表达,表明海马定位注射成功(图 2)。定位航行实验结果如图 3A所示,第1天两组大鼠寻找平台的潜伏期无差异,表明两组大鼠视力和运动能力相当;随着训练天数(第2~5天)的增加,两组大鼠寻找平台的潜伏期均呈逐渐缩短的趋势,但AAV-RARα shRNAs组大鼠潜伏期显著长于AAV-control shRNA组(P < 0.05, P < 0.01,图 3A);第6天空间探索实验发现,AAV-RARα shRNAs组大鼠穿越平台的次数明显少于AAV-control shRNA组大鼠(P < 0.05,图 3B)。

|
| 图 2 腺相关病毒海马定位注射荧光表达结果 |
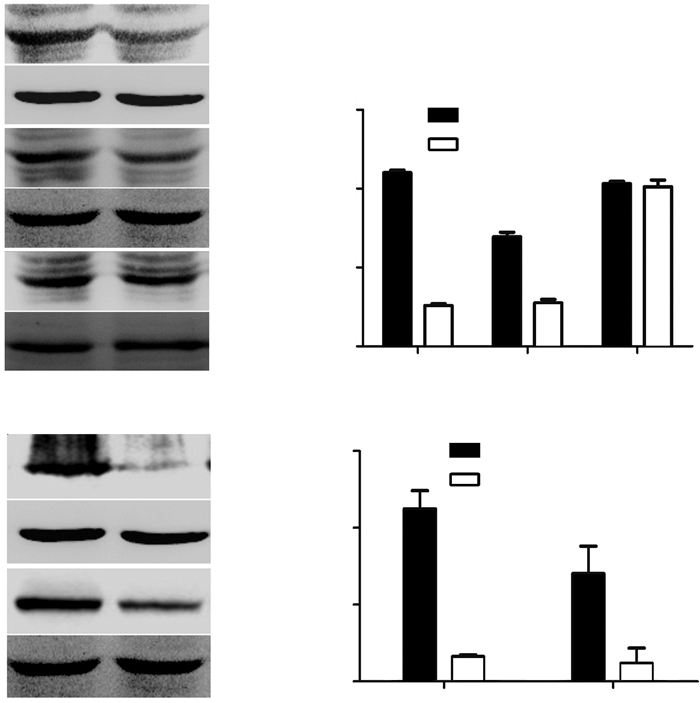
|
| A:水迷宫结果;B:第6天穿越平台的次数;a:P < 0.05, b:P < 0.01, 与AAV-control shRNA组比较 图 3 海马定位注射腺相关病毒RARα shRNAs减弱大鼠的学习记忆功能 |
2.3 海马定位注射腺相关病毒RARα shRNAs降低海马RARα和GluR1表达水平
与AAV-control shRNA组(0.003 9±0.000 2)比较,AAV-RARα shRNAs组(0.003 0±0.000 2)大鼠海马组织中RARα mRNA表达水平明显降低(P < 0.01),AAV-RARα shRNAs注射还显著降低海马中RARα总蛋白表达水平(图 4A),表明RARα shRNAs腺相关病毒有效发挥作用。随着RARα总蛋白表达水平的降低,海马中GluR1总蛋白表达水平也显著下降,且两者均以胞浆蛋白水平降低最为明显,而RARα胞核蛋白表达水平变化并不明显。蛋白条带灰度值量化分析结果显示两组差异具有统计学意义(P < 0.01,图 4B、D)。

|
| A、C:RARα、GluR1 Western blot检测结果(n=3);B、D:RARα、GluR1半定量分析结果;1:AAV-control shRNA组;2:AAV-RARα shRNAs组;a:P < 0.01,与AAV-control shRNA组比较 图 4 海马定位注射AAV-RARα shRNAs减少大鼠海马组织RARα和GluR1表达水平 |
2.4 NGF诱导的PC12细胞中RARα及GluR1表达水平
随着NGF诱导PC12细胞时间的延长,我们发现PC12细胞逐渐出现突起,且部分突起相互交联,从形态上更接近于成熟神经元(图 5A),同时免疫荧光染色观察,RARα在诱导后PC12细胞的胞浆及突起中也有表达(图 5B)。Western blot结果显示,经NGF诱导后,RARα和GluR1总蛋白表达水平均显著升高,尤以胞浆蛋白水平升高明显,而RARα胞核蛋白水平却有下降。条带灰度值量化分析结果显示,两组表达差异均具有统计学意义(P < 0.01,图 5C~F)。
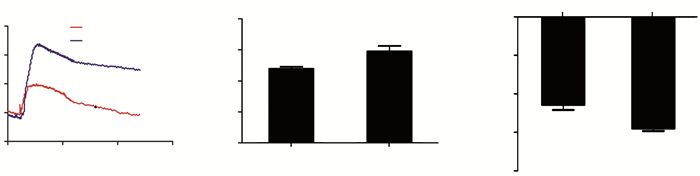
|
| A:倒置显微镜下观察PC12细胞;B:荧光显微镜下观察PC12细胞;C、E:RARα、GluR1 Western blot检测结果(n=3);D、F:RARα、GluR1半定量分析结果;a:P < 0.01,与对照组比较 图 5 NGF诱导的PC12细胞中RARα和GluR1蛋白表达水平变化 |
2.5 NGF诱导的PC12细胞中Ca2+浓度及静息膜电位变化
细胞钙影像测定结果发现,NGF诱导的PC12细胞对ATP的刺激更加敏感,胞内Ca2+浓度较对照组显著升高(P < 0.05,图 6A、B)。膜片钳检测发现NGF诱导的PC12细胞静息膜电位为(-29±3) mV,与对照组(-21±5) mV相比更接近于体外培养的神经元静息膜电位,且两组差异具有统计学意义(P < 0.01,图 6C)。
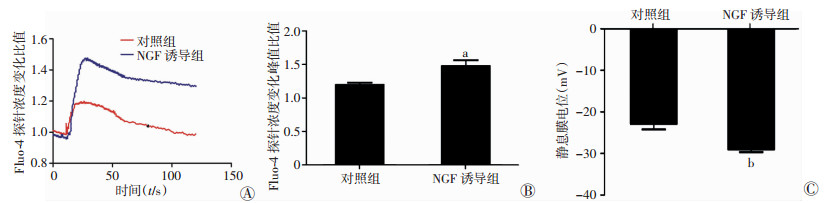
|
| A:细胞胞内钙活性检测结果(n=3);B:细胞胞内钙活性变化峰值比(n=3);C:细胞静息膜电位检测结果,对照组(n=7),NGF诱导组(n=8);a:P < 0.05, b:P < 0.01, 与对照组比较 图 6 NGF诱导增加PC12细胞胞内钙活性及提高细胞的静息膜电位 |
3 讨论
在发育中神经系统,RA信号在神经发生与神经元分化方面发挥作用,主要通过核受体与相关配体结合后发挥调节靶基因的作用[9]。近几年,RA定位在神经元树突,对突触可塑性稳态的作用受到高度关注,但是RA以主动的方式作为重要信号分子调节神经元可塑性主要在体外成熟的神经元和脑片两个系统进行[9],体内研究和发育中神经系统研究尚未见报道。VA及其活性代谢产物RA不仅参与胚胎期中枢神经系统功能的形成,对成年及老年期的学习记忆功能、神经可塑性等也有重要作用[10-11]。剥夺成年鼠的VA营养会减少其海马神经元的数量,影响机体学习记忆功能,VA补充(VA supplement, VAS)可以促进VAD大鼠的神经元生成、部分改善学习记忆能力[10],VAS还可以部分恢复年老引起的学习记忆功能障碍[12]。本课题组前期研究发现RARα是海马组织优势核受体,VAD时海马组织RARα表达降低,学习记忆功能受损[4-5];将RARα的选择性抑制剂R041-5253加入人工脑脊液浸泡的正常大鼠海马组织切片中,海马LTP水平明显降低[13]。在发育过程中海马RARα表达存在从胞核到胞浆的转位现象[6],但是RARα胞浆表达与神经元分化和学习记忆关系不甚了解,本研究发现在发育中海马神经元胞浆RARα定位对学习记忆有重要作用。
3.1 海马组织胞浆表达RARα对大鼠学习记忆的影响RARα作为体内重要的核转录因子,与特定基因的视黄酸反应元件(retinoic acid reaction element, RARE)结合而调节其转录[14],但也有研究发现RARα不仅位于胞核,在胞浆、突触和胞膜也有表达[15-16]。在体外成熟神经元和脑片实验中发现树突RARα与局部突触可塑性密切相关[9]。为了探讨胞浆RARα是否与神经元突触可塑性和学习记忆功能有关,本研究采用水迷宫训练加强大鼠学习记忆功能,结果发现其海马组织RARα总蛋白表达水平增高,并以胞浆RARα蛋白表达水平升高明显,而胞核RARα明显降低;当海马定位注射腺相关病毒抑制RARα表达后,水迷宫测试实验结果提示,与AAV-control shRNA组比较,AAV-RARα shRNAs组大鼠学习记忆功能受损,且其海马组织RARα的mRNA及总蛋白和胞浆蛋白表达水平降低,而胞核蛋白表达水平变化不明显。提示海马神经细胞胞浆RARα表达水平与大鼠学习记忆功能密切相关。
3.2 胞浆RARα通过调控GluR1的表达参与学习记忆功能长时程增强(long-term potentiation, LTP)是突触可塑性的重要组成部分[17],LTP的诱导依赖于突触前膜兴奋性递质谷氨酸的释放及突触后膜谷氨酸受体的激活,谷氨酸受体(glutamate receptors,GluRs)有多种亚型,其中GluR1参与中枢神经系统兴奋性突触的传递,调节学习记忆活动。有研究已证实RARα从胞核转移至胞浆RNA颗粒中[18],RNA颗粒主要在形成和维持突触可塑性时快速合成突触相关蛋白[19],其中GluR1就可在胞浆或突触中合成[18, 20]。在成熟神经元,RARα作为mRNA-binding蛋白是否参与调节GluR1的表达?Maghsoodi[21]等研究发现在突触可塑性的自稳态时,突触中的RARα可以直接调控GluR1的翻译;Chen等[15]还发现atRA通过胞膜上的RARα促进胞浆中GluR1的翻译,诱导海马神经元树突棘的形成; Poon等[18]进一步研究证实RARα通过其C-端F区与目的mRNA连接,从而控制目的基因包括GluR1的翻译。我们的研究发现,通过水迷宫训练加强大鼠学习记忆功能后,海马组织胞浆蛋白RARα和GluR1表达水平均同时明显升高;采用AAV-RARα shRNAs海马定位注射抑制RARα表达后大鼠学习记忆功能明显降低,GluR1胞浆蛋白表达水平也随着海马组织胞浆蛋白RARα表达水平的抑制而显著降低,提示胞浆中RARα通过调控GluR1的表达水平而参与机体的学习记忆功能。
3.3 体外神经细胞分化成熟过程中胞浆RARα和GluR1变化Chen等[15]通过体外培养神经元研究,发现位于神经元胞膜的RARα介导atRA依赖的树突棘的形成,进一步表明RARα在胞浆表达与神经元突触的成熟密切相关。本课组前期研究发现,大鼠海马组织中RARα蛋白表达随着大鼠脑的发育及突触的成熟呈现胞核向胞浆转位的现象[6]。本研究模拟体内神经元成熟过程,当PC12细胞经NGF体外诱导分化为神经元样细胞,细胞静息膜电位更接近于神经元、胞内钙活性增强之时,胞浆中RARα和GluR1蛋白表达水平均明显增加,进一步提示胞浆或树突RARα蛋白是成熟神经元功能所需,在学习记忆功能中具有重要作用。
综上所述,胞浆RARα是神经元成熟功能需求的表现形式,在RA依赖的突触可塑性稳态中发挥重要作用,在局部通过调节GluR1的快速表达,保持突触可塑性稳态和学习记忆功能。但对发育中海马胞浆RARα蛋白的作用研究甚少,其作用和机制有待进一步深入研究。
| [1] | Werner E A, Deluca H F. Retinoic acid is detected at relatively high levels in the CNS of adult rats[J]. Am J Physiol Endocrinol Metab,2002, 282 (3) : E672 –E678. DOI:10.1152/ajpendo.00280.2001 |
| [2] | Zetterström R H, Lindqvist E, Mata de Urquiza A, et al. Role of retinoids in the CNS: differential expression of retinoid binding proteins and receptors and evidence for presence of retinoic acid[J]. Eur J Neurosci,1999, 11 (2) : 407 –416. DOI:10.1046/j.1460-9568.1999.00444.x |
| [3] | 陈丽娜, 瞿平, 刘友学, 等. 维生素A缺乏对幼鼠脑发育和学习记忆的影响[J]. 营养学报,2002, 24 (2) : 158 –162. DOI:10.13325/j.cnki.acta.nutr.sin.2002.02.011 |
| [4] | Hou N, Ren L, Gong M, et al. Vitamin A deficiency impairs spatial learning and memory: the mechanism of abnormal CBP-dependent histone acetylation regulated by retinoic acid receptor alpha[J]. Mol Neurobiol,2015, 51 (2) : 633 –647. DOI:10.1007/s12035-014-8741-6 |
| [5] | Jiang W, Yu Q, Gong M, et al. Vitamin A deficiency impairs postnatal cognitive function via inhibition of neuronal calcium excitability in hippocampus[J]. J Neurochem,2012, 121 (6) : 932 –943. DOI:10.1111/j.1471-4159.2012.07697.x |
| [6] | Huang H M, Wei H, Zhang X, et al. Changes in the expression and subcellular localization of RARα in the rat hippocampus during postnatal development[J]. Brain Res,2008, 1227 : 26 –33. DOI:10.1016/j.brainres.2009.10.069 |
| [7] | Greene L A, Tischler A S. Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor[J]. Proc Natl Acad Sci U S A,1976, 73 (7) : 2424 –2428. DOI:10.1073/pnas.73.7.2424 |
| [8] | Shafer T J, Atchison W D. Transmitter, ion channel and receptor properties of pheochromocytoma (PC12) cells: a model for neurotoxicological studies[J]. NeuroToxicology,1991, 12 (3) : 473 –492. |
| [9] | Chen L, Lau A G, Sarti F. Synaptic retinoic acid signaling and homeostatic synaptic plasticity[J]. Neuropharmacology,2014, 78 : 3 –12. DOI:10.1016/j.neuropharm.2012.12.004 |
| [10] | Bonnet E, Touyarot K, Alfos S, et al. Retinoic acid restores adult hippocampal neurogenesis and reverses spatial memory deficit in vitamin A deprived rats[J]. PloS One,2008, 3 (10) : e3487 . DOI:10.1371/journal.pone.0003487 |
| [11] | Mingaud F, Mormede C, Etchamendy N, et al. Retinoid hyposignaling contributes to aging-related decline in hippocampal function in short-term/working memory organization and long-term declarative memory encoding in mice[J]. J Neurosci,2008, 28 (1) : 279 –291. DOI:10.1523/JNEUROSCI.4065-07.2008 |
| [12] | Etchamendy N, Enderlin V, Marighrtto A, et al. Alleviation of a selective age-related relational memory deficit in mice by pharmacologically induced normalization of brain retinoid signaling[J]. J Neurosci,2001, 21 (16) : 6423 –6429. |
| [13] | 毛春婷, 李廷玉, 刘友学, 等. 孕鼠维生素A边缘缺乏对仔鼠海马长时程增强的影响[J]. 营养学报,2006, 28 (1) : 32 –35. DOI:10.13325/j.cnki.acta.nutr.sin.2006.01.009 |
| [14] | Bastien J, Rochette-Egly C. Nuclear retinoid receptors and the transcription of retinoid-target genes[J]. Gene,2004, 328 : 1 –16. DOI:10.1016/j.gene.2003.12.005 |
| [15] | Chen N, Napoli J L. All-trans-retinoic acid stimulates translation and induces spine formation in hippocampal neurons through a membrane-associated RARα[J]. FASEB J,2008, 22 (1) : 236 –245. DOI:10.1096/fj.07-8739com |
| [16] | Chen N, Onisko B, Napoli J L. The nuclear transcription factor RARα associates with neuronal RNA granules and suppresses translation[J]. J Biol Chem,2008, 283 (30) : 20841 –20847. DOI:10.1074/jbc.M802314200 |
| [17] | Bliss T V, Collingridge G L. A synaptic model of memory: long-term potentiation in the hippocampus[J]. Nature,1993, 361 (6407) : 31 –39. DOI:10.1038/361031a0 |
| [18] | Poon M M, Chen L. Retinoic acid-gated sequence-specific translational control by RARα[J]. Proc Natl Acad Sci U S A,2008, 105 (51) : 20303 –20308. DOI:10.1073/pnas.0807740105 |
| [19] | Krichevsky A M, Kosik K S. Neuronal RNA granules: a link between RNA localization and stimulation-dependent translation[J]. Neuron,2001, 32 (4) : 683 –696. DOI:10.1016/S0896-6273(01)00508-6 |
| [20] | Aoto J, Nam C I, Poon M M, et al. Synaptic signaling by all-trans retinoic acid in homeostatic synaptic plasticity[J]. Neuron,2008, 60 (2) : 308 –320. DOI:10.1016/j.neuron.2008.08.012 |
| [21] | Maghsoodi B, Poon M M, Nam C I, et al. Retinoic acid regulates RARα-mediated control of translation in dendritic RNA granules during homeostatic synaptic plasticity[J]. Proc Natl Acad Sci U S A,2008, 105 (41) : 16015 –16020. DOI:10.1073/pnas.0804801105 |



