胶质瘤是颅内最常见的原发肿瘤,占颅内肿瘤50%左右。级别越高,恶性程度越高,因此准确地判断胶质瘤的级别,对于治疗方案制定以及预后评估至关重要 [1]。研究表明,磁共振弥散加权成像和灌注成像有助于胶质瘤术前病理级别的准确判断 [2],但这两种成像方法需单独进行,而且灌注成像还需注射造影剂。目前发展起来的磁共振新技术体素内不相干运动扩散加权成像 (IVIM-MRI),无需注射造影剂,即可无创、同时监测组织的弥散和灌注信息。为此,本研究采用IVIM-MRI技术,探讨其对脑胶质术前分级诊断的临床应用价值。
1 材料与方法 1.1 一般资料收集我院2015年7月至2016年7月间,40例有完整临床及MR检查资料的脑胶质瘤患者,其中男性27例,女性13例,年龄25~69岁,平均46.9岁。临床表现有头晕、头痛、语言障碍、肢体乏力、癫痫、发作性意识丧失等。
患者均手术病理证实,Ⅰ级星形细胞瘤4例,Ⅱ级星形细胞瘤6例,Ⅱ级混合型星形细胞瘤2例,Ⅱ级少突胶质细胞瘤6例;Ⅲ级间变型少突胶质细胞瘤8例,Ⅲ级间变混合型星形细胞瘤4例和Ⅳ级胶质母细胞10例。根据WHO 2007版中枢神经系统肿瘤分类及分级标准,低级别者18例,高级别者22例。高、低级别的判定以病理结果为金标准。
1.2 检查方法 1.2.1 扫描方法所有患者均采用GE Signa HDxt 1.5 T 超导型磁共振仪8通道头颅相控阵线圈检查,分别行常规MR平扫、增强及IVIM-MRI序列扫描。常规MR包括平时T1WI、T2WI、T2FLAIR序列和横、冠、矢状位增强检查,IVIM-MRI参数如下:14个 b 值 (0、20、40、80、100、120、150、200、400、600、800、1 000、 1 200、1 500 s/mm2),TR =6 000 ms,TE=Min(61.9-64.9)ms,FOV:24.0 cm,矩阵:128×130,层厚: 6.0 mm,层间距=1.0 mm。NEX=2;扫描层数23层,扫描时间280 s。扫描范围覆盖全脑,对比剂使用莫迪司(钆贝葡胺注射液),采用高压注射器右肘正中静脉注入,流速4 mL/s,注入量为:体质量(kg)×0.1 mmol/kg,注射完毕后以同样流速立即注入等量生理盐水,使对比剂充分进入体内。
1.2.2 IVIM图像处理及数据提取分析IVIM图像经ADW4.6后处理工作站,运用Functool(版本: 9.04.06)软件包中MADC软件进行图像后处理分析,首先进行头动校正(Apply correction),然后调整阈值去除背景噪声,计算得出ADCstandard、D、D*、f参数伪彩图。感兴趣区(ROI)的选择:结合增强图像,在ADCstandard图上采用手绘法在肿瘤实质区域(增强图像病灶强化最明显区域)、瘤周区(病灶边缘2.0 cm内)、对侧正常半卵圆中心区内分别勾画出至少3个不同的感兴趣区,ROI的面积大小范围为50~100 mm2,需避开囊变、坏死、颅内动静脉、出血、钙化的区域,最后选择具有最小ADCstandard值的那个区域。所有参数均在此ROI中进行计算,ADCstandard值计算公式如下: S(b)/S(0)=exp(b×ADC);D、D*、f值计算公式如下:
| $S\left( b \right)/{S_0} = f \times \exp \left[ { -b \times D* + \left( {1 -f} \right) \times \exp \left( { -b \times D} \right)} \right]$ |
采用SPSS 13.0统计软件。计量资料以x±s表示,采用t检验,P<0.05表示差异有统计学意义;对各参数的关系进行Pearson相关性分析;绘制每个参数的受试者工作特征(ROC)曲线,并对曲线下面积(AUC)进行分析,以确定对高、低级别胶质瘤进行分级的最佳参数。
2 结果 2.1 肿瘤实质区、瘤周区及对侧半卵圆中心的IVIM各参数比较分析40例患者IVIM图像经后处理后,分别计算肿瘤实质区、瘤周区、对侧半卵圆中心的ADCstandard、D 、D*、f的平均值(表 1)。采用配对t检验比较分析,结果显示肿瘤实质区、瘤周区的ADCstandard、D 、D*值均明显高于对侧半卵圆中心,差异有统计学意义(P<0.05),而f值与对侧半卵圆中心区差别不大;肿瘤实质区D 、D*值高于瘤周区,差异有统计学意义(P<0.05),而ADCstandard、f值与瘤周区差别不大。
| IVIM参数 | 肿瘤实质区 | ROI瘤周区 | 半卵圆中心 | t值 | P值 |
| ADCstandard(×10-3mm2/s) | 1.27±0.33 | 1.24±0.33 | 0.72±0.06 | 10.143a | 0.000a |
| 0.341b | 0.735b | ||||
| 9.839c | 0.000c | ||||
| D(×10-3mm2/s) | 0.97±0.29 | 0.79±0.18 | 0.67±0.12 | 6.653a | 0.000a |
| 3.643b | 0.001b | ||||
| 3.409c | 0.002c | ||||
| D*(×10-3mm2/s) | 25.66±11.86 | 22.22±9.63 | 17.76±5.36 | 5.116a | 0.000a |
| 2.154b | 0.038b | ||||
| 3.035c | 0.004c | ||||
| f | 0.39±0.11 | 0.37±0.12 | 0.39±0.05 | -0.098a | 0.923a |
| 1.017b | 0.315b | ||||
| -0.953c | 0.347c | ||||
| a、b、c:分别表示肿瘤实质区与半卵圆中心、肿瘤实质区与瘤周区、瘤周区与半卵圆中心比较 | |||||
2.2 高、低级别胶质瘤间IVIM各参数比较分析
高、低级别胶质瘤的肿瘤实质区、瘤周区及对侧半卵圆中心区ADCstandard、D 、D*、f的平均值(表 2)。高级别胶质瘤组肿瘤实质区ADCstandard值、D值均低于低级别组,两者比较有统计学差异(t=4.391、P=0.000,t=6.236、P=0.000);高级别者肿瘤实质区 D*、f值高于低级别者 (t=-5.290、P=0.000,t= -7.177、P=0.000),两者比较差异均有统计学意义(图 1、2)。
| IVIM参数ROI | 高级别(22例) | 低级别(18例) | t值 | P值 |
| ADCstandard(×10-3 mm2/s) | ||||
| 肿瘤实质区 | 1.09±0.22 | 1.48±0.32 | 4.391 | 0.000 |
| 瘤周区 | 1.28±0.32 | 1.19±0.32 | -0.888 | 0.380 |
| 半卵圆中心区 | 0.72±0.06 | 0.71±0.05 | -0.323 | 0.748 |
| D(×10-3mm2/s) | ||||
| 肿瘤实质区 | 0.78±0.17 | 1.21±0.23 | 6.236 | 0.000 |
| 瘤周区 | 0.76±0.15 | 0.83±0.21 | 1.097 | 0.279 |
| 半卵圆中心区 | 0.64±0.11 | 0.71±0.12 | 1.792 | 0.081 |
| D*(×10-3mm2/s) | ||||
| 肿瘤实质区 | 32.65±9.91 | 17.12±7.74 | -5.290 | 0.000 |
| 瘤周区 | 26.74±9.56 | 16.69±6.24 | -3.744 | 0.001 |
| 半卵圆中心区 | 20.12±5.00 | 14.88±4.26 | -3.435 | 0.001 |
| f | ||||
| 肿瘤实质区 | 0.47±0.08 | 0.29±0.07 | -7.177 | 0.000 |
| 瘤周区 | 0.43±0.12 | 0.30±0.07 | -4.420 | 0.000 |
| 半卵圆中心区 | 0.39±0.04 | 0.39±0.06 | 0.151 | 0.880 |
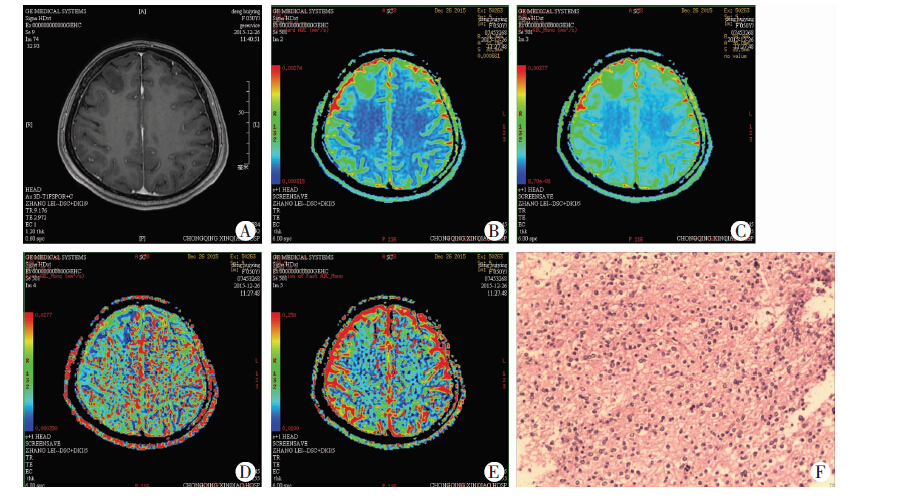
|
| A:术前头颅MR增强 示右侧额叶片状未强化低信号影;B:ADCstandard值伪彩图 右侧额叶病灶区ADCstandard值为1.46× 10-3mm2/s;C:D值伪彩图 右侧额叶病灶区D值为1.12× 10-3mm2/s:D:D*值伪彩图 右侧额叶病灶区D*值为19.4× 10-3mm2/s;E:f值伪彩图 右侧额叶病灶区f值为0.43;F:术后病理学观察(HE×100) 右侧额叶星形细胞瘤,WHO Ⅱ级 图 1 低级别胶质瘤患者(50岁女性)术前增强MR影像、IVIM各参数伪彩图及术后病理表现 |
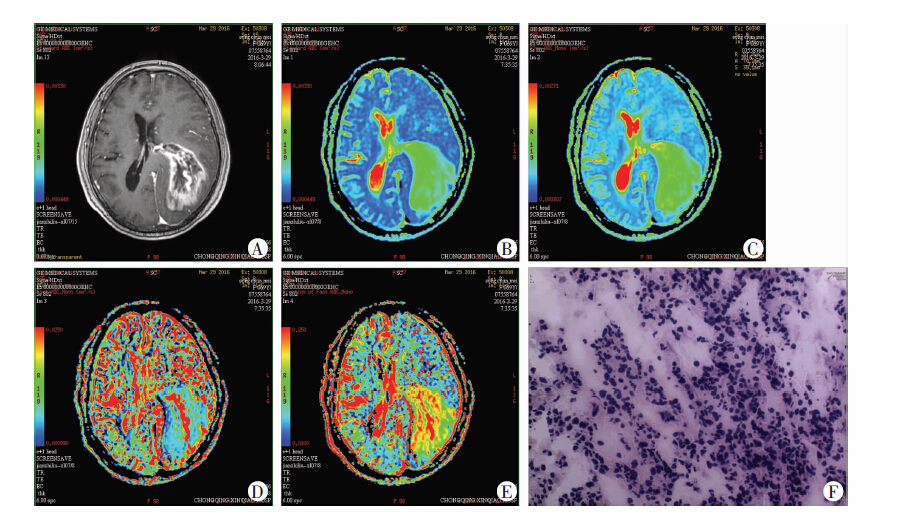
|
| A:术前头颅MR增强 示左侧颞顶叶区不规则环状强化影;B:ADCstandard值伪彩图 左侧颞顶叶病灶区ADCstandard值为 0.96× 10-3mm2/s;C:D值伪彩图 左侧颞顶叶病灶区D值为0.73× 10-3mm2/s;D:D*值伪彩图 左侧颞顶叶病灶区D*值为38.2× 10-3mm2/s;E:f值伪彩图 左侧颞顶叶病灶区f值为0.43;F:术后病理学观察( HE×100) 左侧颞顶叶间变混合型星形细胞瘤,WHO Ⅲ级 图 2 高级别胶质瘤患者(69岁女性)术前增强MR影像、IVIM各参数伪彩图及术后病理表现 |
2.3 IVIM各参数与胶质瘤病理级别的相关性分析
通过Pearson相关性分析发现高、低级别肿瘤分级与ADCstandard、D值呈负相关,与D*、f值呈正相关,且D、f值较好。根据胶质瘤肿瘤实质区ADCstandard、D、D*、f值绘制ROC曲线(图 3),曲线下面积分别为0.851、0.939、0.899、0.957,且对应的诊断阈值分别为1.23× 10-3 mm2/s,0.92× 10-3 mm2/s,20.6× 10-3 mm2/s,0.36;当取灵敏度、特异度均为最高作为高、低级别胶质瘤的鉴别点,诊断的灵敏度、特异度分别为95.5%,84.4%。
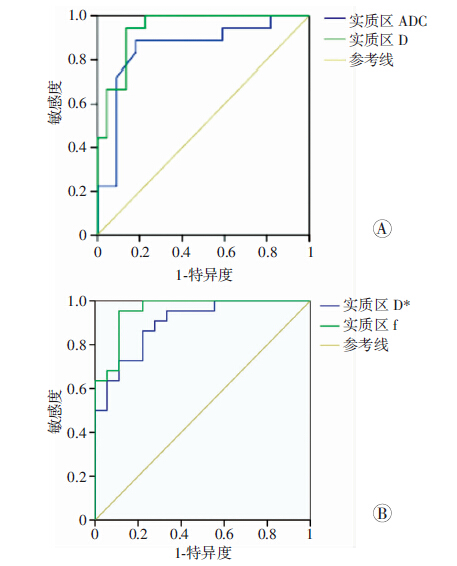
|
| 肿瘤实质区IVIM各参数ROC曲线 图 3 A:肿瘤实质区ADCstandard、D值ROC曲线; B:肿瘤实质区D*、f值ROC曲线 |
3 讨论 3.1 IVIM-MRI原理
常规MR扫描对胶质瘤的微观病理结构、功能状态等显示能力不够,对胶质瘤病理分级的判断存在不足和缺陷 [3-4]。Le Bihan等于1986年首次提出了体素内不相干运动的概念。它是用于描述体素微观运动的一种成像方法,假设血液的微循环和灌注是非一致性、无条理的随机运动,生物体内微观运动包括水分子的扩散和血液的微循环,后者即反映组织的灌注情况 [5]。IVIM成像通过定量参数(ADCstandard、D、 D*、f值)分别评价其中的扩散运动成分和血流灌注成分,可得到感兴趣区扩散及灌注相关信息,对胶质瘤的术前分级诊断有重要价值 [6]。
3.2 IVIM在胶质瘤分级诊断中的价值ADCstandard值主要以肿瘤细胞密度来判定胶质瘤分级。高级别胶质瘤细胞增殖快、数量增多,细胞外间隙缩小,细胞外间隙中的水分子扩散运动受限更明显。因此,高级别胶质瘤ADCstandard值低于低级别胶质瘤。Liu等 [7]发现ADCstandard值对胶质瘤的分级诊断很有价值,它与肿瘤的细胞密度呈负相关。本研究显示高级别组中肿瘤实质区ADCstandard值低于低级别组,结果与该报道相符。然而RydhÖg等 [8]却发现ADCstandard值在高、低级别的胶质瘤间并无统计学差异。分析原因可能是ADCstandard值拟合了肿瘤组织中灌注和扩散的信息,没有考虑到胶质瘤组织和水分子扩散运动的复杂性,使其值在反映肿瘤细胞密度等特征不够准确。本研究虽然采用了14个b值,且计算出的ADCstandard值可区分高、低级别胶质瘤,但其特异性和敏感度均较D值低。D值去除了肿瘤组织内灌注影响因素,能更加准确反映水分子扩散运动受限程度。结果显示胶质瘤患者的D值低于ADCstandard值,高级别胶质瘤组中D值较低级别组低。这可能与高级别胶质瘤细胞比低级别者小、增殖活跃、数量增多、排列紧密、异型性大、细胞外间隙减少等,导致高级别者肿瘤细胞内水分子扩散运动更加受限有关,从而产生了降低D值的影响。研究中通过Pearson相关性分析发现高、低级别肿瘤分级与ADCstandard、D呈负相关。
不需要注射对比剂的IVIM成像技术在低b值(<200 s/mm2)时,组织信号衰减受灌注因素的影响要大于扩散因素(b值越小,灌注影响越明显),能定量计算出病变组织的灌注成分D*、f值。研究发现D*、f值分别与血流量、血容量有关,并且与CBF、K-trans等灌注定量参数存在相关性,对胶质瘤的术前分级诊断有较好的价值 [9-10]。本研究选用了7个低b值(最小20 s/mm2),可较好的反映肿瘤组织中灌注成分,结果显示高、低级别胶质瘤D*均高于对侧半卵圆中心区,且高级别胶质瘤组的D*值显著高于低级别组。分析原因可能与高级别胶质瘤新生血管增多、血供丰富、血流量增加等有关,说明D*值可在一定程度上反映胶质瘤组织的灌注信息,为高、低级别胶质瘤的术前分级提供有价值的信息。研究中测量肿瘤组织内部的D*值差异较大,这可能与肿瘤组织较大的异质性有关,所以D*值反映灌注信息的准确性及与肿瘤组织实际血流量之间的关系还需进一步研究。f值表示微循环所致的灌注效应占总体的扩散效应的容积比率,与血容量有关。研究结果显示高级别胶质瘤组的f值高于低级别组,在胶质瘤的分级中有统计学意义。这与Bisdas等 [11]和Togao等 [12]采用IVIM灌注相关参数D*、f值研究胶质瘤分级的结果一致,而且他们还认为相对于D*值,f值更加均匀且噪声较小,可更好地反映肿瘤组织的灌注信息。通过Pearson相关性分析发现高、低级别肿瘤分级与D*、f值呈正相关。然而Hu等 [13]的研究显示低级别胶质瘤组的f值高于高级别组,且有统计学意义。分析原因可能与他们研究样本量较大(104例),采用了3.0T磁共振扫描设备,选用不同数量、不同大小且跨度大的b值(0~3 500 s/mm2, 13个b值),感兴趣大小选择不同等因素有关。
IVIM成像技术具有区分及定量计算肿瘤组织中水分子自由扩散和灌注相关扩散的优势,对于造影剂过敏、肾功能障碍及妊娠期患者很有价值,可无创、有效的评估胶质瘤分级 [14]。研究中高级别胶质瘤者肿瘤实质区ADCstandard、D值低于低级别者,诊断阈值分别为1.23× 10-3mm2/s,0.92× 10-3 mm2/s,而D*、f值高于低级别者,诊断阈值分别为,20.6× 10-3 mm2/s,0.36,都具有较好的稳定性,且符合胶质瘤组织的生物特性与相关报道结果相符。绘制各IVIM参数ROC曲线发现,f值曲线下面积最大、其次为D值,ADCstandard值最小;当取灵敏度、特异度均为最高作为高、低级别胶质瘤的鉴别点,诊断的灵敏度、特异度分别为95.5%,84.4%。因此对于高、低级别胶质瘤的诊断以D值、f值为最佳参数。
目前IVIM成像技术在最佳b值的设定,提高信噪比,选择最优数据拟合模型及测量数据的准确性等方面仍面临着巨大挑战 [15]。本研究采用1.5T磁共振扫描设备,样本量不大,最大b值为1 500 s/mm2,缺少更高的b值等,可能会对研究结果造成影响。下一步研究有必要扩大样本量,采用3.0T磁共振扫描设备,选择更多及更大范围的b值,探讨IVIM 在胶质瘤术前分级诊断中的应用价值。
| [1] | 林园凯, 李建瑞, 张志强, 等. 体素不相干运动与三维动脉自旋标记在胶质瘤中的对照研究[J]. 临床放射学杂志,2015, 34 (1) : 8 –13. |
| [2] | 黄杰, 李晓光, 康厚艺, 等. DSC-MRI和DCE-MRI定量分析在脑胶质瘤分级诊断中的应用[J]. 第三军医大学学报,2015, 37 (7) : 672 –677. DOI:10.16016/j.1000-5404.201410173 |
| [3] | Jafari-Khouzani K, Emblem K E, Kalpathy-Cramer J, et al. Repeatability of Cerebral Perfusion Using Dynamic Susceptibility Contrast MRI in Glioblastoma Patients[J]. Transl Oncol,2015, 8 (3) : 137 –146. DOI:10.1016/j.tranon.2015.03.002 |
| [4] | Jain K K, Sahoo P, Tyagi R, et al. Prospective glioma grading using single-dose dynamic contrast-enhanced perfusion MRI[J]. Clin Radiol,2015, 70 (10) : 1128 –1135. DOI:10.1016/j.crad.2015.06.076 |
| [5] | Federau C, O'Brien K, Meuli R, et al. Measuring brain perfusion with intravoxel incoherent motion (IVIM): initial clinical experience[J]. J Magn Reson Imaging,2014, 39 (3) : 624 –632. DOI:10.1002/jmri.24195 |
| [6] | Lin Y, Li J, Zhang Z, et al. Comparison of intravoxel incoherent motion diffusion-weighted MR imaging and arterial spin labeling MR imaging in gliomas[J]. Biomed Res lnt,2015, 2015 : 234 –245. DOI:10.1155/2015/234245 |
| [7] | Liu C, Liang C, Liu Z, et al. Intravoxel incoherent motion (IVIM) in evaluation of breast lesions: comparison with conventional DWI[J]. Eur J Radiol,2013, 82 (12) : 782 –789. DOI:10.1016/j.ejrad.2013.08.006 |
| [8] | RydhÖg A S, van Osch M J, Lindgren E, et al. Intravoxel incoherent motion (IVIM) imaging at different magnetic field strengths: what is feasible?[J]. Magn Reson Imaging,2014, 32 (10) : 1247 –1258. DOI:10.1016/j.mri.2014.07.013 |
| [9] | Hu L B, Hong N, Zhu W Z. Quantitative measurement of cerebral perfusion with intravoxel incoherent motion in acute ischemia stroke: initial clinical experience[J]. Chin Med J(Engl),2015, 128 (19) : 2565 –2569. DOI:10.4103/0366-6999.166033 |
| [10] | Santarosa C, Castellano A, Conte G M, et al. Dynamic contrast-enhanced and dynamic susceptibility contrast perfusion MR imaging for glioma grading: Preliminary comparison of vessel compartment and permeability parameters using hotspot and histogram analysis[J]. Eur J Radiol,2016, 6 (85) : 1147 –1156. |
| [11] | Bisdas S, Koh T S, Roder C, et al. Intravoxel incoherent motion diffusion-weighted MR imaging of gliomas: feasibility of the method and initial results[J]. Neuroradiology,2013, 55 (10) : 1189 –1196. DOI:10.1007/s00234-013-1229-7 |
| [12] | Togao O, Hiwatashi A, Yamashita K, et al. Differentiation of high-grade and low-grade diffuse gliomas by intravoxel incoherent motion MR imaging[J]. Neuro Oncol,2016, 18 (1) : 132 –141. DOI:10.1093/neuonc/nov147 |
| [13] | Hu Y C, Yan L F, Wu L, et al. Intravoxel incoherent motion diffusion-weighted MR imaging of gliomas: efficacy in preoperative grading[J]. Sci Rep,2014, 4 : 1 –7. |
| [14] | 李勇. 3D ASL灌注成像、体素内不相干运动扩散加权成像在脑肿瘤诊断和分级中的应用研究[D]. 湖北: 华中科技大学, 2015: 1-102. |
| [15] | 党玉雪, 王晓明. 磁共振新技术DKI和IVIM在中枢神经系统的研究现状[J]. 磁共振成像,2015, 6 (2) : 145 –150. DOI:10.3969/j.issn.1674-8034.2015.02.013 |



