2. 400038 重庆, 第三军医大学: 心理学院发育神经心理学教研室
2. Department of Developmental Neuropsychology, College of Psychology, Third Military Medical University, Chongqing, 400038, China
孕期接触高剂量酒精可以引起胎儿酒精综合征(fetal alcohol syndrome,FAS),主要表现为出生后生长迟缓、异常面容、中枢神经系统的功能障碍等[1-3]。在中枢神经系统中,大脑皮层、小脑皮层及海马等板层样结构对酒精刺激极为敏感[4-5]。在鼠类动物中,小脑是生后发育的器官,且突触形成及细胞迁移的高峰期是在生后3~10 d(相当于人类妊娠晚期)[6-8]。本实验室前期研究显示,新生小鼠在单次酒精注射时可引起小脑小胶质细胞明显活化及炎症因子的大量释放,加之酒精特异性神经毒性作用,会严重损伤小脑浦肯野细胞和伯格曼胶质细胞,以及导致大脑海马区神经干细胞减少,造成难以修复的细胞丢失及行为学功能异常[9-10]。但目前临床上仍未有改善酒精导致的神经损伤的有效措施。
白藜芦醇(resveratrol,RSV)是一种天然的对二苯代乙烯类物质,存在于红葡萄皮和某些药用植物中[11-12]。研究发现白藜芦醇具有抗炎、抗氧化、抗癌、提高免疫系统活性以及心血管、神经保护作用[13-14]。近期研究发现单剂量的白藜芦醇注射就能够减少海马区神经炎症导致的神经干细胞及神经元的丢失[15]。本实验室前期体内及体外实验研究均显示,白藜芦醇单次注射可以明显促进大脑海马区神经干细胞增殖,增加神经元树突棘密度。但是目前白藜芦醇能否改善酒精暴露致新生小鼠小脑发育损伤的相关研究较少。本实验拟采用新生小鼠酒精暴露模型研究白藜芦醇对酒精暴露致新生小脑发育损伤的保护作用。
1 材料与方法 1.1 主要试剂RSV及二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma公司,兔抗小胶质细胞标记物(small glial cell marker,Iba-1)购自Wako公司,兔抗脑脂结合蛋白(brain lipid binding protein,BLBP)和鼠抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)购自Chemicon公司,鼠抗浦肯野细胞标记物(calbindin D-28K,CB)购自Vector公司,DAB显色试剂盒购自北京中杉金桥生物技术有限公司,荧光二抗、生物素化二抗购自Invitrogen公司。
1.2 方法 1.2.1 实验动物及分组健康3月龄C57BL/6雌性与雄性小鼠购自第三军医大学实验动物中心,体质量23~25 g,18~22 ℃饲养,自然昼夜交替采光,自由充足摄取食物和水。将雌雄小鼠随机合笼交配繁育,窝鼠出生后第1个24 h记为PD1。将出生后第6天(PD6)同窝新生小鼠按随机数字表法分成3组:对照组(DMSO+NaCl)、酒精组(DMSO+酒精)和RSV+酒精组,每组4只新生小鼠。
1.2.2 药物处理小鼠PD6时,RSV+酒精组采用腹腔注射(白藜芦醇20 mg/kg,溶剂为DMSO:NaCl=1:3),对照组及酒精组注射等量溶剂;小鼠出生后第7天(PD7)时,酒精组和RSV+酒精组背部皮下注射20%酒精5 g/kg(注射2次,每次2.5 g/kg,间隔2 h,无菌溶剂稀释),对照组背部皮下相同方式注射等量的无菌溶剂。药物注射后继续饲养至出生后第8天(PD8),断头处死各组新生小鼠并取脑组织。
1.2.3 免疫组织化学和免疫荧光染色取材后,将小鼠脑标本置于新鲜配制的4%多聚甲醛(PFA)溶液中固定48 h,随后将脑标本转移至4% PFA+30%蔗糖溶液中,待其充分脱水沉底后,使用Leica冰冻切片机以30 μm切片,选取叶片完整的小脑片子30~40张并转移至防冻液-20 ℃保存备用。每5张片子选取1张合适的切片于PBS漂洗后,3%H2O2溶液37 ℃孵育30 min,PBS漂洗后0.3%Triton X-100 37 ℃反应30 min,分别加入兔来源Iba-1(1:1 000),兔来源BLBP(1:400),小鼠来源GFAP(1:500),小鼠来源CB(1:1 000),4 ℃孵育过夜。PBS漂洗后分别加入生物素化的抗兔IgG,抗兔Cy3及抗小鼠488标记的荧光二抗,并置于37 ℃孵育2 h(抗兔Cy3和抗小鼠488孵育3 h);PBS漂洗后加入链霉亲和素-生物素复合物(SABC)37 ℃反应1 h;PBS漂洗后DAB显色,自然风干,中性树胶封片。BLBP、GFAP和CB免疫荧光二抗孵育后,PBS漂洗3次,DAPI染色,PBS清洗3次后漂片,风干,荧光封片剂封片。每只动物至少选择3张小脑Ⅸ叶片进行研究,10倍光镜下观察浦肯野细胞和小胶质细胞的胞体数,20倍光镜下观察浦肯野细胞树突棘长度和伯格曼胶质细胞(Bergmann glial cell)纤维数。
1.2.4 Western blot检测小脑内核转录因子(nuclear factor-κB,NF-κB)的表达取冻存小脑组织,经组织匀浆器破碎,4 ℃保存细胞30 min,离心,提取上清液,使用BCA蛋白浓度测定试剂盒测定蛋白浓度,再加入加样缓冲液置沸水中煮15 min,室温冷却后分装,放于-80 ℃冰箱冻存备用;制备4%浓缩胶及10%分离胶,加入蛋白样品,上样量为25 μg,电泳分离蛋白质后,转至硝酸纤维素膜;经5%脱脂牛奶封闭4 h后,加入一抗NF-κB(稀释比例为1:1 000)4 ℃过夜,经TBST换洗3次后,加入二抗(稀释比例为1:1 000)37 ℃ 孵育2 h后,TBST换洗3次,用化学发光试剂盒显影。选取β-actin作为内参照。
1.3 统计学分析采用SPSS 18.0统计软件,计量资料以x±s表示,采用单因素方差分析及组间LSD多重比较。P<0.05为差异有统计学意义。
2 结果 2.1 RSV对酒精暴露新生小鼠小脑浦肯野细胞的影响采用浦肯野细胞的标记物CB检测对照组、酒精组及RSV+酒精组的PD8小鼠小脑Ⅸ叶中浦肯野细胞变化。免疫荧光结果显示CB标记的浦肯野细胞分布于整个小脑浦肯野细胞层中,酒精组小脑浦肯野细胞的数量较对照组减少(P<0.05),同时浦肯野细胞的树突结构紊乱且长度较对照组缩短(P<0.05);而RSV+酒精组中,白藜芦醇可改善酒精暴露对浦肯野细胞的损伤作用,使浦肯野细胞数量及树突长度较酒精组增加,差异有统计学意义(P<0.05,图 1)。

|
| A、D:对照组; B、E:酒精组; C、F:RSV+酒精组; D~F:分别为A~C方框的放大;G:浦肯野细胞的胞体数;H:浦肯野细胞的树突棘长度 a:P<0.05,与对照组比较;b:P<0.05,与酒精组比较 图 1 免疫荧光观察RSV对酒精暴露新生小鼠小脑CB标记的浦肯野细胞的影响 |
2.2 RSV对酒精暴露新生小鼠小脑伯格曼胶质细胞的影响
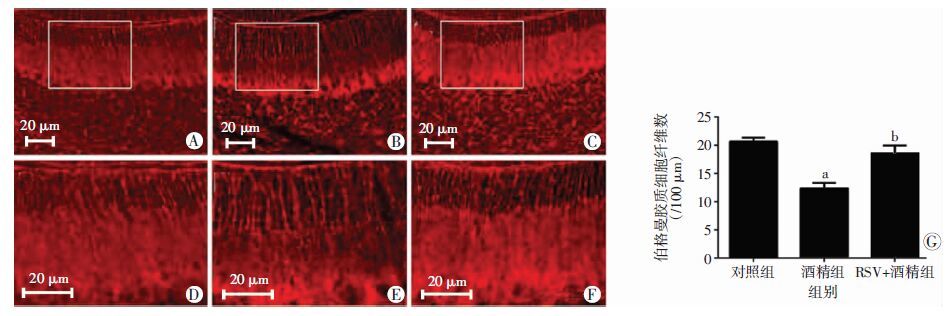
伯格曼胶质细胞纤维作为脚手架介导小脑颗粒细胞的内向性迁移和浦肯野细胞树突生长。采用伯格曼胶质细胞标志物BLBP和GFAP分别进行免疫荧光染色,观察对照组、酒精组及RSV+酒精组的PD8小鼠小脑Ⅸ叶中伯格曼胶质细胞的变化,结果显示酒精组伯格曼胶质细胞纤维的密度较对照组降低(P<0.05);而RSV+酒精组伯格曼胶质细胞纤维密度较酒精组增加(P<0.05,图 2、3)。
|
| A、D:对照组;B、E:酒精组; C、F:RSV+酒精组; D~F:分别为A~C方框的放大;G:BLBP 标记的伯格曼胶质细胞纤维数 a:P<0.05,与对照组比较;b:P<0.05,与酒精组比较 图 2 免疫荧光观察RSV对酒精暴露新生小鼠小脑BLBP标记的伯格曼胶质细胞的影响 |

|
| A、D:对照组; B、E:酒精组; C、F:RSV+酒精组; D~F:分别为A~C方框的放大;G:GFAP标记的伯格曼胶质细胞纤维数 a:P<0.05,与对照组比较;b:P<0.05,与酒精组比较 图 3 免疫荧光观察RSV对酒精暴露新生小鼠小脑GFAP标记的伯格曼胶质细胞的影响 |
2.3 RSV对酒精暴露致新生小鼠小脑小胶质细胞和NF-kB表达的影响
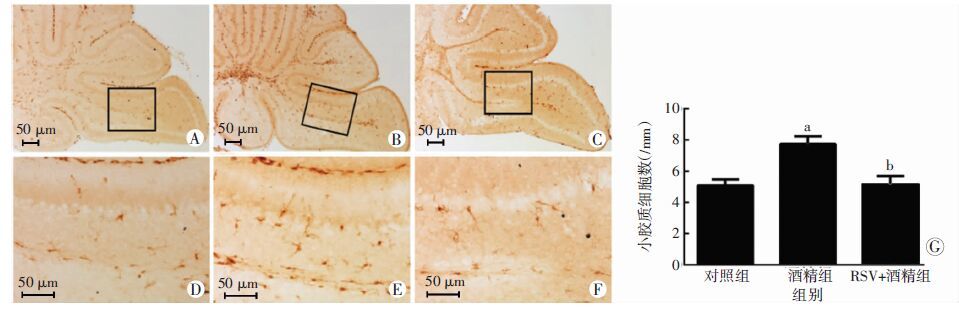
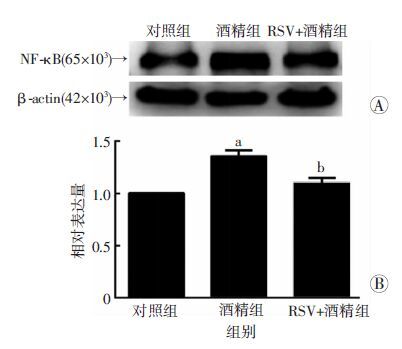
Iba-1作为小胶质细胞的标志物,可以标记静止与活化的小胶质细胞,以此来观察对照组、酒精组及RSV+酒精组的PD8小鼠小脑Ⅸ叶中浦肯野细胞层内小胶质细胞的激活状态。对照组浦肯野细胞层内有少量激活的小胶质细胞,其胞体较大、树突变短增粗,呈阿米巴样。酒精组浦肯野细胞层激活的小胶质细胞数目较对照组增多,差异有统计学意义(P<0.05);而RSV+酒精组中,白藜芦醇可抑制酒精暴露引起的小胶质细胞激活,与酒精组比较差异亦有统计学意义(P<0.05,图 4)。NF-κB作为调节炎症反应的细胞核转录因子,在酒精组的表达较对照组增加,差异有统计学意义(P<0.05);而RSV+酒精组中,白藜芦醇可抑制NF-κB表达,与酒精组比较,差异亦有统计学意义(图 5,P<0.05)。
|
| A、D:对照组; B、E:酒精组; C、F:RSV+酒精组;D~F:分别为A~C方框的放大;G:Iba-1标记的小胶质细胞数 a: P<0.05,与对照组比较;b: P<0.05,与酒精组比较 图 4 RSV对酒精暴露新生小鼠小脑浦肯野细胞层内Iba-1标记的小胶质细胞的影响(SABC) |
|
| A:Western blot检测结果;B:半定量分析结果 a: P<0.05,与对照组比较;b: P<0.05,与酒精组比较 图 5 Western blot检测RSV对酒精暴露新生小鼠小脑内NF-κB水平的影响 |
3 讨论
脑的快速发育期对于不同种类的动物存在差异,在鼠类动物中的这个时期是生后2周内,而在人类则是从孕期第6个月开始到生后的前几年[16]。在人妊娠末期和鼠类动物出生后10 d内新生小鼠的脑快速生长时期进行酒精暴露,对脑能产生神经毒性作用,甚至导致其成年后行为与认知功能的障碍[16-19]。本实验室前期研究中,采用出生后7 d小鼠进行酒精暴露来研究酒精对大脑海马区产生的神经毒性作用,观察到白藜芦醇可以显著改善酒精暴露致新生小鼠大脑海马区神经发育的损伤作用[9-10],但白藜芦醇对于酒精暴露致新生小鼠小脑发育损伤作用的研究不多,其作用途径和作用机制尚不明确。在本研究中,采用生后7 d小鼠进行酒精暴露,观察到白藜芦醇可以通过抑制酒精暴露引起的小胶质细胞活化和NF-κB表达水平上调,进而降低酒精暴露对于新生小鼠小脑浦肯野细胞和伯格曼胶质细胞的毒性作用,逆转酒精暴露对新生小鼠小脑的神经毒性作用。
小脑浦肯野细胞层内小胶质细胞的过度活化往往导致浦肯野细胞的损伤。在本研究中可以观察到酒精组小脑浦肯野细胞层中活化的小胶质细胞数目较对照组增加,并伴有浦肯野细胞的损伤和丢失,而RSV+酒精组中,白藜芦醇则可以抑制这一效应。这提示白藜芦醇可通过抑制新生小鼠酒精暴露引起的小脑小胶质细胞活化,来保护小脑浦肯野细胞免于酒精暴露引起的毒性损伤。NF-κB作为一种重要的核转录因子,参与脑内炎症反应与小胶质细胞的激活。本研究显示新生小鼠酒精暴露后增加了小脑NF-κB的表达;而白藜芦醇则抑制酒精暴露引起的小脑NF-κB的上调,进而参与抑制小脑小胶质细胞的活化。
此外,伯格曼胶质细胞在小脑的发育过程中发挥着重要作用。离体与在体的研究中均发现伯格曼胶质细胞纤维能够为小脑颗粒神经元的迁移提供支架[20-21]。当给予新生大鼠适量的酒精暴露后会导致其小脑伯格曼胶质细胞的损伤和丢失,进而导致颗粒神经元大量滞留在小脑的外颗粒细胞层[22]。近年来研究发现,小脑伯格曼胶质细胞纤维与浦肯野细胞树突能够紧密接触,进而为浦肯野细胞树突的发育提供结构上的支撑,促进浦肯野细胞树突生长发育,保证神经元之间的信号传导。本研究显示新生小鼠酒精暴露后,在减少小脑伯格曼胶质细胞纤维密度的同时,使小脑浦肯野细胞树突的生长受限;而白藜芦醇可以保护小脑伯格曼胶质细胞纤维免于酒精毒性损伤作用,能有效缓解酒精暴露引起的小脑浦肯野细胞树突生长的抑制作用。
综上所述,白藜芦醇对酒精暴露致小脑浦肯野细胞损伤的保护作用,一方面可能是抑制了浦肯野细胞层活化的小胶质细胞,另一方面可能通过对伯格曼胶质细胞的保护来维持浦肯野细胞的正常发育。新生期酒精暴露影响新生小鼠小脑发育的整个过程,包括细胞的增殖、迁移和突触形成[23-24]。本研究对酒精暴露引起新生小鼠小脑发育损伤的作用进行了探索,表明白藜芦醇对于酒精暴露致新生小鼠小脑发育损伤的保护作用,为白藜芦醇治疗酒精暴露导致的小脑发育障碍提供一定的理论依据,可能为酒精暴露致小脑发育损伤提供了一种新的治疗药物或者策略。
| [1] | Clarren S K, Smith D W. The fetal alcohol syndrome[J]. New Engl J Med,1978, 298 (19) : 1063 –1067. DOI:10.1056/NEJM197805112981906 |
| [2] | Wood C E. Maternal binge drinking and fetal neuronal damage[J]. Exp Physiol,2007, 92 (5) : 821 . DOI:10.1113/expphysiol.2007.038448 |
| [3] | Ungerer M, Knezovich J, Ramsay M. In utero alcohol exposure, epigenetic changes, and their consequences[J]. Alcohol Res,2013, 35 (1) : 37 –46. |
| [4] | Maier S E, West J R. Regional differences in cell loss associated with binge-like alcohol exposure during the first two trimesters equivalent in the rat[J]. Alcohol,2001, 23 (1) : 49 –57. DOI:10.1016/s0741-8329(00)00133-6 |
| [5] | Sakata-Haga H, Sawada K, Hisano S, et al. Abnormalities of cerebellar foliation in rats prenatally exposed to ethanol[J]. Acta Neuropathol,2001, 102 (1) : 36 –40. DOI:10.1007/s004010000345 |
| [6] | Nowoslawski L, Klocke B J, Roth K A. Molecular regulation of acute ethanol-induced neuron apoptosis[J]. J Neuropathol Exp Neurol,2005, 64 (6) : 490 –497. DOI:10.1093/jnen/64.6.490 |
| [7] | Olney J W, Young C, Wozniak D F, et al. Do pediatric drugs cause developing neurons to commit suicide?[J]. Trends Pharmacol Sci,2004, 25 (3) : 135 –139. DOI:10.1016/j.tips.2004.01.002 |
| [8] | Altman J, Bayer S A. Prenatal development of the cerebellar system in the rat. I. Cytogenesis and histogenesis of the deep nuclei and the cortex of the cerebellum[J]. J Comp Neurol,1978, 179 (1) : 23 –48. DOI:10.1002/cne.901790104 |
| [9] | Yang Y, Tang Y, Xing Y, et al. Activation of liver X receptor is protective against ethanol-induced developmental impairment of Bergmann glia and Purkinje neurons in the mouse cerebellum[J]. Mol Neurobiol,2014, 49 (1) : 176 –186. DOI:10.1007/s12035-013-8510-y |
| [10] | Xu L, Yang Y, Gao L, et al. Protective effects of resveratrol on the inhibition of hippocampal neurogenesis induced by ethanol during early postnatal life[J]. Biochim Biophys Acta,2015, 1852 (7) : 1298 –1310. DOI:10.1016/j.bbadis.2015.03.009 |
| [11] | Gehm B D, McAndrews J M, Chien P Y, et al. Resveratrol, a polyphenolic compound found in grapes and wine, is an agonist for the estrogen receptor[J]. Proc Natl Acad Sci U S A,1997, 94 (25) : 14138 –14143. DOI:10.1073/pnas.94.25.14138 |
| [12] | Sovak M. Grape extract, resveratrol, and its analogs: a review[J]. J Med Food,2001, 4 (2) : 93 –105. DOI:10.1089/109662001300341752 |
| [13] | Yousuf S, Atif F, Ahmad M, et al. Resveratrol exerts its neuroprotective effect by modulating mitochondrial dysfunctions and associated cell death during cerebral ischemia[J]. Brain Res,2009, 1250 : 242 –253. DOI:10.1016/j.brainres.2008.10.068 |
| [14] | Menard C, Bastianetto S, Quirion R. Neuroprotective effects of resveratrol and epigallocatechin gallate polyphenols are mediated by the activation of protein kinase C gamma[J]. Front Cell Neurosci,2013, 7 : 281 . DOI:10.3389/fncel.2013.00281 |
| [15] | Moriya J, Chen R, Yamakawa J, et al. Resveratrol improves hippocampal atrophy in chronic fatigue mice by enhancing neurogenesis and inhibiting apoptosis of granular cells[J]. Biol Pharm Bull,2011, 34 (3) : 354 –359. DOI:10.1248/bpb.34.354 |
| [16] | Dobbing J, Sands J. Comparative aspects of the brain growth spurt[J]. Early Hum Dev,1979, 3 (1) : 79 –83. DOI:10.1016/0378-3782(79)90022-7 |
| [17] | Ieraci A, Herrera D G. Single alcohol exposure in early life damages hippocampal stem/progenitor cells and reduces adult neurogenesis[J]. Neurobiol Dis,2007, 26 (3) : 597 –605. DOI:10.1016/j.nbd.2007.02.011 |
| [18] | Hamilton G F, Murawski N J, St Cyr S A, et al. Neonatal alcohol exposure disrupts hippocampal neurogenesis and contextual fear conditioning in adult rats[J]. Brain Res,2011, 1412 : 88 –101. DOI:10.1016/j.brainres.2011.07.027 |
| [19] | Chastain L G, Sarkar D K. Role of microglia in regulation of ethanol neurotoxic action[J]. Int Rev Neurobiol,2014, 118 : 81 –103. DOI:10.1016/B978-0-12-801284-0.00004-X |
| [20] | Rakic P. Neuron-glia relationship during granule cell migration in developing cerebellar cortex. A Golgi and electonmicroscopic study in Macacus rhesus[J]. J Comp Neurol,1971, 141 (3) : 283 –312. DOI:10.1002/cne.901410303 |
| [21] | Rakic P, Sidman R L. Organization of cerebellar cortex secondary to deficit of granule cells in weaver mutant mice[J]. J Comp Neurol,1973, 152 (2) : 133 –161. DOI:10.1002/cne.901520203 |
| [22] | Gonzalez-Burgos I, Alejandre-Gómez M. Cerebellar granule cell and Bergmann glial cell maturation in the rat is disrupted by pre-and post-natal exposure to moderate levels of ethanol[J]. Int J Dev Neurosci,2005, 23 (4) : 383 –388. DOI:10.1016/j.ijdevneu.2004.11.002 |
| [23] | Hatten M E. Central nervous system neuronal migration[J]. Ann Rev Neurosci,1999, 22 (1) : 511 –539. DOI:10.1146/annurev.neuro.22.1.511 |
| [24] | Xu H, Yang Y, Tang X, et al. Bergmann glia function in granule cell migration during cerebellum development[J]. Mol Neurobiol,2013, 47 (2) : 833 –844. DOI:10.1007/s12035-013-8405-y |



