T细胞免疫球蛋白黏蛋白(T-cell immunoglobulin and mucin-domain-containing molecule,TIM)基因家族是2001年在哮喘研究中发现的一个新基因家族[1],此后其在免疫调节和免疫相关性疾病的研究领域备受关注[2-3]。TIM基因家族在小鼠由TIM-1~4和4个假想蛋白TIM-5~8组成,在人类由TIM-1、3、4组成,两者氨基酸序列具有高度同源性。在TIM家族成员中,不同于其他TIM分子,TIM-4选择性表达于抗原提呈细胞(antigen presenting cell,APC)表面,这种表达的局限性提示TIM-4可能在APC功能的发挥中起着重要作用[2, 4]。有研究发现,阻断树突状细胞(dendritic cells,DCs)TIM-4信号通路,能够抑制CD4+T细胞向Th2细胞的分化,诱导iTreg细胞的产生,从而延长小鼠皮肤移植生存率[5]。人体内大部分免疫性疾病都涉及Th1/Th2/Treg细胞数量和功能上的失衡。Kupffer细胞(Kupffer cells,KCs)作为体内最大的抗原提呈细胞群,在调节肝脏免疫环境中发挥重要作用[6]。因此,本研究通过阻断肝移植术后小鼠KCs TIM-4表达,观察诱导iTreg细胞的产生以及探讨其可能机制,从而阐明对肝移植术后免疫耐受形成的影响。
1 材料与方法 1.1 实验动物和主要试剂实验动物:供体为健康雄性C57BL/6小鼠,受体为健康雄性C3H小鼠,鼠龄8~10周,体质量16~22 g,各58只(均购自重庆医科大学实验动物中心),饲养于重庆医科大学实验动物中心SPF实验室。术前8~12 h禁食。所有操作遵守重庆医科大学伦理委员会发布的伦理及管理指南。主要试剂:Ⅳ型胶原酶购自美国Sigma公司;TIM-4 mAb(RMT4-53,Cat:GTX14149)购自美国GeneTex公司;CellTraceTM CFSE 细胞增殖试剂盒购自美国Invitrogen公司;CD4+ T细胞分选试剂盒和CD25-MicroBeads细胞磁珠购自德国Miltenyi公司;流式抗体CD14-PE(Sa2-8,Cat:12-0141)、CD163-APC(GHI/61,Cat: 17-1639-42)、Foxp3-PE(150D/E4,Cat:12-4774)、CD25-FITC(CD25-4E3,Cat: 11-0257)购自美国eBioscience公司;STAT6单克隆抗体(Cat: ab28829)购自美国Abcam公司;ELISA试剂盒购自美国Active motif 公司;总蛋白提取试剂购自上海碧云天生物技术有限公司。
1.2 小鼠原位肝移植模型的建立和分组采用改良的Kamada“二袖套管”法建立C57BL/6→C3H小鼠配对组合的原位肝移植(ROLT)急性排斥反应模型。实验动物采用随机数字表法分为3组:①sham组,小鼠开腹手术暴露门静脉,并经门静脉注入1 mL PBS;②control mAb组,于供体冷血期经门静脉注入含TIM-4同型对照抗体(0.35 mg/只)是1 mL PBS;③TIM-4 mAb组,于供体冷血期经门静脉注入含抗TIM-4抗体(0.35 mg/只)的1 mL PBS。各组均于术后3 d经尾静脉再次分别注入上述液体。小鼠在移植后7 d处死,取下中叶肝组织备检、液氮保存。余部分固定包埋。
用预先TIM-4+ mAb处理的TIM-4+ KCs与初始TIM-4+T细胞共培养所诱导的iTreg细胞处理动模型时,实验动物分为3组:iTreg组于供体冷血期经门静脉注入1×106个/mL iTreg细胞,sham组(假手术组)和单纯肝移植组(LT)注入相应的PBS作为对照。小鼠在移植后7 d处死。检测各组AST、ALT、TBIL水平,HE染色评价肝组织排斥活动指数(rejective activity index,RAI),观察小鼠生存率。
1.3 细胞分离与纯化取移植术后7 d受体小鼠肝脏,参照Dai等[7]介绍的胶原酶肝脏原位灌注法分离Kupffer细胞,用含10%胎牛血清(FCS)的RPMI1640完全培养液种植于培养板中,5%CO2,37 ℃恒温培养箱培养2 h后,更换培养液,洗去未贴壁细胞,重悬贴壁细胞,将细胞浓度调整至1×106个/mL。采用流式分选技术,分选出TIM-4+ KCs和TIM-4- KCs备用。
提取受体小鼠脾脏单细胞悬液,根据CD4+T细胞分离试剂盒说明分离初始CD4+T细胞,进一步运用CD25-磁珠分离法,分离出初始CD4+CD25- T细胞(纯度>90%)。
1.4 激光共聚焦检测KCs TIM-4表达将提取的各组贴壁KCs进行细胞爬片,将爬片的细胞用4%多聚甲醛固定10 min,PBS洗3次,爬片置于1%BSA、10%山羊血清和含0.3 mol/L甘氨酸的0.1%PBS-TWEEN的混合封闭液封闭1 h,PBS洗3次,加入一抗TIM-4工作液(1:200),4 ℃孵育过夜。PBS溶液洗3次×3 min,将细胞爬片置人TRITC标记的二抗工作液(1:200),4 ℃避光孵育30 min。PBS溶液洗3次×3 min。然后封片,封片剂为含有4',6-二脒基-2-苯基吲哚(DAPI)的抗荧光淬灭的封片剂。激光共聚焦显微镜下观察各组TIM-4表达情况。
1.5 TUNEL检测肝细胞凋亡TUNEL染色切片脱蜡至水→蛋白酶K消化15 min,4%多聚甲醛固定10 min→3% H2O2,室温封闭10 min→ 0.1% Triton X-100冰浴2 min,每片加50 μL TUNEL混合液,37 ℃ 1 h,PBS洗3次→每片加50 μL POD,37 ℃ 30 min,PBS洗3次→DAB显色,水性封片剂液体封闭。结果判定:每个样本观察1张切片,每张切片分析5个视野,每个视野计数100个细胞核,计算凋亡细胞百分比的均数,即为凋亡指数(apoptotic index,AI)。凋亡的细胞多表现为细胞皱缩、染色质浓集,细胞核呈棕褐色着色。
1.6 CD4+T细胞增殖检测提取受体脾脏CD4+T细胞,将浓度为5 μmol/L CFSE的二甲亚砜溶液加入细胞悬液中,37 ℃孵育20 min 后,按1:1的比例与KCs进行共培养(加或不加0.5 mg/L TIM-4抗体)96 h。用PBS终止反应,洗涤2次后重悬于10% FCS的RPMI1640培养液中培养72 h,用FITC标记的抗小鼠CD4 mAb染色,4 ℃孵育30 min后,用2.5% FCS的PBS洗涤3次。PBS重悬细胞流式细胞仪检测。
1.7 细胞因子测定根据ELISA检测试剂盒说明书检测KCs与CD4+T细胞共培养上清液白介素4(IL-4)、白介素6(IL-6)、白介素13(IL-13)表达水平。每组实验重复3次。
1.8 流式细胞仪检测分别向细胞悬液中加入荧光素标价的抗体(PE-CD14、FITC-CD163/PE-Foxp3、FITC-CD25),室温避光孵育30 min,再加入2 mL 含0.09% 叠氮化钠的PBS,振荡混匀后1 000 r /min,离心5 min,弃上清,PBS重悬细胞上流式细胞仪检测。
1.9 Western blot检测按照总蛋白提取试剂盒说明提取各组总蛋白,并进行蛋白浓度测定,蛋白变性后,40 μg加入上样孔进行电泳分离,电转至PVDF膜,5%脱脂奶粉4 ℃下封闭1.5 h,TBST冲洗3次×10 min,一抗4 ℃过夜孵育,TBST冲洗3次×10 min,二抗37 ℃孵育1 h,TBST冲洗3次×10 min,加ECL发光液,X线曝光、显影、定影,然后用UVP凝胶图像处理系统软件分析目的条带的灰度值。
1.10 肝组织病理观察取移植肝组织放入10%中性甲醛中固定→常规脱水→二甲苯透明→石蜡包埋→3 μm厚切片→脱蜡、脱水→HE染色,光学显微镜观察肝组织病变情况;根据Banff方案制定的急性排斥反应标准进行RAI评分。
1.11 统计学分析采用SPSS 18.0统计软件,计量资料数据以x±s表示,多组间均数比较经方差齐性检验后用方差分析,组间均数比较采用t检验,生存资料分析用Log-Rank方法,P<0.05为差异有统计学意义。
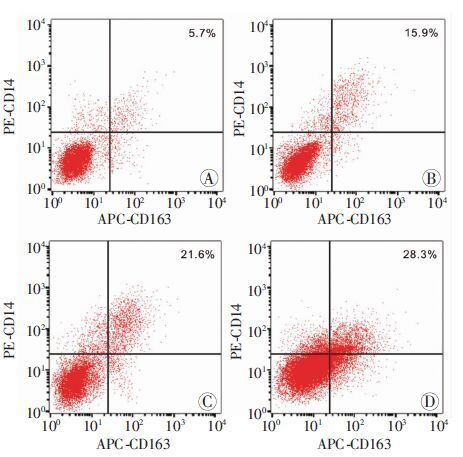
2 结果 2.1 肝移植术后Kupffer细胞活化数以及TIM-4表达变化为了探讨肝移植术后KCs活化情况,分别于移植术后24、48、72 h处死受体,流式细胞仪检测各时间点肝组织KCs细胞活化数发现,与sham组5.7%相比,肝移植后KCs的活化随着时间逐渐增加,于24、48、72 h分别为15.9%、21.6%、28.3%(图 1)。提取肝脏KCs,Western blot及PCR检测结果显示,随着时间的变化,KCs表达TIM-4逐渐增加,3 d达高峰,之后处于一个较高的水平。1、3、7 d TIM-4蛋白相对表达水平分别为(0.31±0.04)、(0.86±0.05)、(0.77±0.03),明显高于sham组[(0.11±0.03),P<0.05,图 2]。
|
| A:sham组;B~D:分别为肝移植术后24、48、72 h 图 1 流式细胞仪检测肝移植术后肝脏Kupffer细胞活化 |

|
| 图 2 移植术后肝脏Kupffer细胞TIM-4蛋白表达 |
2.2 各组KCs TIM-4表达比较
提取各组肝脏KCs,激光共聚焦检测KCs TIM-4表达情况发现,TIM-4 mAb组TIM-4荧光表达强度明显低于control mAb组(P<0.05),提示阻断KCs TIM-4成功(图 3)。

|
| TIM-4:红色荧光(膜处);DAPI:蓝色荧光(核处);Merge:叠加 图 3 术后7 d各组Kupffer细胞TIM-4荧光表达 (×800) |
2.3 各组术后7 d 肝脏凋亡指数
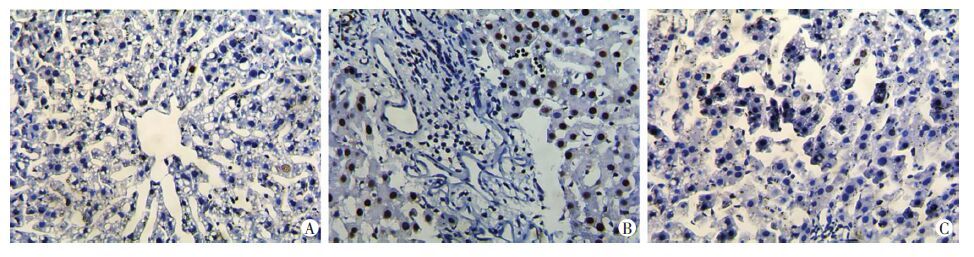
TUNEL染色观察各组术后7 d肝脏凋亡情况见图 4。显微镜下,凋亡的细胞多表现为细胞皱缩、染色质浓集,细胞核呈棕褐色着色。sham组AI为(0.40±0.49),control mAb组为(29.23±2.56),TIM-4 mAb组为(11.04±2.28),control mAb组AI值明显高于sham组(P<0.05),而TIM-4 mAb组AI值明显低于TIM-4 mAb组(P<0.05),提示阻断KCs TIM-4具有保护肝细胞作用。
|
| A:sham组;B:control mAb组;C:TIM-4 mAb组 图 4 TUNEL染色观察各组术后7 d肝细胞凋亡 (×400) |
2.4 阻断KCs TIM-4对Th2细胞的分化以及iTreg细胞的影响
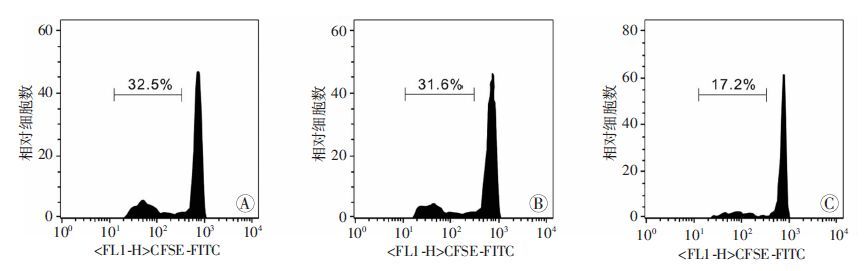
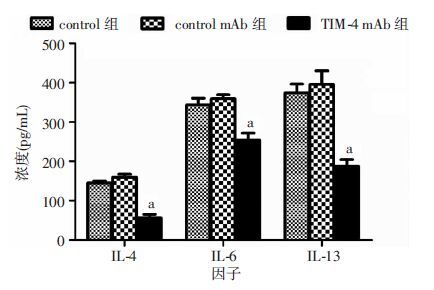
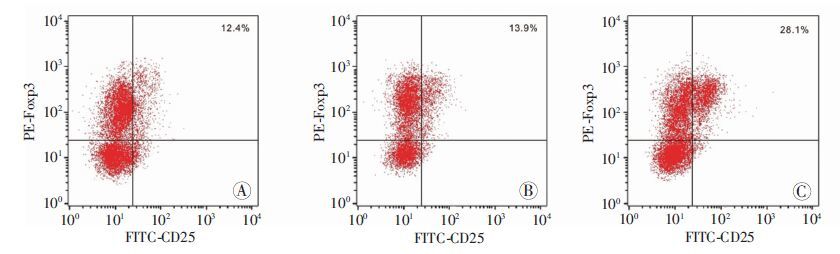
将提取的KCs(预先加或不加0.5 mg/L TIM-4 mAb处理)与CD4+T细胞按比例1:1进行共培养发现,control组、control mAb组以及TIM-4 mAb组CD4+T细胞的增殖率分别为32.5%、31.6%、17.2%(图 5)。这说明阻断TIM-4可明显抑制初始CD4+T细胞的增殖。流式分选出TIM-4+ KCs,培养24 h(预先加或不加0.5 mg/L TIM-4 mAb处理),再与CD4+T细胞共培养48 h,ELISA检测各组上清IL-4、IL-6、IL-13分泌水平,流式细胞仪检测各组CD4+CD25+Foxp3+T细胞产 生情况。结果显示,阻断TIM-4+ KCs TIM-4可明显减少上述炎症因子的分泌(P<0.05,图 6);control组、control mAb组以及TIM-4 mAb组CD25、Foxp3双阳性细胞分别为(12.8±0.3)%、(13.3±0.5)%、(28.1±0.4)%,后者与前两组比较差异有统计学意义(P<0.05)。阻断TIM-4+ KCs TIM-4可促进CD4+CD25+Foxp3+T细胞的产生(图 7)。表明KCs TIM-4在Th2细胞的极化以及iTreg细胞的分化中发挥重要作用。
|
| A:control组;B:control mAb组; C:TIM-4 mAb组 图 5 各组CD4+T细胞增殖比较 |
|
| a: P<0.05,与control组、control mAb组比较 图 6 ELISA检测各组Th2极化因子表达 |
|
| A:control组; B: control mAb组; C:TIM-4 mAb组 图 7 流式细胞仪检测各组诱导CD4+CD25+Foxp3+T细胞的产生 |
2.5 阻断KCs TIM-4通过抑制IL-4/STAT6信号通路促进iTreg细胞增多
通过流式分选出TIM-4+ KCs和TIM-4- KCs,并与初始CD4+T细胞共培养,通过Western blot分析T细胞p-STAT6蛋白表达情况。结果显示TIM-4+组T细胞p-STAT6相对蛋白表达水平(1.75±0.06)明显高于TIM-4-组[(0.60±0.06),P<0.05]。然而TIM-4+ KCs与CD4+T细胞共培养时,加入或未加入TIM-4mAb的p-STAT6蛋白表达分别为2.29±0.25、1.30±0.11,两者比较差异有统计学意义(P<0.05),此现象在TIM-4-组间比较差异无统计学意义(P>0.05)。另外,向培养液中加入IL-4(0.25 mg/L)发现,阻断KCs TIM-4的表达,外源性加入IL-4可明显增高CD4+T细胞p-STAT6蛋白的表达(P<0.05,图 8)。

|
| A:各组T细胞p-STAT6蛋白表达;B:加或者不加0.5 mg/L TIM-4 mAb处理,各组T细胞p-STAT6蛋白表达;C:加或者不加0.25 mg/L IL-4处理,各组T细胞p-STAT6蛋白表达 图 8 各组T细胞IL-4/STAT6信号通路分析 |
2.6 阻断TIM-4+KCs TIM-4功能诱导的iTreg细胞可改善排斥反应以及提高小鼠生存率
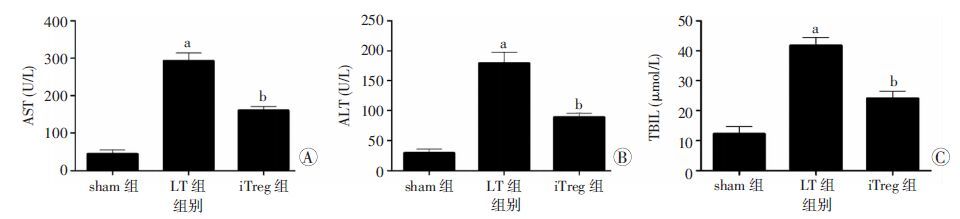
TIM-4+ KCs(预先用TIM-4 mAb处理)与初始CD4+T细胞进行共培养,48 h后获取CD4+CD25+Foxp3+Treg细胞,调整iTreg细胞浓度1×106个/mL,将所得细胞于供体冷血期经门静脉注入iTreg组,sham 组以及LT组注入相应的PBS作为对照,术后7 d检测各组肝功能,结果显示:单纯LT组肝功指标明显高于sham组,差异具有统计学意义(P<0.05),而iTregz组肝功指标明显好转,与LT组比较差异具有统计学意义(P<0.05,图 9)。肝组织病理学检查,iTreg组RAI平均得分为(3.97±0.67),明显低于LT组[(8.47±0.90),P<0.05,图 10]。且iTreg组小鼠平均存活时间(55.7±5.5)d明显长于LT组平均存活时间(14.5±3.7)d(P<0.05,图 11)。
|
| A: AST; B: ALT; C:TBIL a: P<0.05,与sham组比较;b: P<0.05,与LT组比较 图 9 术后7 d各组血清肝功指标比较 |

|
| A:sham组;B:LT组;C:iTreg组 图 10 HE染色观察术后7 d各组肝脏病理组织学变化 (×400) |

|
| 图 11 术后各组小鼠生存曲线 |
3 讨论
肝移植是治疗终末期肝病的有效方法。目前器官移植都可能发生急性排斥反应,而免疫抑制剂的使用,基本能够控制急性排斥反应。但如果不及时治疗急性排斥反应,仍会威胁到患者的生命。同种异体肝脏移植主要组织相容性复合物不同,可诱发以淋巴细胞浸润为主的免疫排斥反应。T辅助淋巴细胞在不同类型刺激因子下可转化为Th1、Th2、Th17以及Treg等亚群。Th1/Th2和Th17/Treg细胞的功能正常和相互平衡,是维持正常免疫功能的基础。Th1细胞主要分泌IL-2、IFN-γ,Th17细胞主要分泌IL-17、IL-23等细胞因子。Th1细胞主要通过增加移植物血管粘附性等方式促进炎症细胞的聚集,进而增强Th17细胞对移植物的持续性破坏,促进急性排斥反应的发生和发展。Th2细胞主要分泌IL-4、IL-6、IL-13等,而Treg细胞主要分泌IL-10、TGF-β,通过抑制毒性T细胞反应来诱导并维持自体和异体抗原的免疫耐受[8-9]。CD4+ CD25+ Foxp3+ Treg细胞高表达CTLA-4,与效应T细胞上的CD80/CD86结合后,将抑制信号传递给效应T细胞,从而影响其功能。同时CD4+ CD25+ Foxp3+ Treg细胞与靶细胞接触后释放穿孔素或颗粒酶,导致靶细胞凋亡。Foxp3是Treg细胞的唯一标志,在Treg细胞的产生和获能过程中起重要作用[10-11]。
肝脏作为“免疫特惠”器官的重要原因是存在树突状细胞、肝星状细胞、窦内皮细胞和Kupffer细胞等特异性免疫细胞。KCs是定居于肝血窦内的巨噬细胞,占全身单核-巨噬细胞的80%以上,是机体最大的抗原递呈细胞群,是肝脏具有致耐受免疫原性的重要组成,因此其功能状态在Th1/Th17以及Th2/Treg平衡偏移上由着至关重要的调节作用[12]。TIM作为一种新型免疫分子,在Th细胞的激活和分化上发挥着重要的作用。在TIM家族成员中,TIM-1和TIM-2主要表达于活化的Th2细胞,TIM-3主要表达于活化的Th1及Th17细胞。TIM-4 是TIM-1 的天然配体,TIM-4/TIM-1 的相互作用能够激活CD4+T细胞,从而促进T细胞的增殖和效应T细胞的分化,然而TIM-4对于T细胞的激活具有双面效应,当它与初始CD4+T细胞结合时,却能够抑制后者的激活[13]。同时TIM-4还能够与凋亡细胞表面分子磷脂酰丝氨酸(phosphatidy-lserine,PS)结合,介导凋亡的抗原特异性T细胞及时有效清除,促进巨噬细胞免疫抑制因子的分泌和(或)Treg的产生,从而发挥免疫调控效应[14]。有研究发现,TIM-4在关节炎患者中表达会增高,而阻断TIM-4 表达可有效地减少促症因子的释放、破骨细胞的分化和骨吸收[15]。此外,减少DC细胞TIM-4的表达,可以减少TIM-4/TIM-1相互作用,从而减少CD4+T细胞向Th2细胞的分化[16]。Th2细胞的激活能够分泌大量的炎症因子IL-4,有证据显示,IL-4可抑制CD4+T细胞Foxp3的产生,从而抑制CD4+T细胞向Treg细胞的分化[17]。因此,我们推测阻断KCs TIM-4的表达,可减少CD4+T细胞向Th2细胞的分化,从而诱导CD4+CD25+Foxp3+Treg细胞的增多,导致肝脏免疫耐受的形成。
本实验通过建立小鼠急性排斥反应模型发现,TIM-4的表达会随着时间逐渐升高,且3 d达到高峰期,门静脉注射TIM-4 mAb阻断肝脏KCs TIM-4能有效减少肝细胞的凋亡,起到保护肝脏作用。本研究将TIM-4-/+ KCs与初始CD4+T细胞共培养,结果显示,TIM-4- KCs可有效减少CD4+T细胞的增殖,并且同样减少了CD4+T细胞GATA-3(Th2细胞生成重要转录因子)的表达和Th2细胞因子(IL-4、IL-6、IL-13)的产生,从而诱导CD4+CD25+Foxp3+Treg细胞的生成。IL-4被认为是Treg细胞生成的抑制因子,在初始T细胞向Th2细胞分化中,Th2细胞因子IL-4与其受体结合,首先激活转录因子STAT6,随后激活GATA-3,使初使T细胞分化为Th2细胞。GATA-3能抑制Foxp3的诱导,从而减少Treg细胞分化,反过来TGF-β能促进Foxp3转录,Foxp3也能结合GATA-3,阻止Th2基因的表达。STAT6/GATA-3和Foxp3的相对含量决定了CD4+T细胞向Th2/Treg细胞分化命运[18-19]。因此,我们通过阻断KCs TIM-4可抑制初始CD4+T细胞IL-4/STAT6信号通路的激活,从而诱导更多CD4+CD25+Foxp3+Treg细胞的生成,致使宿主对移植物产生免疫耐受,延长了小鼠的生存时间,TIM-4有望在肝移植排斥反应的治疗中发挥潜在作用。目前,TIM-4对Treg细胞的调节过程及机制尚需进一步行临床研究。
| [1] | McIntire J J, Umetsu S E, Akbari O, et al. Identification of Tapr (an airway hyperreactivity regulatory locus) and the linked Tim gene family[J]. Nat Immunol,2001, 2 (12) : 1109 –1116. DOI:10.1038/ni739 |
| [2] | Li Z, Ju Z, Frieri M. The T-cellimmunoglobulin and mucin domain (Tim) gene family in asthma[J]. Allergy Asthma Proc,2013, 34 (1) : e21 –26. DOI:10.2500/aap.2013.34.3646 |
| [3] | Fang X Y, Xu W D, Pan H F, et al. Novel insights into Tim-4 function in autoimmune diseases[J]. Autoimmunity,2015, 48 (4) : 189 –195. DOI:10.3109/08916934.2014.983266 |
| [4] | Meyers J H, Sabatos C A, Chakravarti S, et al. The TIM gene family regulates innate and adaptive immunity[J]. Trends Mol Med,2005, 11 (8) : 362 –269. DOI:10.1016/j.molmed.2005.06.008 |
| [5] | Zhao C Q, Li T L, He S H, et al. Specific immunotherapy suppresses Th2 responses via modulating TIM1/TIM4 interaction on dendritic cells[J]. Allergy,2010, 65 (8) : 986 –995. DOI:10.1111/j.1398-9995.2009.02295.x |
| [6] | Chen G S, Qi H Z. Effect of Kupffer cells on immune tolerance in liver transplantation[J]. Asian Pac J Trop Med,2012, 5 (12) : 970 –972. DOI:10.1016/S1995-7645(12)60184-9 |
| [7] | Dai L L, Gong J P, Zuo G Q, et al. Synthesis of endotoxin receptor CD14 protein in Kupffer cells and its role in alcohol-induced liver disease[J]. World J Gastroenterol,2003, 9 (3) : 622 –626. DOI:10.3748/wjg.v9.i3.622 |
| [8] | Thomson A W, Knolle P A. Antigen-presenting cell function in the tolerogenic liver environment[J]. Nat Rev Immunol,2010, 10 (11) : 753 –766. DOI:10.1038/nri2858 |
| [9] | Toscano M A, Bianco G A, Ilarregui J M, et al. Differential glycosylation of TH1, TH2 and TH-17 effector cells selectively regulates susceptibility to cell death[J]. Nat Immunol,2010, 8 (8) : 825 –834. |
| [10] | Biswas M, Terhorst C, Herzog R W. Treg: tolerance vs immunity[J]. Oncotarget,2015, 6 (24) : 19956 –19957. DOI:10.18632/oncotarget |
| [11] | Hou X, Song J, Su J, et al. CD4+Foxp3+ Tregs protect against innate immune cell-mediated fulminant hepatitis in mice[J]. Mol Immunol,2015, 63 (2) : 420 –427. DOI:10.1016/j.molimm.2014.09.015 |
| [12] | Knechtle S J, Kwun J. Unique aspects of rejection and tolerance in liver transplantation[J]. Semin Liver Dis,2009, 29 (1) : 91 –101. DOI:10.1055/s-0029-1192058 |
| [13] | Rong S, Park J K, Kirsch T, et al. The TIM-1:TIM-4 pathway enhances renal ischemia-reperfusion injury[J]. J Am Soc Nephrol,2011, 22 (3) : 484 –495. DOI:10.1681/ASN.2010030321 |
| [14] | Tietjen G T, Gong Z, Chen C H, et al. Molecular mechanism for differential recognition of membrane phosphatidylserine by the immune regulatory receptor Tim4[J]. Proc Natl Acad Sci U S A,2014, 111 (15) . DOI:10.1073/pnas.1320174111 |
| [15] | Abe Y, Kamachi F, Kawamoto T, et al. TIM-4 has dual function in the induction and effector phases of murine arthritis[J]. J Immunol,2013, 191 (9) : 4562 –4572. DOI:10.4049/jimmunol.1203035 |
| [16] | Zhao C Q, Li T L, He S H, et al. Specific immunotherapy suppresses Th2 responses via modulating TIM1/TIM4 interaction on dendritic cells[J]. Allergy,2010, 65 (8) : 986 –995. DOI:10.1111/j.1398-9995.2009.02295.x |
| [17] | Yeung M Y, McGrath M M, Nakayama M, et al. Interruption of Dendritic Cell-Mediated TIM-4 Signaling Induces Regulatory T Cells and Promotes Skin Allograft Survival[J]. J Immunol,2013, 191 (8) : 4447 –4455. DOI:10.4049/jimmunol.1300992 |
| [18] | Chapoval S, Dasgupta P, Dorsey N J, et al. Regulation of the T helper cell type 2 (Th2)/T regulatory cell (Treg) balance by IL-4 and STAT6[J]. J Leukoc Biol,2010, 87 (6) : 1011 –1018. DOI:10.1189/jlb.1209772 |
| [19] | Mantel P Y, Kuipers H, Boyman O, et al. GATA3-driven Th2 responses inhibit TGF-β1-induced FOXP3 expression and the formation of regulatory T cells[J]. PLoS Biol,2007, 5 (12) . |



