在我国,随着饮食因素和环境因素的改变,近10年来结直肠癌的发病率明显上升[1],日益威胁着人们的心身健康。有研究证实基因突变是结直肠癌发病的主要机制,其与结直肠癌的治疗与预后关系密切,故寻找结直肠癌新的分子靶点,提高肿瘤的治疗和诊断效率是目前的研究重点[2]。SOX基因家族是一类最初参与胚胎发育及性别决定的转录因子,其家族成员均包含一个能促进DNA结合的保守基序HMG box(high-mobility group box domain),可以和(A/T)(A/T)CAA(A/T)G序列进行特异性结合,并可依赖氨基酸序列和特异性结合伴侣扮演着转录激动子或抑制子的功能[3]。SOX基因根据HMG基序内的相似性分为A~J 10个亚族,其不仅广泛参与到细胞分化、性别决定、中枢神经系统及造血系统等发育过程中,且近年来有研究发现,SOX多个亚族成员还在许多肿瘤的发生、发展中扮演着不同的角色,例如SOX B族中SOX2、SOX3在乳腺癌、肺癌、食管鳞状细胞癌中是致癌基因[4-6],而分别属于SOX C、F族中的SOX6和SOX17却在食管鳞状细胞癌和胃癌中分别发挥着肿瘤抑制子的功能[7-8]。不同于其他亚族至少包括3个以上的相关因子,在SOX G族中SOX15基因是唯一的成员,位于17p13.1,全长1 991 bp,其在大脑、脊髓多种组合中广泛表达,并在肌源性细胞系中优先表达,参与骨骼肌的发育与重建[9-10]。近期有研究显示,SOX15在诸如胰腺癌、睾丸胚胎细胞癌、食管癌等肿瘤组织中表达异常[11-13],与肿瘤的发生、发展、转移密切相关,但目前SOX15对结肠癌细胞生物学功能的调控作用尚不清楚。因此,本实验将通过构建SOX15重组质粒,检测其在转染结肠癌细胞前后的表达变化以及对结肠癌细胞增殖、凋亡、迁移侵袭的影响。
1 材料与方法 1.1 主要试剂Caco2、SW480、HCT116、HT29人结肠癌细胞株购自重庆市分子肿瘤及表观遗传学重点实验室,结肠癌正常新鲜组织取自重庆医科大学附属第一医院。胎牛血清购自杭州四季青生物有限技术公司,RPMI1640培养基购自HyClone公司,逆转录及PCR试剂盒购自Promega公司,SOX15基因引物由南京金斯瑞生物科技有限公司合成。LipofectamineTM2000购自Invitrogen公司,兔抗人SOX15多克隆抗体购自美国Abcam公司,鼠抗β-actin单克隆抗体购自CST公司。HRP标记的抗兔和抗鼠IgG二抗、Annexin V-FITC/PI凋亡检测试剂盒均购自碧云天生物公司。无内毒素质粒提取试剂盒购自Omega公司,质粒pEGFP-N1-SOX15和pEGFP-N1由上海吉凯生物公司合成,G418购自Amersco公司,CCK-8试剂盒购自同仁试剂公司,Transwell小室购自Corning公司,Matrigel基质胶购自BD公司。
1.2 方法 1.2.1 细胞培养Caco2、SW480、HCT116、HT29人结肠癌细胞用含10%胎牛血清的RPMI1640培养基,在50 mL/L CO2、37 ℃孵箱内培养。隔天换液,待细胞融合度达80%时即可进行消化传代。
1.2.2 正常结肠组织于结肠癌患者手术中取4例距离肿瘤组织至少5 cm以外的组织为正常结肠组织,保存于液氮罐中备用。
1.2.3 RT-PCR检测SOX15在结肠癌细胞及正常结肠组织中的mRNA表达应用TRIzol试剂盒提取各细胞及组织总RNA。随后使用Promega逆转录试剂盒将提取的总RNA逆转录成cDNA。SOX15基因上游引物5′-CAAGATGCACAACTCCGAGA-3′,下游引物5′-GGAGCCTAGGGTCACTCT GA-3′,其目的片段大小为264 bp;β-actin 上游引物为5′-CTCCATCCTGGCCTCGCTGT-3′,下游引物为5′-GCTGTCACCTTCACCGTTCC-3′,片段大小为268 bp。扩增的PCR产物进行2%琼脂糖凝胶电泳,应用凝胶成像仪成像并保存结果。
1.2.4 细胞转染及筛选将结肠癌细胞Caco2接种于6孔板中,分为pEGFP-N1-SOX15转染组及pEGFP-N1空质粒组,在细胞融合度达70%时应用脂质体LipofectamineTM2000分别将空质粒和重组质粒转染入细胞。首先将4 μg DNA及5 μL脂质体LipofectamineTM 2000分别溶于500 μL无血清培养基中,混匀室温静置5 min,再将两管溶液混合,室温放置20 min,转染期间,用无血清培养基洗涤6孔板细胞2次后每孔各加入1 mL质粒脂质体混合液,并用无血清培养基补足至2 mL,于孵箱培养4~6 h后更换为含10%胎牛血清培养液。细胞转染后48 h采用300 μg/mL G418(加药前已筛选出最低死亡浓度)进行筛选,每3天换液加药1次,筛选2周左右,细胞单克隆即可形成。
1.2.5 RT-PCR及Western blot检测细胞转染后表达变化细胞转染48 h后可分别提取6孔板中转染质粒及空质粒组细胞总RNA。利用RT-PCR检测转染后SOX15 mRNA表达变化。Western blot检测转染细胞蛋白表达的方法如下:首先将待处理的细胞和预先配制好的细胞裂解液于冰上充分混匀裂解后提取总蛋白;BCA蛋白检测试剂盒测定蛋白浓度后,加入1/4总体积5×Buffer SDS上样缓冲液,100 ℃水浴10 min;每孔取40 g/L蛋白上样量进行SDS-PAGE凝胶电泳;后将蛋白电转至0.2 μm聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上;用含50 g /L 脱脂奶粉室温封闭2 h;分别加入兔抗人SOX15(1:1 000)、鼠抗人β-actin(1:1 000),4 ℃孵育过夜;TBST洗膜3次,室温孵育二抗(1:3 000) 约2 h,TBST同样洗膜3次后用ECL发光液显影。
1.2.6 CCK-8检测Caco2细胞增殖将细胞分为pEGFP-N1-SOX15转染组、pEGFP-N1空质粒组、空白对照组,每组设5个复孔,分别将转染后和空白对照组中处于对数生长期Caco2细胞,接种于96 孔板,每孔约5×103 个细胞,于种板后0、24、48、72 h分别在每孔中加入10 μL CCK-8,置于孵箱中培养2 h;酶标仪读取450 nm 波长处光密度值[D(450)]。
1.2.7 克隆形成实验检测Caco2细胞克隆形成率分别取pEGFP-N1-SOX15转染组、pEGFP-N1空质粒组稳定转染细胞,按500个/孔接种于6孔板中,每组3孔。因以Caco2细胞最低死亡浓度进行克隆形成,培养2周左右,空白对照组细胞已全部死亡,pEGFP-N1-SOX15转染组、pEGFP-N1空质粒组中待克隆长至肉眼可见的50个细胞左右,即可终止培养。首先用PBS浸洗2次,即用4%多聚甲醛室温固定15 min;固定完毕后用0.1%结晶紫染色10~30 min,再用PBS洗去染色液,干燥后拍照计数。
1.2.8 Transwell实验检测Caco2细胞迁移、侵袭能力 1.2.8.1 迁移实验将细胞分为pEGFP-N1-SOX15转染组和pEGFP-N1空质粒组、空白对照组;将8 μm 孔径大小的Transwell小室放入24 孔板中;将转染48 h 后的3组细胞消化离心后,用不含胎牛血清的RPMI1640培养基重悬,调整细胞密度至5×104/mL;小室上室加入200 μL细胞悬液,下室加入700 μL含10%胎牛血清的RPMI1640培养基,孵箱培养42 h 后取出小室;PBS 洗涤2遍后用棉签小心擦去上室细胞,后用4%多聚甲醛固定15 min,自然风干后用结晶紫染色20 min,PBS 洗涤2 遍小室,干燥后置于显微镜下观察计数穿膜细胞。
1.2.8.2 侵袭实验不含胎牛血清的RPMI1640培养基与Matrigel基质胶以8:1比例混合,每个小室上室各加入100 μL混合液,放入孵箱内2~3 h,使其凝固。余下步骤同迁移实验。
1.2.9 流式细胞仪检测Caco2细胞凋亡将细胞分为pEGFP-N1-SOX15转染组、pEGFP-N1 空质粒组及空白对照组后,用预冷的PBS清洗细胞,用不含EDTA 的胰酶消化细胞,各组离心后收集5×106个细胞。加入500 μL Binding Buffer悬浮细胞,加入5 μL FITC标记的Annexin-V(20 μg/mL)混匀,加入5 μL Propidium Iodide混匀;室温避光5~15 min,即进行流式细胞仪检测。
1.3 统计学分析计量资料以x±s表示,采用SPSS 18.0统计软件进行单因素方差分析,两组间均数比较采用t检验。P<0.05表示差异有统计学意义。
2 结果 2.1 SOX15在结肠癌细胞及正常结肠组织中的表达以正常结肠组织为对照组,RT-PCR及Western blot检测结果显示,相较于对照组,SOX15 mRNA及蛋白的表达明显下调,且差异有统计学意义(P<0.01,图 1)。
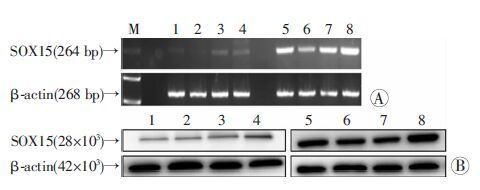
|
| M:标准; 1:Caco2结肠癌细胞; 2: SW480结肠癌细胞; 3:HCT116 结肠癌细胞; 4:HT29结肠癌细胞; 5~8:正常结肠组织;A: RT-PCR检测结果;B: Western blot检测结果 图 1 结肠癌细胞及正常结肠组织中SOX15 mRNA及蛋白表达 |
2.2 SOX15转染Caco2细胞后其mRNA及蛋白的表达
Caco2结肠癌细胞生长稳定性强,且SOX15基因转染成功率明显高于SW480、HCT116、HT29结肠癌细胞株,故将其作为SOX15稳定转染的细胞株。将Caco2 细胞转染后培养48 h 后分别提取pEGFP-N1-SOX15转染组及pEGFP-N1对照组、空白对照组Caco2细胞总RNA和总蛋白进行RT-PCR和Western blot检测。结果显示在Caco2细胞中,相比空白对照组[(0.51±0.03)、(0.14±0.02)]及pEGFP-N1对照组[(0.54±0.06)、(0.19±0.03)],pEGFP-N1-SOX15转染组[(1.23±0.10)、(1.13±0.08)]SOX15基因的mRNA及蛋白表达水平明显上调,且差异有统计学意义(P<0.01);空白对照组和pEGFP-N1对照组差异无统计学意义(P>0.05,图 2),说明癌细胞已成功转染过表达SOX15基因。

|
| 1: pEGFP-N1-SOX15转染组;2: pEGFP-N1对照组;3:空白对照组; A: RT-PCR检测结果;B: Western blot检测结果 图 2 转染pEGFP-N1-SOX15在Caco2细胞中mRNA及蛋白表达 |
2.3 SOX15对Caco2细胞增殖活力的影响
转染Caco2细胞后,分别检测pEGFP-N1-SOX15转染组和pEGFP-N1对照组、空白对照组细胞在0、24、48、72 h 4个时间点光密度D(450)值,绘制细胞增殖曲线发现转染组细胞增殖活力较pEGFP-N1对照组及空白对照组显著降低(P<0.01),pEGFP-N1对照组及空白对照组差异无统计学意义(P>0.05,图 3)。表明SOX15可显著抑制Caco2细胞的增殖活力。

|
| a:P<0.01,与空白对照组、pEGFP-N1对照组比较 图 3 CCK-8检测pEGFP-N1-SOX15对Caco2细胞增殖活力的影响 |
2.4 SOX15对Caco2细胞克隆形成能力的影响
以Caco2细胞最低死亡浓度进行克隆形成,空白对照组细胞全部死亡。转染组pEGFP-N1-SOX15细胞通过实验形成的克隆数为(75±8) 个,pEGFP-N1对照组的细胞形成的克隆数为 (145±7)个,转染组细胞增殖能力明显低于pEGFP-N1对照组,差异有统计学意义(P<0.01,图 4) 。说明SOX15过表达可明显抑制Caco2细胞增殖能力。
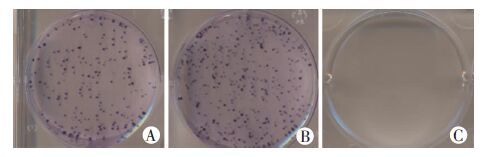
|
| A: EGFP-N1-SOX15转染组;B: pEGFP-N1对照组;C:空白对照组 图 4 克隆形成实验检测pEGFP-N1-SOX15对Caco2细胞克隆形成的影响 |
2.5 SOX15对Caco2细胞凋亡的影响
Caco2细胞转染48 h后,流式细胞仪检测细胞转染组pEGFP-N1-SOX15凋亡率为(15.96±1.87)%明显高于对照组pEGFP-N1凋亡率(4.56±1.30)%及空白对照组凋亡率(3.14±1.81)%,差异有统计学意义(P<0.01),对照组pEGFP-N1和空白对照组凋亡率差异无统计学意义(P>0.05,图 5)。说明SOX15过表达可明显促进CaCo2细胞凋亡。
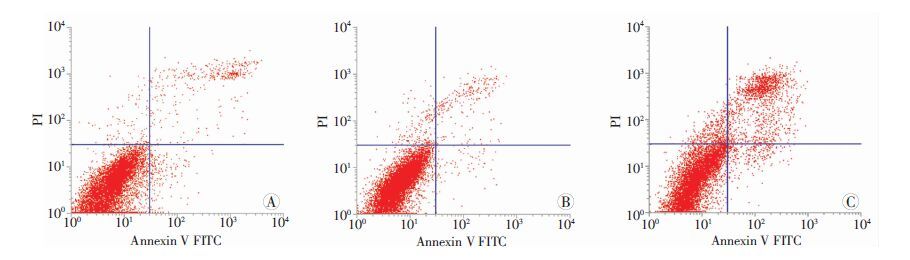
|
| A:空白对照组;B: EGFP-N1-SOX15转染组;C: pEGFP-N1对照组 图 5 流式细胞仪检测pEGFP-N1-SOX15对Caco2细胞凋亡的影响 |
2.6 SOX15对CaCo2细胞迁移和侵袭能力的影响
Transwell迁移实验结果显示pEGFP-N1-SOX15转染组Caco2细胞穿膜细胞数为(86±7)个明显少于pEGFP-N1 对照组穿膜细胞数为(466±22)个及空白对照组(483±13)个,差异具有统计学意义(P<0.01),pEGFP-N1 对照组和空白对照组差异无统计学意义(P>0.05,图 6)。侵袭实验结果显示,pEGFP-N1-SOX15转染组CaCo2细胞穿膜细胞数为(37±7)个,同样少于pEGFP-N1 对照组(147±16)个和空白对照组(159±11)个,差异具有统计学意义(P<0.01),pEGFP-N1 对照组和空白对照组差异无统计学意义(P>0.05,图 6)。说明SOX15过表达可明显抑制 CaCo2细胞迁移及侵袭能力。
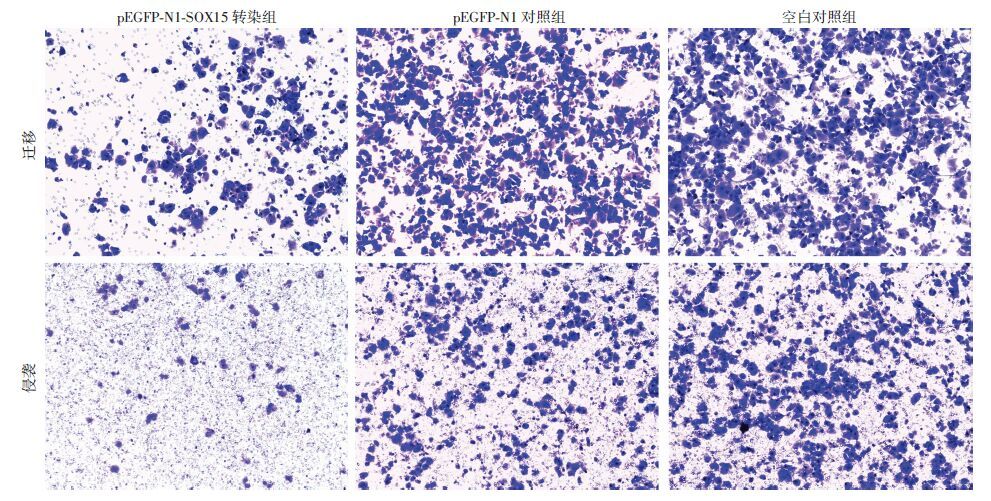
|
| 图 6 Transwell检测pEGFP-N1-SOX15对Caco2细胞迁移和侵袭影响 (结晶紫 ×100) |
3 讨论
结直肠癌发病的原因主要包括癌基因的上调和抑癌基因的下调,故其在基因水平上的研究越发受到关注[2]。SOX15在早期研究中通过与其他鼠科动物SOX基因的氨基酸同源性进行比对,结果表明SOX15属于SOX家族的边缘成员,相比于SOX家族中大部分的转录因子都是由单一外显子编码,SOX15 是唯一由位于HMG保守序列3′末端的内含子所编码的基因,其广泛存在于胎儿和成人的多个组织中,在细胞分化过程中起着重要的转录因子的作用[14]。但近年来有研究发现SOX15在包括结肠癌、胃癌、乳腺癌等肿瘤组织中均存在表达下调或者缺失[15],但其对结直肠癌细胞功能的调控作用及相关机制目前尚不清楚。故本实验首先以正常结肠组织为对照组,发现SOX15基因在人结肠癌细胞中mRNA水平显著下调,明确该基因可作为结直肠癌候选的抑癌基因。在此基础上进一步筛选出SOX15低表达的人结肠癌细胞Caco2,将成功构建的SOX15上调质粒转入Caco2细胞中,并通过RT-PCR及Western blot检测发现pEGFP-N1-SOX15转染Caco2细胞后其mRNA及蛋白表达较对照组明显上调,证明重组质粒可有效上调SOX15基因表达,为进一步检测SOX15对Caco2结肠癌细胞生物学功能的影响奠定了良好的基础。
本研究通过CCK-8及克隆形成实验证实SOX15基因对结肠癌细胞增殖能力起到明显抑制作用。流式细胞仪检测发现SOX15转染Caco2细胞后可明显促进癌细胞凋亡,尤其是结肠癌细胞早期凋亡率明显增加,进一步证明了 SOX15的转录水平及表达对Caco2结肠癌细胞的凋亡有较强的调控作用。同时通过Transwell实验证明转染SOX15还可明显降低结肠癌细胞迁移、侵袭能力。从分子水平上充分验证了SOX15对Caco2结肠癌细胞的抑制,并可作为结直肠癌新的候选抑癌因子发挥其抗肿瘤作用。但其对结肠癌细胞具体的作用机制仍需进一步的研究。
近年来研究表明SOX15与细胞增殖或者周期相关,如Yan 等[12]通过构建过表达的SOX15稳定NT2/D1人畸胎瘤细胞系发现SOX15也可明显抑制畸胎瘤细胞的增殖,并将癌细胞阻滞于G0~G1期,提示SOX15在睾丸胚胎细胞癌的增殖生长方面起到了重要作用。本实验也证明了SOX15同样可抑制结肠癌细胞的增殖,但其对癌细胞周期的调控作用仍需进一步验证。Thu等[11]通过联合应用DNA甲基化拷贝数分析和mRNA表达分析证实SOX15可在胰腺癌中存在表达丢失,杂合性丢失和异位DNA甲基化,并可作为Wnt/β-catenin负性调控因子介导胰腺癌的发生、发展,为本实验提供了进一步的研究方向。
抑癌基因抑制肿瘤细胞生长最主要的机制是调控细胞信号通路的转导[16]。大量研究证实Wnt/β-catenin信号通路在结直肠癌等多个类型肿瘤的浸润、转移等过程中起到关键作用[17-19],并且已有研究证实SOX家族其他成员可作为Wnt/β-catenin信号通路的负性调控因子影响肿瘤的增殖转移,其中也包括结直肠癌[20-22]。文献[11, 23]报道SOX15与Wnt/β-catenin有关,为研究SOX15在结直肠癌中的作用机制提供了理论依据。
综上所述,SOX15在结直肠癌发展过程中发挥着重要的调控作用,为深入了解结直肠癌发病机制奠定了实验基础,为结直肠癌的诊断及基因靶向治疗提供了新的思路。
| [1] | Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin,2016, 66 (2) : 115 –132. DOI:10.3322/caac.21338 |
| [2] | Brenner H, Kloor M, Pox C P. Colorectal cancer[J]. Lancet,2014, 383 (9927) : 1490 –1502. DOI:10.1016/S0140-6736(13)61649-9 |
| [3] | Castillo S D, Sanchez-Cespedes M. The SOX family of genes in cancer development: biological relevance and opportunities for therapy[J]. Expert Opin Ther Targets,2012, 16 (9) : 903 –919. DOI:10.1517/14728222.2012.709239 |
| [4] | 李雄武, 张徽, 柳满然. SOX2下调表达对MDA-MB-231乳腺癌细胞β-catenin与转录中介因子γ的影响[J]. 第三军医大学学报,2016, 38 (1) : 55 –61. DOI:10.16016/j.1000-5404.201506126 |
| [5] | Bass A J, Watanabe H, Mermel C H, et al. SOX2 is an amplified lineage-survival oncogene in lung and esophageal squamous cell carcinomas[J]. Nat Genet,2009, 41 (11) : 1238 –1242. DOI:10.1038/ng.465 |
| [6] | Li K, Wang R W, Jiang Y G, et al. Overexpression of Sox3 is associated with diminished prognosis in esophageal squamous cell carcinoma[J]. Ann Surg Oncol,2013, 20 (3) : 459 –466. DOI:10.1245/s10434-012-2792-6 |
| [7] | Du Y C, Oshima H, Oguma K, et al. Induction and down-regulation of Sox17 and its possible roles during the course of gastrointestinal tumorigenesis[J]. Gastroenterology,2009, 137 (4) : 1346 –1357. DOI:10.1053/j.gastro.2009.06.041 |
| [8] | Qin Y R, Tang H, Xie F, et al. Characterization of tumor-suppressive function of SOX6 in human esophageal squamous cell carcinoma[J]. Clin Cancer Res,2011, 17 (1) : 46 –55. DOI:10.1158/1078-0432.CCR-10-1155 |
| [9] | Meyer J, Wirth J, Held M, et al. SOX20, a new member of the SOX gene family, is located on chromosome 17p13[J]. Cytogenet Cell Genet,1996, 72 (2/3) : 246 –249. |
| [10] | Lee H J, Goring W, Ochs M, et al. Sox15 is required for skeletal muscle regeneration[J]. Mol Cell Biol,2004, 24 (19) : 8428 –8436. DOI:10.1128/MCB.24.19.8428-8436.2004 |
| [11] | Thu K L, Radulovich N, Becker-Santos O D, et al. SOX15 is a candidate tumor suppressor in pancreatic cancer with a potential role in Wnt/beta-catenin signaling[J]. Oncogene,2014, 33 (3) : 279 –288. DOI:10.1038/onc.2012.595 |
| [12] | Yan H T, Shinka T, Sato Y, et al. Overexpression of SOX15 Inhibits Proliferation of NT2/D1 Cells derived from a testicular embryonal cell carcinoma[J]. Mol Cells,2007, 24 (3) : 323 –328. |
| [13] | Sulahian R, Chen J, Arany Z, et al. SOX15 governs transcription in human stratified epithelia and a subset of esophageal adenocarcinomas[J]. Cell Mol Gastroenterol Hepatol,2015, 1 (6) : 598 –609. DOI:10.1016/j.jcmgh2015.07.009 |
| [14] | Ito M. Function and molecular evolution of mammalian Sox15, a singleton in the SoxG group of transcription factors[J]. Int J Biochem Cell Biol,2010, 42 (3) : 449 –452. DOI:10.1016/j.biocel.2009.10.023 |
| [15] | Thu K L, Becker-Santos O D, Radulovich N, et al. SOX15 and other SOX family members are important mediators of tumorigenesis in multiple cancer types[J]. Oncoscience,2014, 1 (5) : 326 –335. DOI:10.18632/oncoscience.46 |
| [16] | Sever R, Brugge J S. Signal transduction in cancer[J]. Cold Spring Harbor Perspect Med,2015, 5 (4) . DOI:10.1101/cshperspect.a006098 |
| [17] | Wang S, Dong Y, Zhang Y, et al. DACT2 is a functional tumor suppressor through inhibiting Wnt/beta-catenin pathway and associated with poor survival in colon cancer[J]. Oncogene,2015, 34 (20) : 2575 –2585. DOI:10.1038/onc.2014.201 |
| [18] | Boone J D, Arend R C, Johnston B E, et al. Targeting the Wnt/beta-catenin pathway in primary ovarian cancer with the porcupine inhibitor WNT974[J]. Lab Invest,2016, 96 (2) : 249 –259. DOI:10.1038/labinvest2015.150 |
| [19] | Jang G B, Kim J Y, Cho S D, et al. Blockade of Wnt/beta-catenin signaling suppresses breast cancer metastasis by inhibiting CSC-like phenotype[J]. Sci Rep,2015, 5 : 12465 . DOI:10.1038/srep12456 |
| [20] | Sinner D, Kordich J J, Spence J R, et al. Sox17 and Sox4 differentially regulate beta-catenin/T-cell factor activity and proliferation of colon carcinoma cells[J]. Mol Cell Biol,2007, 27 (22) : 7802 –7815. DOI:10.1128/MCB.02179-06 |
| [21] | Ma F, Ye H, He H H, et al. SOX9 drives WNT pathway activation in prostate cancer[J]. J Clin Invest,2016, 126 (5) : 1745 –1758. DOI:10.1172/JCI78815 |
| [22] | Liu H, Yan Z Q, Li B, et al. Reduced expression of SOX7 in ovarian cancer: a novel tumor supressor through the Wnt/β-catenin signaling pathway[J]. J Ovarian Res,2014, 7 : 87 . DOI:10.1186/s13048-014-0087-1 |
| [23] | Bernard P, Harley V R. Acquisition of SOX transcription factor specificity through protein-protein interaction, modulation of Wnt signalling and post-translational modification[J]. Int J Biochem Cell Biol,2010, 42 (3) : 400 –410. DOI:10.1016/j.biocel.2009.10.017 |



