登革病毒(dengue virus,DENV)为黄病毒属的单股正链RNA病毒,具有4种抗原性不同血清型,主要以蚊虫为媒介进行传播,广泛分布于热带及亚热带地区[1]。我国海南、广东等地区是登革病毒感染的重要疫区[2]。登革病毒侵入人体后首先感染皮下的未成熟树突状细胞(dendritic cells,DCs)[3],进而复制增殖并感染其他细胞。登革病毒感染DCs的过程复杂,受多种因素调控。研究表明,CD209(cluster of differentiation 209,又称Dendritic cell-specific intercellular adhesion molecule-3-grabbing non- integrin,DC-SIGN)基因启动子多态性是影响登革病毒感染的潜在因素之一[4-6],但具体机制仍未阐明。
CD209为DCs表面的一种Ⅱ型跨膜糖蛋白,该分子能识别登革病毒表面E蛋白的受体结合区,介导登革病毒感染DCs[7-8]。为明确登革病毒-宿主(受体分子)相互作用的具体过程及影响因素,建立稳定、可靠的登革病毒感染细胞模型势在必行。目前,常用于研究登革病毒-CD209相互作用的细胞模型大都为用细胞转染技术建立的CD209表达细胞系,如THP-1细胞、Raji细胞等[8-9],但人工建立的细胞系能否真实地反映登革病毒感染DCs的过程仍有待探讨。因此,探索以人体分离的原代DCs为宿主的病毒感染模型意义重大。本研究团队前期开展了基于中国人群的CD209启动子多态性与登革病毒感染相关性的研究,发现我国人群DCs的CD209,-139A/-336A基因型分布最广。本研究首先从该基因型血液标本中分离并培养原代DCs,对分离DCs的形态及功能进行验证,再以登革病毒 GZ2002株为模式病毒,开展感染性研究,建立以人原代DCs为宿主的登革病毒感染模型,以期为后续研究登革病毒-DCs相互作用及CD209启动子多态性影响登革病毒感染的机制奠定基础。
1 材料与方法 1.1 主要材料本研究获第三军医大学临床试验伦理审查委员会批准(2011年)。人外周血标本来源于第三军医大学西南医院急诊科的外伤患者,男性,46岁,除左手桡骨远端骨折外,余正常。前期小样本证实其血样为DCs CD209,-139A/-336A型,征得患者同意后,采集外周抗凝血30 mL,用于分离原代DCs。I型登革病毒 GZ2002株为本室早期分离并于液氮保存,C6/36细胞、Vero细胞为本室保存,流式细胞仪(BD FACS Calibur,美国),激光共聚焦显微镜(Leica TCS-NT,德国),鼠抗人CD1a抗体(FITC)、CD83(FITC)、HLA-DR(PE)及同型对照正常鼠IgG1K(FITC,eBioscience,美国),间接免疫荧光抗体anti-E抗体(Abcam,美国)。
1.2 方法 1.2.1 病毒复苏及培养37 ℃水浴迅速复苏液氮冻存的C6/36细胞,置于RPMI1640(含12% FBS)培养液中培养至单层。将液氮冻存的登革病毒 GZ2002株毒液常温融化后进行接种感染。感染1 h后,以RPMI1640(含2% FBS)培养液替换瓶内病毒上清液并继续培养。感染2 d后开始观察细胞病变(CPE),当出现明显细胞病变时收集感染细胞及上清,以Vero细胞为宿主,采用噬斑法检测病毒滴度后冻存备用。
1.2.2 人原代DCs(CD209,-139A/-336A)的分离培养人外周抗凝血标本中分离、提取DCs前体细胞并进行诱导。取外周抗凝血30 mL,加入等量D-Hanks液稀释混匀;向无菌离心管(25 mL) 内预先加入10 mL人淋巴细胞分离液,将上述稀释抗凝血缓慢加入离心管,使之与分离液形成明显分层;室温条件下400 r/min 水平离心30 min,将乳白色细胞层(第2层)收集至另一无菌离心管中,以4倍体积的D-Hanks液洗涤细胞1次;再以人血红细胞裂解液重悬细胞沉淀并离心至细胞沉淀为白色,继续以D-Hanks液洗涤细胞;以无血清RPMI1640培养液洗涤细胞1次后用RPMI1640(含10% FBS)培养液重悬细胞;37 ℃、5% CO2孵育6 h后轻微晃动并吸去上清及非贴壁细胞,以37 ℃预热的RPMI1640(含10%FBS)培养基冲洗贴壁细胞1次,即获得人DCs前体细胞;加入RPMI1640完全培养基(含10% FBS,100 ng/mL rhGM-CSF,50 ng/mL rhIL-4),37 ℃、5% CO2条件下培养,诱导DCs生长。
1.2.3 DCs的鉴定 1.2.3.1 瑞氏染色观察DCs的生长形态收集DCs,均匀涂抹在以5%多聚赖氨酸包被的盖玻片上,自然风干后冰甲醇-20 ℃固定,PBS洗涤后用瑞氏染液进行染色,倒置显微镜观察。
1.2.3.2 流式细胞术检测DCs表面特异标志CD1a收集DCs,PBS重悬后分装于2支EP管,分别以鼠抗人CD1a抗体(FITC)及正常鼠IgG1K(FITC)做对照进行细胞表面染色,染色条件为4 ℃避光30 min,以PBS洗涤细胞2次后,流式检测CD1a的表达水平。
1.2.3.3 淋巴细胞增殖实验评价DCs的生物学功能收集DCs作为刺激细胞,以1.2.2中收集的非贴壁细胞为反应细胞;以RPMI1640(含2% FBS)将DCs的浓度调整为1×106、1×105、5×104、2×103、1×103/mL,分别加入96孔培养板,每个浓度设置3个复孔,分别向每孔加入1×106反应细胞;37 ℃培养3 d后,加入5 mg/mL的MTT 20 μL并于4 h后终止培养;小心吸除每孔上清,加入DMSO 150 μL,轻微振荡至甲瓒结晶溶解,利用DG-3022型酶联免疫检测仪读取570 nm波长处的光密度值[D(570)],实验结果以 3个复孔的均值呈现。
1.2.4 登革病毒感染细胞模型的建立与评价 1.2.4.1 病毒感染将分离的原代DCs传代于24孔培养板中(5×105/孔),次日吸干培养液,加入登革病毒 GZ2002株病毒液1 mL进行感染(MOI=0.1),感染2 h后弃病毒上清液,加入RPMI1640(含10% FBS)培养液,37 ℃继续培养3 d后分别收集细胞及上清进行评价。
1.2.4.2 流式细胞术检测DCs表面标志CD83和HLA-DR的表达变化取感染后的DCs,用CD83(FITC)和HLA-DR(PE)进行表面染色,以同型鼠IgG1K(FITC)染色细胞为对照进行流式细胞术检测。
1.2.4.3 间接免疫荧光检测将感染了登革病毒的DCs盖玻片用4%的多聚甲醛固定,用登革病毒特异的anti-E抗体进行间接免疫荧光染色,用DAPI (4’,6-diamidino-2-phenylindole)染色细胞核,激光共聚焦显微镜观察DCs中登革病毒复制增殖情况。
1.2.4.4 培养上清病毒滴度检测以Vero细胞为宿主,采用病毒噬斑法检测DCs培养上清中登革病毒滴度,评价登革病毒在DCs (CD209,-139A/-336A)中的复制增殖与释放。
1.3 统计学处理采用SPSS 18.0统计软件,进行单因素方差分析,P<0.05为差异有统计学意义。
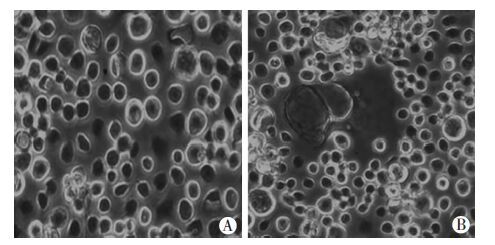
2 结果 2.1 登革病毒 GZ2002株复苏、培养C6/36细胞感染登革病毒 GZ2002株后第3天出现典型的细胞病变效应(+ + +):细胞变大肿胀,堆积融合,形成空泡、网状结构,并出现细胞脱落现象,与正常细胞相比具有显著差异(图 1)。利用Vero细胞噬斑实验检测感染上清中病毒的滴度为1×104 pfu/mL。
|
| A:正常C6/36细胞;B:登革病毒 GZ2002株感染3 d后的C6/36细胞 图 1 登革病毒GZ2002株对C6/36细胞的致病变性 (倒置显微镜×400) |
2.2 人原代DCs的培养及鉴定
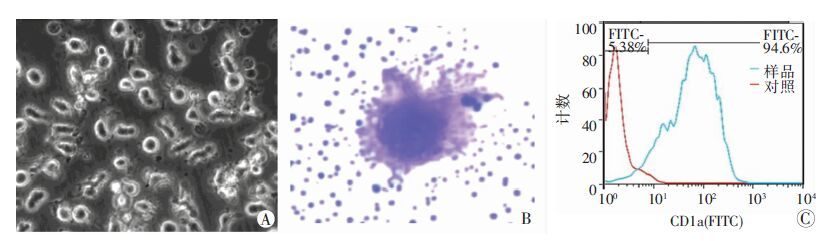
从健康人外周抗凝血中分离出DCs前体细胞,于含细胞因子(rhGM-CSF、rhIL-4)的RPMI 1640培养基中诱导生长,每日观察细胞生长状况,培养约7 d后可见形态典型的未成熟DCs(图 2A)。为鉴定DCs的形态,对细胞进行瑞氏染色,显微镜下可见细胞呈蓝紫色,核深染,形态完整但不规则,体积较大,细胞膜边界清晰,细胞表面有明显的毛刺样树突状突起,呈典型的非成熟DCs形态(图 2B)。
CD1a是未成熟DCs表面的重要标志物之一。利用流式细胞术分析诱导DCs前体细胞向未成熟DCs分化的效率,发现利用本方法获得的CD1a+细胞率超过90%(图 2C)。为进一步鉴定DCs的生物活性,分析了DCs刺激淋巴细胞增殖的能力。结果显示,培养的DCs具有明显的刺激淋巴细胞增殖的能力,刺激效果具有显著的细胞数量依赖性,以1×103 DCs进行刺激,D(570)值为(0.140 6±0.012 1),以2×103、5×104、1×105、1×106等不同数目DCs分别进行刺激,D(570)值分别为(0.278 2±0.018 9)、(0.334 4± 0.030 2)、(0.434 7±0.000 4)和(0.526 2±0.000 3),与1×103 DCs的检测结果相比,差异均有统计学意义(P<0.05)。
|
| A: 倒置显微镜观察培养5 d的DCs细胞(×100);B: 瑞氏染色观察培养7 d的DCs细胞(×1 000);C:流式细胞术检测DCs表面标志CD1a的表达水平 图 2 人原代DCs的形态观察及生物活性鉴定 |
2.3 登革病毒感染人DCs(CD209,-139A/-336A)细胞模型的建立与评价
登革病毒 GZ2002株感染人原代DCs (CD209,-139A/-336A)后,细胞会向成熟DCs分化。采用流式细胞术检测细胞表面标志物,证实登革病毒感染后DCs表面的成熟标志物HLA-DR及CD83分子表达量均显著增高,HLA-DR由感染前的34.6%升至感染后的77.4%,CD83由感染前的14.9%上升至感染后的66.8%。表明登革病毒 GZ2002株感染人原代DCs (CD209,-139A/-336A)后能促进其成熟活化。
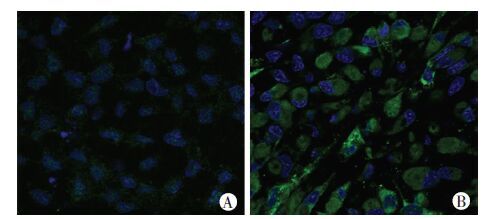
为确认感染的登革病毒进入DCs并增殖,采用间接免疫荧光检测DCs中病毒E抗原。如图 3所示,超过90%的感染DCs中有登革病毒存在,表明登革病毒 GZ2002株能成功感染人原代DCs (CD209,-139A/-336A),细胞模型建立成功。进一步以Vero细胞为宿主,采用病毒噬斑法检测登革病毒感染DCs培养上清中的病毒滴度,结果为1×105 pfu/mL,证实登革病毒感染DCs(CD209,-139A/-336A)后可裂解细胞并释放病毒。
|
| A:未感染登革病毒的DCs(蓝色为细胞核); B:感染登革病毒的DCs(anti-E抗体染色) 图 3 间接免疫荧光染色观察登革病毒在DCs中的复制增殖 (激光共聚焦显微镜 ×1 000) |
3 讨论
登革病毒是一种重要的蚊媒传播病毒,传播范围广泛,致病性强。长期以来,科研人员以登革病毒为对象开展了大量研究,但仍未获得有效的疫苗及预防药物,究其原因主要是因为对病毒的致病机制缺乏全面深入的了解。而阐明病毒的致病机制,必须首先建立稳定的、能良好反映病毒在人体致病过程的感染模型。
登革病毒致病的第一步是在蚊媒叮咬局部对靶细胞进行吸附和感染。2000年,Wu等[3]首次证实了朗格汉斯细胞是登革病毒感染的首要靶细胞,为进一步研究病毒-宿主相互作用奠定了基础。2003年,Navarro-Sanchez等[7-8]研究发现DC-SIGN(CD209)可能是介导登革病毒感染DCs的受体分子,其使用的细胞模型均为人工改造的能稳定表达CD209的THP-1细胞系。此后,多项基于细胞转染技术的CD209表达细胞系被成功构建,如Raji细胞、HeLa细胞、BHK21细胞和L929细胞等[10-13]。其中,一些细胞模型已被用于研究登革病毒-靶细胞相互作用[10],但其能否全面反映登革病毒-DCs相互作用仍有待商榷。
本研究旨在建立以人原代DCs为基础的登革病毒感染细胞模型,使其能真实反映病毒-细胞相互作用,为进一步研究中国人群CD209启动子多态性影响登革病毒感染的机制奠定基础。本研究首先尝试分离人CD209,-139A/-336A基因型对应的DCs。通过密度梯度离心法获得外周血中的DCs前体细胞,进一步采用传统的贴壁法加细胞因子诱导获得未成熟的DCs。该方法费用低,适合大样本制备[14-16]。本实验中使用GM-CSF和IL-4联合诱导,GM-CSF是诱导和培养DCs的重要因子[17],而IL-4能抑制中性粒细胞和巨噬细胞生长,从而增加前体细胞向DCs的分化。结果表明,诱导分化效率高达90%以上,符合预期结果。
根据目前常用的DCs鉴定方法对培养的细胞进行观察和鉴定,实验获得的DCs经证明具有典型的DCs细胞形态和生物学功能。进一步以GZ2002株为模式病毒开展登革病毒感染实验,发现DCs在感染登革病毒后形态变化明显,胞体变圆,树突回缩,细胞发育趋向成熟,成熟标志物HLA-DR和CD83表达水平增高,与皮肤朗格汉斯细胞经登革病毒感染后的变化相似[3]。此外,90%以上的感染细胞中可检测到登革病毒复制 增殖,感染细胞培养上清的病毒滴度可达1×105 pfu/mL。 表明成功建立人原代DCs的分离培养方法,以及登革病毒体外感染原代DCs的模型。实验中大量观测指标如DCs形态,DCs表面分子CD1a、CD83及HLA-DR表达水平的改变等,均是在人工改造的CD209表达细胞系上无法实现的,再次证明本研究的优越性及重要意义。
本研究的不足之处在于尚未获得4种基因型对应的细胞感染模型。目前,本研究仅构建了CD209,-139A/-336A优势基因型对应的人原代DCs登革病毒感染模型,这主要受限于其他基因型的样本数量极为稀少。本课题组前期调查发现,中国人群CD209启动子-136位点及-336位点具有明显的连锁不平衡现象,该现象与文献[5, 18-19]报道相一致。在中 国人群中,仅考虑纯合子基因型组合,-139AA/-336AA 基因型频率最高,为36.5%,139AA/-336GG、 -139GG/-336AA 和-139GG/-336GG的频率则依次为1.5%、9.9%和0.5%。致使部分基因型对应的抗凝血标本难于获取。同时,人群健康差异性和抗凝血标本制备及保存的差异性导致从不同的标本分离的DCs前体细胞质量及数量差异明显,也给本研究的工作增加了难度。此外,本研究的不足之处还在于仅使用了1株登革病毒进行了病毒感染实验。GZ2002株属于Ⅰ型登革病毒[20],在今后工作中,我们还将进一步开展其他3型病毒的人原代DCs感染实验,以拓展本研究成果的应用领域。
| [1] | Bhatt S, Gething P W, Brady O J, et al. The global distribution and burden of dengue[J]. Nature,2013, 496 (7446) : 504 –507. DOI:10.1038/nature12060 |
| [2] | Wang L, Yang G, Jia L, et al. Epidemiologic characteristics of dengue in China (2010-2014)[J]. J Infect,2015, 71 (3) : 397 –399. DOI:10.1016/j.jinf.2015.04.018 |
| [3] | Wu S J, Grouard-Vogel G, Sun W, et al. Human skin Langerhans cells are targets of dengue virus infection[J]. Nat Med,2000, 6 (7) : 816 –820. DOI:10.1038/77553 |
| [4] | Sakuntabhai A, Turbpaiboon C, Casadémont I, et al. A variant in the CD209 promoter is associated with severity of dengue disease[J]. Nat Genet,2005, 37 (5) : 507 –513. DOI:10.1038/ng1550 |
| [5] | Alagarasu K, Damle I M, Bachal R V, et al. Association of promoter region polymorphisms of CD209 gene with clinical outcomes of dengue virus infection in Western India[J]. Infect Genet Evol,2013, 17 : 239 –242. DOI:10.1016/j.meegid.2013.04.024 |
| [6] | Xavier-Carvalho C, Gibson G, Brasil P, et al. Single nucleotide polymorphisms in candidate genes and dengue severity in children: a case-control, functional and meta-analysis study[J]. Infect Genet Evol,2013, 20 : 197 –205. DOI:10.1016/j.meegid.2013.08.017 |
| [7] | Navarro-Sanchez E, Altmeyer R, Amara A, et al. Dendritic-cell-specific ICAM3-grabbing non-integrin is essential for the productive infection of human dendritic cells by mosquito-cell-derived dengue viruses[J]. EMBO Rep,2003, 4 (7) : 723 –728. DOI:10.1038/sj.embor.embor866 |
| [8] | Tassaneetrithep B, Burgess T H, Granelli-Piperno A, et al. DC-SIGN (CD209) mediates dengue virus infection of human dendritic cells[J]. J Exp Med,2003, 197 (7) : 823 –829. DOI:10.1084/jem.20021840 |
| [9] | Richter M K, da Silva Voorham J M, Torres Pedraza S, et al. Immature dengue virus iIs infectious in human immature dendritic cells via interaction with the receptor molecule DC-SIGN[J]. PLoS One,2014, 9 (6) : e98785 . DOI:10.1371/journal.pone.0098785 |
| [10] | Roehrig J T, Butrapet S, Liss N M, et al. Mutation of the dengue virus type 2 envelope protein heparan sulfate binding sites or the domain Ⅲ lateral ridge blocks replication in Vero cells prior to membrane fusion[J]. Virology,2013, 441 (2) : 114 –125. DOI:10.1016/j.virol.2013.03.011 |
| [11] | 王宇, 阎瑾琦, 张亮, 等. DC-SIGN真核表达载体的构建及其稳定转染BHK21细胞系的建立[J]. 解放军医学杂志,2010, 35 (3) : 304 –306. |
| [12] | 王欣, 谭磊, 陆凤, 等. DC-SIGN真核表达载体的构建及其稳定转染HeLa细胞系的建立[J]. 中国动物传染病学报,2015, 23 (3) : 12 –16. DOI:10.3969/j.issn.1674-6422.2015.03.003 |
| [13] | 朱守兵, 王泳, 高超, 等. 人DC-SIGN基因克隆及其转基因细胞的构建[J]. 苏州大学学报(医学版),2010, 30 (1) : 102 –105. |
| [14] | Garderet L, Cao H, Salamero J, et al. In vitro production of dendritic cells from human blood monocytes for therapeutic use[J]. J Hematother Stem Cell Res,2001, 10 (4) : 553 –567. DOI:10.1089/15258160152509163 |
| [15] | Liu K, Nussenzweig M C. Origin and development of dendritic cells[J]. Immunol Rev,2010, 234 (1) : 45 –54. DOI:10.1111/j.0105-2896.2009.00879.x |
| [16] | Romani N, Gruner S, Brang D, et al. Proliferating dendritic cell progenitors in human blood[J]. J Exp Med,1994, 180 (1) : 83 –93. DOI:10.1084/jem.180.1.83 |
| [17] | van de Laar L, Coffer P J, Woltman A M. Regulation of dendritic cell development by GM-CSF: molecular control and implications for immune homeostasis and therapy[J]. Blood,2012, 119 (15) : 3383 –3393. DOI:10.1182/blood-2011-11-370130 |
| [18] | Barkhash A V, Perelygin A A, Babenko V N, et al. Single nucleotide polymorphism in the promoter region of the CD209 gene is associated with human predisposition to severe forms of tick-borne encephalitis[J]. Antiviral Res,2012, 93 (1) : 64 –68. DOI:10.1016/j.antiviral.2011.10.017 |
| [19] | Alagarasu K, Damle I M, Bachal R V, et al. Association of promoter region polymorphisms of CD209 gene with clinical outcomes of dengue virus infection in Western India[J]. Infect Genet Evol,2013, 17 : 239 –242. DOI:10.1016/j.meegid.2013.04.024 |
| [20] | 方昕, 胡珍, 张俊磊, 等. 登革1型病毒GZ2002株全基因组测序与分析[J]. 中国现代医学杂志,2012, 22 (14) : 25 –33. |



