脑卒中是致人残疾、死亡的重要疾病之一[1],其中缺血性脑卒中占70%~87%。缺血性脑卒中时脑组织发生非特异性炎症反应, 过度发生的炎症反应可进一步加剧脑组织继发性损伤[2]。合理控制脑缺血后炎症反应可减轻脑组织继发性损伤,在缺血性脑卒中的治疗中占重要地位。一些抗炎药物能抑制缺血后炎症反应,具有良好的神经保护作用,但其临床疗效并不显著。近年来,干细胞在组织再生修复中的作用越来越受到广泛关注,成为本领域的研究热点之一。间充质干细胞(mesenchymal stem cells, MSCs)可促进脑卒中动物损伤脑组织与损伤神经的修复[3-4],但其机制尚不清楚。
趋化因子CX3C的配体1(chemokine CX3C ligand 1,CX3CL1)是内皮细胞表达的具有黏附和趋化双重活性的细胞因子。CX3CL1具有趋化与黏附作用,参与白细胞尤其是吞噬细胞与淋巴细胞的游走与活化,介导细胞间的黏附,在炎症反应中发挥重要作用,其受体CX3CR1表达于神经系统的小胶质细胞[5]。在炎症反应中,由于炎症信号的驱使,MSCs能显著增加小胶质细胞上与神经保护密切相关的CX3CR1的表达[5]。因此,MSCs促进脑卒中动物损伤脑组织与损伤神经修复的机制可能与其分泌CX3CL1调控炎症反应密切相关, 但这尚需研究证实。
本实验首先分离、培养并鉴定大鼠骨髓间充质干细胞(bone marrow derived mesenchymal stem cells, bMSCs),然后采用慢病毒RNA干扰(RNA interference, RNAi)、CCK-8、Real-time PCR及Western blot等实验,探讨沉默CX3CL1对bMSCs生长的影响以及沉默CX3CL1的bMSCs的趋化效应,以期为研究bMSCs可能通过分泌CX3CL1基因调控炎症反应在介导脑卒中神经功能恢复中的可能机制奠定基础。
1 材料与方法 1.1 材料本实验使用的材料包括DMEM高糖培养基(HyClone);胎牛血清(Sigma);CD44、CD45及CX3CL1兔多克隆抗体(Santa Cruz);Anti-Mouse/Rat CD90 FITC抗体(Ebioscience);质粒抽提试剂盒与胶回收试剂盒(Roche);RT-PCR试剂盒(大连宝生物);寡核苷酸oligos、慢病毒载体CD513B-1、干扰靶序列的DNA oligo合成、引物合成与测序(上海捷瑞);CCK-8试剂盒(Toyobo);Lipofectamine® 2000(Invitrogen);PCNA兔多克隆抗体(Millipore);PVDF膜(Bio-Rad)。
22只SD大鼠购自第三军医大学实验动物中心,体质量190 g左右,生产许可证号为SCXK (渝)2012~0003,雌雄均有,于恒湿50%~80%与恒温18~22 ℃条件的SPF级动物室饲养,自由摄取无菌水与标准饲料。
1.2 方法 1.2.1 bMSCs的分离、培养及流式细胞术(FCM)检测鉴定大鼠bMSCs的分离、培养参照文献[6-7]进行, 具体如下。陆眠宁Ⅱ肌肉注射(0.25 mL/kg)麻醉大鼠后,颈椎脱臼处死,整体浸泡于75%的乙醇中10 min,取其双侧股骨与胫骨,无菌条件下用DMEM/F12培养液反复冲洗其髓腔,获得细胞悬液,按1:1(容积比)加入Percoll细胞分离液(比重:1.073),2 500 r/min离心20 min, 取其交界处白膜层,培养基洗涤2次。将细胞按约2×107/mL的密度种植于DMEM/F12完全培养液(含10% FBS、100 U/mL青霉素、100 U/mL链霉素)中, 于37 ℃、5% CO2及饱和湿度环境中培养, 24 h后换人新鲜完全培养液,以后每2~3天换液1次, 培养6~9 d, 挑取单克隆细胞, 放入6孔板, 相同环境中培养, 细胞生长至80%~100%汇片时, 0.25%的胰酶(含0.02% EDTA)消化, 按约6.5×103/cm2的细胞的密度接种传代扩增。
取培养4~6 d的第3代bMSCs制成细胞悬液,经PBS洗涤并计数,确保每组细胞不少于1×105个。在细胞样本中分别加入CD44、CD45及CD90抗体,避光,37 ℃孵育1.5 h,以不加抗体的细胞为对照。PBS再次重悬各待测细胞,流式细胞术分别检测不同抗体标记的细胞百分率,具体按各抗体说明书进行。实验重复3次。
1.2.2 CX3CL1基因最佳RNAi靶点的确定参照文献[8]进行最佳RNAi靶点的确定,具体如下。从大鼠CX3CL1基因mRNA序列中筛选出3个RNA干扰序列,分别为:①ACCCAGTTCATACTGATAT;②CTCTATGAGCAATTATTTA;③CAACTCGTTCTGTCTTTGC,并合成其相应siRNAs。即:①5′-ACCCAGUUCAUAC-UGAUAUUU-3′/3′-UUUGGGUCAAGUAUGACUAUA-5′;②5′-CUCUAUGAGCAAUUAUUUAUU-3′/3′-UUGAGA-UACUCGUUAAUAAAU-5′;③5′-CAACUCGUUCUGUCUUUGCUU-3′/3′-UUGUUGAGCAAGACAGAAACG-5′。分别将这3个siRNAs导入bMSCs,以未导入siRNAs的细胞为对照,严格按其操作说明进行。采用Western blot分别检测3个siRNAs对bMSCs的CX3CL1蛋白的抑制情况,以此明确CX3CL1基因的最优RNAi序列。具体为将各细胞总蛋白转置NC膜上,置于含CX3CL1的兔多克隆抗体的封闭液中,抗体稀释度为1:800,置4 ℃环境24 h,随后与稀释度为1:700的相应酶标二抗共同孵育约1.5 h (室温), 和发光底物作用8 min左右。以相对分子质量为4.3×104的β-actin作内参。
1.2.3 CX3CL1 shRNA慢病毒载体的构建与鉴定设计并合成能生成最佳siRNA的CX3CL1的短发夹RNA (正义链:5′-AATTCCTCTATGAGCAATTATTTACTTCCTGTCAGATAAATAATTGCTCATAGAGTTTTTG-3′,反义链:5′-GATCCAAAAACTCTATGAGCAATTATTTA-TCTGACAGGAAGTAAATAATTGCTCATAGAGG-3′),并克隆至慢病毒载体CD513B-1的EcoRⅠ及BamHⅠ位点间,构建重组慢病毒载体CD513B-1/CX3CL1 shRNA。转化感受态菌。测序鉴定重组慢病毒载体CD513B-1/CX3CL1 shRNA的正确性。
1.2.4 重组慢病毒CX3CL1 shRNA的包装及滴度测定将293T细胞种植于6孔板,密度约4.5×105细胞/孔,待细胞生长至60%~80%汇片时,在基因转染试剂Lipofectamine® 2000与包装质粒的作用下,将测序正确的CD513B-1/CX3CL1 shRNA的DNA导入病毒包装细胞293T,8 h后替换其培养基,再培养40 h, 显微镜下观察细胞的绿色荧光蛋白(GFP)的变化并拍照。再培养32 h后予以收集,离心10 min (4 ℃,4 000×g),用0.45 μm滤器无菌过滤其上清液,滤液经浓缩后分装,于-80 ℃存放备用。
用上述病毒液转染接种于24孔板中的293T细胞,倍比稀释方法测定并计算其病毒滴度,病毒滴度=(P×N/100×V)/DF, N:105(每孔细胞数)、P:GFP阳性克隆数、V:病毒液稀释体积(mL)、DF:稀释倍数。
1.2.5 bMSCs的CD513B-1/CX3CL1 shRNA病毒感染以1:50比例(病毒液和培养液体积比)感染种植于6孔板的第2或第3代bMSCs,以未感染的bMSCs作对照,培养24~72 h后,用倒置显微镜观察被感染bMSCs的GFP的表达情况。
1.2.6 重组慢病毒CD513B-1/CX3CL1 shRNA对bMSCs生长的影响将第2或第3代bMSCs接种到96孔板中,每孔150 μL培养液中接种3 000个bMSCs,5~7 d后,按病毒液与培养基1:50的体积比添加上述经浓缩的病毒液;正常对照采用空病毒感染的bMSCs,空白对照采用常规培养的bMSCs。加病毒液后1、2、3 d与4 d分别取96孔板1块,每孔替换新鲜培养基(含10 μL的CCK-8),培养约3 h后,在酶标仪上检测其光密度值[D(450)]。以D(450)值为纵坐标,培养时间为横坐标,绘制细胞增殖曲线图, 该实验进行3次。
1.2.7 Real-time PCR检测沉默CX3CL1基因的bMSCs的PCNA基因的表达变化设计并合成大鼠的PCNA (NM_022381.3)基因引物,上游引物:5′-TGTCCCAGACAAGCAATGTT-3′, 下游引物:5′-AGGAGACAGTGGAGTGGCTT-3′。以经CD513B-1/CX3CL1 shRNA病毒液感染的bMSCs总RNA为模板,Real-time PCR检测被感染bMSCs的PCNA基因的表达,对照采用空病毒感染或不感染的用bMSCs,内参采用β-actin。
1.2.8 Western blot检测沉默CX3CL1基因的bMSCs的PCNA蛋白的表达变化采用Western blot把1.2.7的各组bMSCs总蛋白转移至PVDF膜,放入含PCNA的兔多克隆抗体(1:600)的封闭液中,置4 ℃环境24 h,随后与稀释度为1:500的相应酶标二抗共同孵育约1.5 h (室温), 和发光底物作用8 min左右。以相对分子质量为4.3×104的β-actin作内参。
1.2.9 沉默CX3CL1对bMSCs周期的影响参照文献[9]检测沉默CX3CL1对bMSCs周期的影响,具体为,密度为1×106个细胞/mL的经上述病毒感染的bMSCs培养48 h,经空病毒感染或未经感染的bMSCs作对照。
收集并计数各组bMSCs,保证各bMSCs样品有1×104~2×106个细胞,75%酒精固定各bMSCs样品24~72 h,碘化丙啶(PI)染色, FCM检测分析各bMSCs样品的周期变化情况,此实验重复3次。
1.2.10 沉默CX3CL1基因的bMSCs趋化效应的Western blot检测参照文献[10]分离培养大鼠脾巨噬细胞。以5×105个细胞/mL种植第2或第3代经上述病毒感染的bMSCs于6孔板中培养24 h,用与bMSCs相同密度的脾巨噬细胞接种于和6孔板孔匹配的Transwell培养小室,将该小室放入6孔板和经病毒感染的bMSCs共培养作第1实验组,在此共培养体系中加入细胞因子CX3CL1作第2实验组,两组48 h后收集脾巨噬细胞,采用Western blot检测其趋化因子M-CSF、IL-8的表达变化,分别以与空病毒感染的bMSCs相同密度共培养的脾巨噬细胞和单纯培养的脾巨噬细胞的相同检测作对照,具体方法与1.2.8的相同。
1.3 统计学方法采用SPSS 16.0统计软件的方差分析与t检验分别被用于统计比较多组间与两组间数据差异,用x±s呈现统计比较结果,P < 0.05为差异有统计学意义。
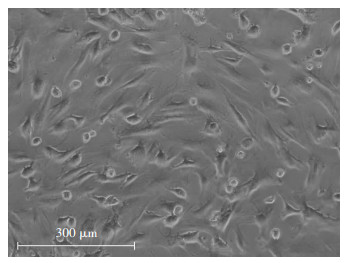
2 结果 2.1 bMSCs的分离培养及鉴定倒置显微镜下,初接种的bMSCs呈散在集落,细胞由圆形变为不规则形,大部分细胞呈纺锤样、长梭形。培养6~9 d后, 挑取其单克隆培养。经传代扩增的单克隆bMSCs, 长势良好,待生长至80%~100%汇片时进行传代扩增,传代扩增的bMSCs分布均匀,形态较均一,以梭形为主(图 1),细胞分裂生长旺盛,生长速度较原代细胞明显加快,5~7 d可传代扩增。流式细胞术检测结果显示,bMSCs稳定表达中胚层来源细胞的表型标志CD44、CD90,阳性率分别为94.7%和86.5%,微弱表达或不表达造血细胞的表型标志CD45,阳性率为0.972%(图 2)。
|
| 图 1 倒置显微镜下传代扩增的bMSCs |

|
| A:CD44;B:CD90;C:CD45 图 2 流式细胞术检测骨髓间充质干细胞的CD44、CD90与CD45的阳性率变化 |
2.2 CX3CL1基因最佳RNAi靶点的确定
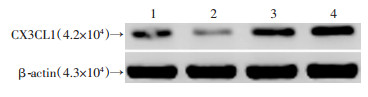
Western blot检测结果显示,3个小干扰RNA都能使bMSCs的CX3CL1的表达下调,下调程度:靶位2>靶位1>靶位3(图 3)。可见最佳RNA干扰序列为CTCTATGAGC AATTATTTA (靶位2)。
|
| 1:靶位1;2:靶位2;3:靶位3;4:对照 图 3 Western blot检测小干扰RNA对bMSCs的CX3CL1蛋白表达的影响 |
2.3 慢病毒载体CD513B-1/CX3CL1 shRNA的测序鉴定
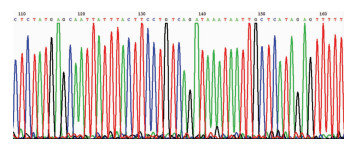
重组慢病毒载体CD513B-1/CX3CL1 shRNA经测序证实(图 4),携带CX3CL1 shRNA的重组慢病毒载体CD513B-1/CX3CL1 shRNA被成功构建。
|
| 图 4 重组慢病毒载体CD513B-1/CX3CL1 shRNA的测序鉴定结果 |
2.4 CX3CL1 shRNA重组病毒的包装和滴度测定
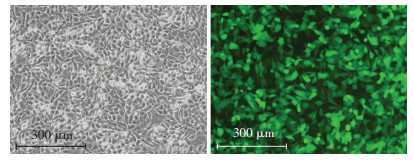
把经测序鉴定的CX3CL1 shRNA重组病毒的DNA导入293T细胞(图 5A),48 h后在显微镜下可见GFP的显著表达(图 5B)。倍比稀释法检测显示,其病毒滴度约为1.4×108 TU/mL。
|
| A:正常293T细胞;B:包装有重组慢病毒CD513B-1/CX3CL1 shRNA的293T细胞 图 5 荧光倒置显微镜观察包装有重组慢病毒CD513B-1/CX3CL1 shRNA的293T细胞中GFP表达 |
2.5 bMSCs的CD513B-1/CX3CL1 shRNA病毒感染
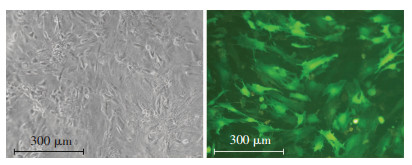
未经感染的bMSCs不表达GFP (图 6A),经CD513B-1/CX3CL1 shRNA病毒感染的bMSCs,倒置荧光显微镜下可见GFP的明显表达(图 6B)。
|
| A:未感染的bMSCs;B:经重组病毒CX3CL1 shRNA感染的bMSCs 图 6 荧光倒置显微镜观察经CX3CL1 shRNA病毒感染的bMSCs中GFP表达 |
2.6 沉默CX3CL1对bMSCs生长的影响
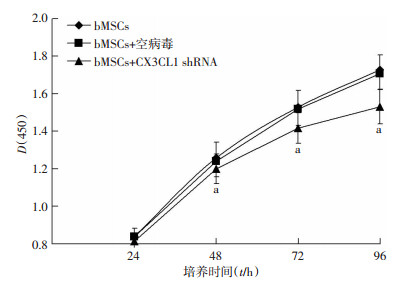
CCK-8检测结果显示,经重组病毒CD513B-1/CX3CL1 shRNA感染的bMSCs生长慢于经空病毒感染或未经感染的bMSCs,48 h开始表现更加明显(P < 0.01,图 7)。
|
| a:P < 0.01,与各对照组比较 图 7 CCK-8检测重组病毒CX3CL1 shRNA沉默CX3CL1基因对bMSCs生长的影响 |
2.7 沉默CX3CL1对bMSCs的PCNA基因及其蛋白表达的影响
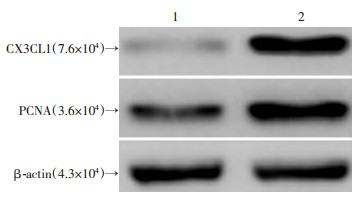
Real-time PCR结果表明,以经病毒CD513B-1/CX3CL1 shRNA感染48 h的细胞总RNA作模板,分别检测结果显示CX3CL1微弱表达,PCNA较弱表达;用空病毒感染48 h的细胞总RNA作模板,均可检测到CX3CL1与PCNA基因的较强表达。Western blot检测结果显示,与空病毒感染的bMSCs相比,病毒CD513B-1/CX3CL1 shRNA感染48 h的细胞,也能检测见CX3CL1的微弱和PCNA较弱表达(图 8)。这些结果提示,重组病毒CD513B-1/CX3CL1 shRNA可较好的使bMSCs的CX3CL1基因及其编码蛋白得以沉默,还可下调bMSCs的PCNA基因及其编码蛋白的表达。
|
| 1:CX3CL1 shRNA病毒感染的bMSCs;2:空病毒感染的bMSCs 图 8 Western blot检测各组bMSCs的CX3CL1与PCNA蛋白表达 |
2.8 沉默CX3CL1对bMSCs周期的影响
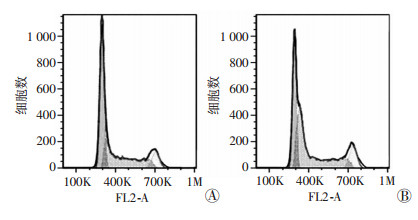
细胞周期的FCM检测结果显示,与正常对照细胞[G1期:(49.31±1.68)%;S期:(38.27±1.17)%,图 9A]比较,沉默CX3CL1的bMSCs,其G1期降低[16.16±0.43)%,S期细胞增加(14.20±0.25)%,图 9B],可见,沉默CX3CL1的bMSCs被阻滞于S期,其差异有统计学意义(P < 0.01)。由此提示,沉默CX3CL1阻抑bMSCs增殖的机制之一可能是将bMSCs阻滞于S期。
|
| A:对照bMSCs;B:沉默CX3CL1的bMSCs 图 9 FCM检测沉默CX3CL1对bMSCs周期的影响 |
2.9 沉默CX3CL1基因的bMSCs趋化效应的Western blot检测
Western blot检测结果显示,和单纯培养的脾巨噬细胞相比,与经病毒感染的bMSCs共培养的脾巨噬细胞(第1实验组)能检测见其趋化因子M-CSF、IL-8的最弱表达(图 10);共培养体系中加入细胞因子CX3CL1时,脾巨噬细胞(第2实验组)的M-CSF、IL-8的表达最强;与空病毒感染的bMSCs共培养的脾巨噬细胞的M-CSF、IL-8的表达次强。此结果提示,bMSCs能分泌CX3CL1在炎症反应的趋化效应中发挥重要作用。
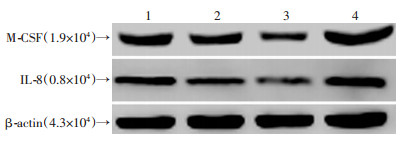
|
| 1:与空病毒感染的bMSCs相同密度共培养的脾巨噬细胞;2:单纯培养的脾巨噬细胞;3:第1实验组;4:第2实验组 图 10 Western blot检测沉默CX3CL1基因的bMSCs趋化效应 |
3 讨论
本研究首先分离、培养大鼠bMSCs并予以其表面标志的FCM检测鉴定,结果证实,所获得的bMSCs具有干细胞的形态与表面标志特性,可用于后续实验。其次构建大鼠CX3CL1基因的shRNA重组慢病毒载体,实现了慢病毒介导shRNA对bMSCs的CX3CL1基因的有效沉默。
趋化因子是结构与功能相关的一类超家族多肽,其分子序列中大多具有4个半胱氨酸残基(C或Cys),根据其N末端保守的2个Cys排列情况,可分成C、CC、CXC及CX3C 4个亚家族。CX3CL1是CX3C的配体,其独特的结构(黏蛋白样杆状)决定了其以膜结合型与游离型方式存在,还具有黏附与趋化活性[11]。在炎症过程中,CX3CL1显著表达于血管内皮细胞表面,促使中性粒细胞的黏附、趋化并跨越内皮细胞,迁徙到作用靶位[11-12],其受体CX3CR1主要在内皮细胞与白细胞表面表达,为一种特异受体(7次跨膜G蛋白偶联受体)[13-14]。CX3CR1是一特殊的黏附分子,其介导细胞黏附无需其他分子参与。CX3CL1作为趋化因子结合CX3CR1参与免疫反应与细胞间信号转导[15]。CX3CL1还与神经系统关系密切,在大脑内广泛分布,但主要集中在神经元。CX3CL1在神经元发育和分化过程中扮演了一定的角色[16]。
缺血性脑卒中是严重危害人类健康和生命安全的常见难治性疾病, 由血栓或栓塞导致血管阻塞引起脑组织缺血、缺氧,脑组织神经元发生不可逆性死亡,同时启动了以局部固有免疫细胞的激活和外源性白细胞的浸润为特征的组织非特异性炎症。炎症主要通过以下几方面介导脑组织损伤:白细胞机械性堵塞微循环通道, 造成“无再流”现象, 缺血区得不到氧和营养物质的供应;大量蛋白水解酶与氧自由基等可经活化的白细胞释放而损伤内皮细胞,破坏血脑屏障,导致脑水肿、脑出血及神经元损伤;白细胞释放的大量炎性介质和细胞因子, 可直接导致脑组织细胞坏死或凋亡。可见,炎症是缺血性脑卒中病理生理过程中的重要因素,贯穿了疾病发展的始终,与患者病情严重程度和预后直接相关。因此,针对炎症反应作用机制的关键环节加以干预,有可能成为治疗缺血性脑卒中新的治疗途径。
MSCs具有自我更新和多向分化的潜能,能在不同的微环境中分化为其环境所需要的细胞,特别是其能横向分化为神经细胞的特性,使其广泛应用于神经系统性疾病的研究[5, 17]。MSCs主要以旁分泌的方式释放可溶性因子影响组织内细胞的功能行为,展现其显著的免疫炎症反应调节与中枢神经系统保护能力[5, 17]。在炎症反应中,MSCs可明显上调小胶质细胞的CX3CR1的表达,而CX3CR1又是CX3CL1的受体[5]。因此,脑缺血时MSCs能否通过分泌CX3CL1,以调控其炎症反应,减轻脑卒中缺血脑组织损伤,促进神经修复,尚不十分清楚。
为了干预缺血性脑卒中的关键环节--炎症反应,我们首先把广泛应用于神经系统性疾病研究的bMSCs与CX3CL1基因(和炎症反应的趋化效应密切相关)相结合,并将沉默CX3CL1基因的bMSCs与巨噬细胞共培养,以探讨CX3CL1基因对bMSCs生长的影响及沉默CX3CL1基因的bMSCs的趋化效应,为bMSCs负载CX3CL1基因调控炎症反应,治疗脑卒中奠定基础。CCK-8检测结果显示,与对照细胞比较,沉默CX3CL1基因的bMSCs的生长明显减慢。细胞的生长、增殖与其核抗原基因PCNA密切相关。PCNA合成并存在于胞核内,有可溶性与不溶性两种类型。不溶性PCNA相当稳定,在细胞周期的G1晚期表达明显增加,其量的变化和DNA合成相一致。PCNA在细胞中的表达检测是反映细胞增殖的良好指标。Real-time PCR、Western blot检测结果表明,沉默CX3CL1基因后,bMSCs的PCNA基因及其编码蛋白的表达明显下调。细胞周期检测显示,沉默CX3CL1的bMSCs其周期被阻滞于S期,其生长、增殖减慢。这些结果提示,沉默CX3CL1的bMSCs,其PCNA表达下调、DNA合成减少、细胞周期被阻是bMSCs生长、增殖受抑的可能机制之一。实验结果还显示,与沉默CX3CL1的bMSCs相比,经空病毒感染或未经感染的bMSCs,其生长、增殖能力明显较强,其细胞周期亦未受抑,且还能上调巨噬细胞的趋化因子M-CSF、IL-8的表达,因此,bMSCs的CX3CL1可能会以自分泌的形式促进其增殖。上述结果提示,bMSCs可能通过分泌CX3CL1基因调控炎症反应在介导脑卒中的损伤组织与神经等的修复过程中发挥重要作用。
我们下一步研究拟将过表达与沉默CX3CL1基因的bMSCs从尾静脉分别注入脑卒中模型大鼠,观察该bMSCs在脑卒中损伤部位的分布、迁移,对损伤部位炎症及损伤神经等的影响,以期探明bMSCs可通过分泌CX3CL1调控脑卒中损伤部位炎症反应,促进其组织与神经等的修复。
| [1] | Liu L, Wang D, Wong K S, et al. Stroke and stroke care in China: huge burden, significant workload, and a national priority[J]. Stroke,2011, 42 (12) : 3651 –3654. DOI:10.1161/STROKEAHA.111.635755 |
| [2] | Shafi N, Levine J M. Emergency management of acute ischemic stroke[J]. Curr Atheroscler Rep,2010, 12 (4) : 230 –235. DOI:10.1007/s11883-010-0116-5 |
| [3] | Mochizuki N, Moriyama Y, Takagi N, et al. Intravenous injection of neural progenitor cells improves cerebral ischemia-induced learning dysfunction[J]. Biol Pharm Bull,2011, 34 (2) : 260 –265. DOI:10.1248/bpb.34.260 |
| [4] | Wang S P, Wang Z H, Peng D Y, et al. Therapeutic effect of mesenchymal stem cells in rats with intracerebral hemorrhage: reduced apoptosis and enhanced neuroprotection[J]. Mol Med Rep,2012, 6 (4) : 848 –854. DOI:10.3892/mmr.2012.997 |
| [5] | Giunti D, Parodi B, Usai C, et al. Mesenchymal stem cells shape microglia effector functions through the release of CX3CL1[J]. Stem Cells,2012, 30 (9) : 2044 –2053. DOI:10.1002/stem.1174 |
| [6] | Xia J 1, Luo M, Ni N, et al. Bone marrow mesenchymal stem cells stimulate proliferation and neuronal differentiation of retinal progenitor cells[J]. PLoS One,2013, 30;8 (9) : e76157 . DOI:10.1371/journal.pone.0076157 |
| [7] | 郝磊, 邹仲敏, 王军平, 等. hPD GF2A /hBD2双基因共表达腺病毒载体的构建及表达[J]. 第三军医大学学报,2007, 29 (10) : 859 –862. DOI:10.3321/j.issn:1000-5404.2007.10.001 |
| [8] | 刘晓丽, 马阳, 梁源, 等. 慢病毒介导shRNA沉默E2-2基因促进内皮前体细胞增殖[J]. 第三军医大学学报,2015, 37 (22) : 2261 –2266. DOI:10.16016/j.1000-5404.201503187 |
| [9] | Xiang Y, Li Q, Huang D, et al. Preparation and antitumor effect of a toxin-linked conjugate targeting vascular endothelial growth factor receptor and urokinase plasminogen activator[J]. Exp Biol Med,2015, 240 (2) : 160 –168. DOI:10.1177/1535370214547154 |
| [10] | Dombrink-Kurtzman M A, Gomez-Flores R, Weber R J. Activation of rat splenic macrophage and lymphocyte functions by fumonisin B1[J]. Immunopharmacology,2000, 49 (3) : 401 –409. DOI:10.1016/S0162-3109(00)00262-9 |
| [11] | Wojdasiewicz P, Poniatowski L A, et al. The chemokine CX3CL1 (fractalkine) and its receptor CX3CR1: occurrence and potential role in osteoarthritis[J]. Arch Immunol Ther Exp (Warsz),2014, 62 (5) : 395 –403. DOI:10.1007/s00005-014-0275-0 |
| [12] | ZuJovic V, Benavides J, Vige X, et al. Fractalkine modulates TNF-alpha secretion and neurotoxicity induced by microglial activation[J]. Glia,2000, 29 (4) : 305 –315. DOI:10.1002/(SICI)1098-1136 |
| [13] | Njerve I U, Pettersen A, Opstad T B, et al. Fractalkine and its receptor (CX3CR1) in patients with stable coronary artery disease and diabetes mellitus[J]. Metab Syndr Relat Disord,2012, 10 (6) : 400 –406. DOI:10.1089/met.2012.0052 |
| [14] | Zanchi C, Zoja C, Morigi M, et al. Fractalkine and CX3CR1 mediate leukocyte capture by endothelium in response to Shiga toxin[J]. J Immunol,2008, 181 (2) : 1460 –1469. DOI:10.4049/jimmunol.181.2.1460 |
| [15] | Bazan J F, Bacon K B, Hardiman G A, et al. A new class of membrane-bound chemokine with a CX3C motif[J]. Nature,1997, 385 (6617) : 640 –644. DOI:10.1038/385640a0 |
| [16] | Goda S, Imai T, Yoshie O, et al. CX3C-chemokine, fractalkine-enhanced adhesion of THP-1 cells to endothelial cells through integrin-dependent and independent mechanisms[J]. Immunol,2000, 164 (8) : 4313 –4320. DOI:10.4049/jimmunol.164.8.4313 |
| [17] | Sheikh A M, Nagai A, Wakabayashi K, et al. Mesenchymal stem cell transplantation modulates neuroinflammation in focal cerebral ischemia: contribution of fractalkine and IL-5[J]. Neurobiol Dis,2011, 41 (3) : 717 –724. DOI:10.1016/j.nbd.2010.12.009 |



