2. 610083成都,成都军区总医院心内科 ;
3. 610083成都,成都军区总医院普通外科
2. Department of Cardiology, General Hospital of Chengdu Military Command, Chengdu, Sichuan Province, 610083, China ;
3. Department of General Surgery, General Hospital of Chengdu Military Command, Chengdu, Sichuan Province, 610083, China
经皮穿刺腔内冠状动脉成形术(percutaneous transluminal coronary angioplasty,PTCA)术后导致的血管再狭窄是限制冠心病介入术远期疗效的重大难题,即使应用药物涂抹支架,再狭窄发生率仍有10%~20%,大量实验表明平滑肌细胞的过度增殖是再狭窄发生的重要机制[1]。由此,如何有效抑制平滑肌细胞的过度增殖成为当下研究的热点。
大黄素(emodin)作为蒽醌类衍生物因其抗肿瘤、抗病毒、抗炎等作用受到广泛重视[2-3],体外实验证明大黄素能够抑制平滑肌细胞的迁移和增殖[4-5]。有学者利用大黄素涂抹支架成功缓解了再狭窄的发生,但具体机制还不清楚[6]。以往的研究表明活性氧/丝裂原活化蛋白激酶/细胞外调节激酶(reactive oxygen species/motigen-activated protein kinase/extracelluar regulated protein kinase,ROS/MAPK/ERK)通路能够调节平滑肌细胞的迁移和增殖,且在大鼠颈动脉狭窄模型中高表达[7-8],但大黄素是否能通过干预ROS/MAPK/ERK通路抑制颈动脉狭窄发生并不清楚。本研究通过建立大鼠颈动脉狭窄模型,观察大黄素干预下颈动脉狭窄的变化。并检测大黄素干预狭窄过程中是否能够调节ROS/MAPK/ERK通路的活化,以及核内因子c-myc及增殖蛋白Ki67表达量变化,探讨大黄素缓解大鼠颈动脉狭窄的分子机制。
1 材料与方法 1.1 实验材料 1.1.1 实验动物及分组72只SD大鼠,体质量为(200±20) g,购自成都达硕生物科技有限公司,实验动物许可证号:SCXK (川)2008-24;雌雄不拘。应用随机数字表法分为假手术组(n=24)、损伤组(n=24)及大黄素+损伤组(n=24)。按实验动物使用的3R原则给予人道的关怀。
1.1.2 实验材料及设备球囊(2.0 mm×12 mm,Baxter,USA);1、5及10 mL一次性使用无菌注射器(36 mm×0.8 mm,山东威高);显微手术器械(弯镊、直镊、剪刀,镇江新天)。
1.2 主要试剂大黄素(Sigma,E7881,USA),DMSO (Sigma,D2650,USA),MEK1/2(Abcam,ab-217/221,UK)、p-MEK1/2(Genetex,GTX50860,USA)、ERK1/2(Proteintech,11257-1-AP,USA),p-ERK1/2(Cell Signaling Technology,CST4695P,USA)。
1.3 大鼠颈动脉狭窄模型建立参照Hua等[9]大鼠颈动脉狭窄模型制作方法,钝性分离暴露左侧颈总动脉,颈外动脉远心端结扎,颈内动脉远心端打活结,动脉夹夹闭颈总动脉近心端。颈外动脉结扎处与颈内、颈外动脉分叉处中间切口,深度为血管横截面1/3到1/2。损伤组及大黄素+损伤组采用球囊(2.0 mm×12 mm)从颈外动脉切口进入颈总动脉近心端,2个大气压扩张球囊,而后缓慢拉回球囊至切口处,来回抽拉3次,结扎切口,打开活结及动脉夹恢复供血;假手术组暴露左侧颈总动脉、夹闭和切口血管与损伤组完全相同,但颈外动脉切口后不作内膜损伤处理(球囊抽拉),直接结扎切口,打开活结恢复供血。术后大黄素+损伤组灌胃大黄素(70 mg/kg);其余两组灌胃等体积溶剂(生理盐水含二甲亚砜)。
1.4 HE染色观察颈动脉形态学变化选取3组大鼠术后14 d术侧颈总动脉,每组6只,生理盐水迅速冲洗血管内血液,放入10%甲醛溶液过夜。每只取6张石蜡切片(4 μm)行常规HE染色,光学显微镜200×(Leica,DM3000,德国)光镜下观察新生内膜变化,Image-Pro Plus (Media Cybernetics, Silver Spring, MD, USA)测量新生内膜、中膜面积。
1.5 免疫组化检测α-SMA、Ki67及c-myc水平将包埋的石蜡块,每组6个,每个取6张石蜡切片(4 μm),常规脱蜡复水,3% H2O2浸泡10 min采用酸修复,PBS洗2次,每次5 min。5% BSA,37 ℃封闭1 h,anti-α-SMA (博士德,BM0002,中国)1:800、anti-c-myc (博士德,BA1284-2,中国)1:100、Ki67(Abcam,ab15580,UK)1:100,4℃孵育过夜,PBS洗2次,每次5 min。采用SABC染色法。生物素偶联羊抗兔IgG二抗1:1 000,37℃孵育30 min,PBS洗2次,每次5 min。辣根过氧化物酶标记的SABC (博士德,SA1020,中国),孵育20 min,PBS洗2次,每次5 min。DAB统一显色10 s,苏木精复染核及中性树胶封片,光学显微镜200×(DM3000,Leica)观察血管α-SMA、Ki67及c-myc分布,Image-Pro Plus测量200×新生内膜面积及α-SMA阳性区域面积,计算阳性面积百分比;Image-Pro Plus测量200×血管总细胞数,并测量Ki67及c-myc阳性细胞个数,计算阳性细胞数百分比。
1.6 免疫荧光检测ROS水平选取3组大鼠术后14 d术侧颈总动脉,每组6只,生理盐水迅速冲洗血管内血液,常规冰冻切片,每只取6张(8 μm) PBS洗2次,每次5 min。2% Triton-X100室温孵育10 min,PBS洗2次,每次5 min。5% BSA 37 ℃封闭30 min,将DHE (碧云天,S0063,中国)终浓度调整为10 μmol/L,37℃孵育60 min。PBS洗3次,每次5 min。荧光显微镜(奥林巴斯,IX81,日本)下波长488 nm激发,Image-Pro Plus采图并计算阳性区域表达比例。
1.7 Westren blot检测MAPK-ERK各因子表达水平选取3组大鼠术后14 d术侧颈总动脉,每组6只,生理盐水迅速冲洗血管内血液,迅速放入液氮中保存,采用凯基蛋白提取试剂盒提取全蛋白(凯基生物,KGP2100,中国)及胞浆胞核蛋白(凯基生物,KGP150,中国),采用BCA法(碧云天,P0006,中国)进行蛋白定量。按12%分离胶,5%浓缩胶;35 mA恒流电泳;200 mA转膜恒流湿转;5%脱脂奶粉(磷酸蛋白用5% BSA)室温封闭120 min;一抗:兔抗鼠MEK1/2、p-MEK1/2、ERK1/2、p-ERK1/2及c-myc (博士德,BA1284-2,中国)室温孵育30 min后4 ℃过夜;二抗(Proteintech,SA00001-2,USA)羊抗兔1:4 000室温孵育1 h;暗室曝光,凝胶成像系统(UVP,EC3300,美国)采集图像并计算各组灰度值。
1.8 统计学处理采用SPSS 19.0统计软件,数据用x±s表示。组间采用独立样本t检验分析,检测水准α=0.05。
2 结果 2.1 大黄素减轻颈动脉狭窄HE染色观察到相对于损伤组[内膜/中膜(1.33±0.03),大黄素(内膜/中膜)(0.76±0.04)有效缓解了颈动脉新生内膜增殖(P<0.01)],3组颈动脉弹性纤维(中膜内深红色条纹)完整。见图 1。
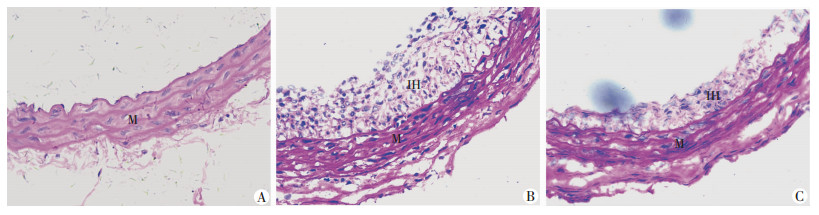
|
| IH:内膜;M:中膜;A:假手术组;B:损伤组;C:大黄素+损伤组 图 1 3组球囊损伤后大鼠颈动脉病理学变化(HE ×200) |
2.2 大黄素减少狭窄新生内膜中平滑肌细胞增生
免疫组化染色标记α-SMA (胞浆棕色区域为阳性表达)。结果显示,损伤后新生内膜主要成分为平滑肌细胞。在新生内膜中,与损伤组。[阳性面积百分比(23.14±0.81)%比较,大黄素(阳性面积百分比)(5.34±0.25)%干预后显著减少了新生内膜中平滑肌细胞的增生(P < 0.01,图 2)]。
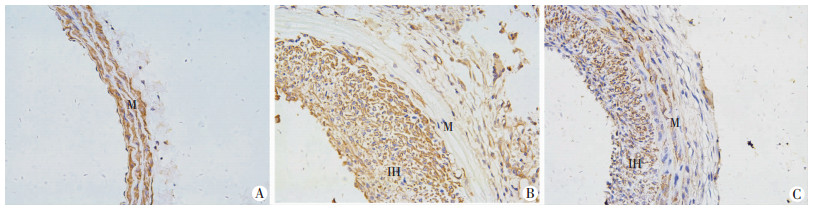
|
| IH:内膜;M:中膜;A:假手术组;B:损伤组;C:大黄素+损伤组 图 2 免疫组化染色检测3组大鼠新生内膜中平滑肌细胞成分比例(SABC ×200) |
2.3 大黄素下调新生内膜中ROS表达
免疫荧光DHE染色标记ROS (红色区域为阳性表达)。结果显示,损伤组较假手术组ROS显著升高(P < 0.01);与损伤组[阳性面积比例:(4.39±0.15)]比较,大黄素[阳性面积比例:(1.72±0.14)显著的下调了ROS表达(P < 0.01)],下调区域主要集中在新生内膜(图 3)。

|
| IH:内膜;M:中膜;A:假手术组;B:损伤组;C:大黄素+损伤组 图 3 免疫荧光检测3组大鼠颈动脉ROS表达含量(×200) |
2.4 大黄素减少增殖蛋白Ki67表达
免疫组化染色标记细胞增殖蛋白Ki67(胞核棕色区域为阳性表达)。结果显示,在新生内膜中,损伤组大量表达Ki67[阳性细胞数百分比:(4.48±0.20)%],大黄素+损伤组[阳性细胞数百分比:(1.37±0.05)%]相对于损伤组能够显著减少Ki67表达(P < 0.01, 图 4)。
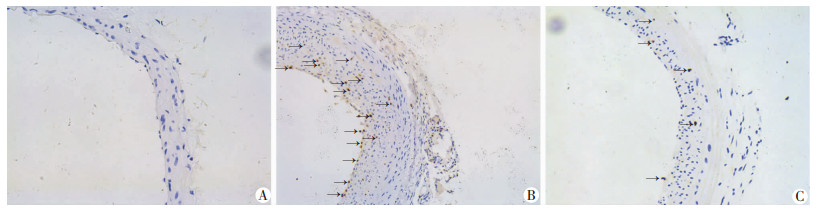
|
| ↑:Ki67阳性表达细胞区域; IH:内膜;M:中膜;A:假手术组;B:损伤组;C:大黄素+损伤组;D:半定量分析结果 图 4 免疫组化检测3组大鼠颈动脉Ki67表达含量(SABC ×200) |
2.5 大黄素阻止MAPK-ERK通路活化
Western blot检测增殖通路MAPK-ERK因子变化。结果显示,与损伤组比较,大黄素降低了p-MEK1/2、p-ERK1/2表达(P < 0.05),而对MEK1/2及ERK1/2的表达量无显著影响(图 5)。

|
| 1:假手术组;2:损伤组;3:大黄素+损伤组;A:Western blot检测结果;B:半定量分析结果a:P < 0.01,与假手术组比较;b:P < 0.01,与大黄素+损伤组及假手术组比较 图 5 Western blot检测3组大鼠颈动脉MAPK/ERK通路各因子变化 |
2.6 大黄素减少核内转录因子c-myc表达
免疫组化(胞核棕色区域为阳性表达)及Western blot检测结果一致:损伤组与假手术组相比,核内大量c-myc活化(P < 0.01);相对于损伤组[阳性细胞数百分比:(16.09±0.53)%],大黄素[阳性细胞数百分比:(6.77±0.23)%]能够显著的减少核内c-myc活化发挥作用(P < 0.01,图 6、7)。
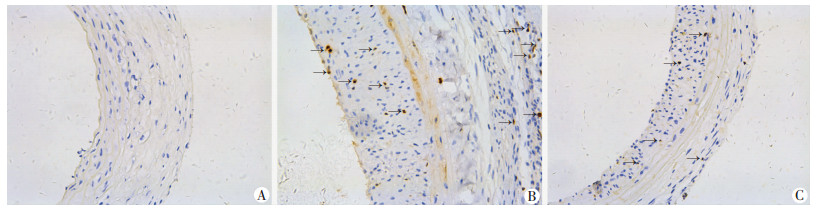
|
| ↑:示c-myc阳性表达区域A:假手术组;B:损伤组;C:大黄素+损伤组 图 6 免疫组化观察3组大鼠颈动脉中核内因子c-myc含量变化(SABC ×200) |
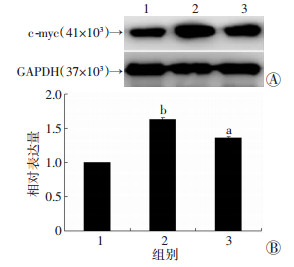
|
| 1:假手术组;2:损伤组;3:大黄素+损伤组;A:Western blot检测结果;B:半定量分析结果a:P < 0.01,与假手术组比较;b:P < 0.01,与大黄素+损伤组及假手术组比较 图 7 Western blot检测3组大鼠颈动脉中核内因子c-myc含量变化] |
3 讨论
PTCA致血管内皮损伤后内膜增生的进程包括内皮损伤、炎性细胞浸润和炎症反应、血管外膜成纤维细胞迁移至内膜,其中平滑肌细胞由中膜迁移至内膜并过度增殖是新生内膜形成的重要部分[10]。因此,寻找一种能有效抑制平滑肌细胞过度增殖的药物损伤致血管内膜增生具有重要意义。
大黄素学名“1, 3, 8-三羟基-6-甲基蒽醌”,分子式为C15H1005。Guo等[11]体外实验结果提示大黄素能够有效地抑制VSMCs的增殖和迁移,但调节的通路还不清楚。体外实验结果显示大黄素抑制VSMCs增殖的过程中能够显著的下调平滑肌细胞ROS表达[12],ROS能够通过激活MAPKs家族(ERK、p38MAPK、JNKs)调节平滑肌细胞增殖、迁移、炎症等功能。本实验验证了大黄素对血管的保护作用,HE及免疫组化染色显示,相对于损伤组,大黄素能够显著的抑制新生内膜中VSMCs的增殖,增殖蛋白Ki67在大黄素+损伤组中显著下调。免疫荧光结果显示,内膜损伤产生大量的ROS,大黄素能显著下调新生内膜中ROS的表达,本研究发现大黄素可能通过下调ROS表达发挥抑制VSMCs增殖的作用。
MAPK/ERK通路与细胞生长、发育、增殖、分化等生理过程密切相关[13]。有学者发现大黄素能够通过MAPK/ERK通路抑制肿瘤细胞的迁移和增殖[14-15],生长因子以磷酸化的形式激活ERK1/2后,形成经典的RAS-RAF-MEK1/2-ERK1/2信号通路,该通路在肿瘤的发生、发展具有重要的作用[16]。但大黄素下调ROS后是否通过介导阻止MAPK/ERK通路活化,抑制过度增殖的VSMCs并不清楚。本研究Western blot检测结果显示:大黄素处理后MAPK-ERK通路中MER1/2及ERK1/2的磷酸化被显著抑制,提示大黄素阻止MAPK-ERK通路活化进而抑制新生内膜中VSMCs的过度增殖,但ERK1/2入核后,引起的核内增殖相关转录因子变化还不清楚。实验利用Western blot检测及免疫组化染色观察到,与损伤组比较,大黄素能够显著阻止核内c-myc的活化。c-myc是多个生理、病理生理(细胞增殖、炎症发生、发展)的核内下游分子,尤其是在氧化应激介导的细胞MAPK/ERK通路调节增殖具有重要的作用[17-18]。结果显示大黄素能够抑制核内因子c-myc表达进而抑制VSMCs增殖。
综上所述,球囊损伤致内膜增殖,成功的建立颈动脉狭窄模型,大黄素能够显著的抑制新生内膜中VSMCs的过度增殖,从而缓解大鼠颈动脉损伤后新生内膜的形成。其机制可能是通过下调ROS表达,下调增殖通路MAPK-ERK活化,减少通路下游核内转录因子c-myc表达,同时降低增殖蛋白Ki67表达,缓解了颈动脉狭窄的发生。本研究为扩展大黄素干预颈动脉狭窄作用的认识提供了新的实验依据。
| [1] | Lv L, Liang W, Ye M, et al. Thrombospondin-4 ablation reduces macrophage recruitment in adipose tissue and neointima and suppresses injury-induced restenosis in mice[J]. Atherosclerosis,2016, 247 : 70 –77. DOI:10.1016/j.atherosclerosis.2016.02.005 |
| [2] | Shrimali D, Shanmugam M K, Kumar A P, et al. Targeted abrogation of diverse signal transduction cascades by emodin for the treatment of inflammatory disorders and cancer[J]. Cancer Lett,2013, 341 (2) : 139 –149. DOI:10.1016/j.canlet.2013.08.023 |
| [3] | Lee W, Ku S K, Lee D, et al. Emodin-6-O-β-D-glucoside inhibits high-glucose-induced vascular inflammation[J]. Inflammation,2014, 37 (2) : 306 –313. DOI:10.1007/s10753-013-9741-9 |
| [4] | Wang S, Liu Y, Fan F, et al. Inhibitory effects of emodin on the proliferation of cultured rat vascular smooth muscle cell-induced by angiotensin II[J]. Phytother Res,2008, 22 (2) : 247 –251. DOI:10.1002/ptr.2301 |
| [5] | Heo S K, Yun H J, Park W H, et al. Emodin inhibits TNF-alpha-induced human aortic smooth-muscle cell proliferation via caspase-and mitochondrial-dependent apoptosis[J]. J Cell Biochem,2008, 105 (1) : 70 –80. DOI:10.1002/jcb.21805 |
| [6] | 赵燕超, 龚飞荣, 葛均波, 等. 大黄素洗脱可降解涂层支架的制作及其体内外实验研究[J]. 华东理工大学学报(自然科学版),2008, 34 (2) : 242 –246. |
| [7] | Svineng G, Ravuri C, Rikardsen O, et al. The role of reactive oxygen species in integrin and matrix metalloproteinase expression and function[J]. Connect Tissue Res,2008, 49 (3) : 197 –202. DOI:10.1080/03008200802143166 |
| [8] | Taniyama Y, Griendling K K. Reactive oxygen species in the vasculature: molecular and cellular mechanisms[J]. Hypertension,2003, 42 (6) : 1075 –1081. DOI:10.1161/01.HYP.0000100443.09293.4F |
| [9] | Hua J Y, He Y Z, Xu Y, et al. Emodin prevents intima thickness via Wnt4/Dvl-1/β-catenin signaling pathway mediated by miR-126 in balloon-injured carotid artery rats[J]. Exp Mol Med,2015, 47 : e170 . DOI:10.1038/emm.2015.36 |
| [10] | Bauters C, Meurice T, Hamon M, et al. Mechanisms and prevention of restenosis: from experimental models to clinical practice[J]. Cardiovasc Res,1996, 31 (6) : 835 –846. DOI:10.1016/s0008-6363(96)00038-7 |
| [11] | Guo D, Xu C, Chen Y. A study on the effect of emodin on smooth muscle cell proliferation[J]. Zhonghua Nei Ke Za Zhi,1996, 35 (3) : 157 –159. |
| [12] | 李志刚, 王章阳, 刘松青. 大黄素对家兔离体主动脉平滑肌细胞增殖影响的可能途径[J]. 中国临床康复,2005, 9 (26) : 134 –135. |
| [13] | Ye X, Hemida M G, Qiu Y, et al. MiR-126 promotes coxsackievirus replication by mediating cross-talk of ERK1/2 and Wnt/β-catenin signal pathways[J]. Cell Mol Life Sci,2013, 70 (23) : 4631 –4644. DOI:10.1007/s00018-013-1411-4 |
| [14] | Chambard J C, Lefloch R, Pouysségur J, et al. ERK implication in cell cycle regulation[J]. Biochim Biophys Acta,2007, 1773 (8) : 1299 –1310. DOI:10.1016/j.bbamcr.2006.11.010 |
| [15] | Ding D, Li L, Song Y, et al. MAPK-ERK1/2 signaling pathway regulates osteogenic gene expression in rat osteoblasts in vitro[J]. Journal of Southern Medical University,2013, 33 (10) : 1432 –1436. |
| [16] | 夏启松, 刘静维, 孙仁宇, 等. 大黄素对人肺腺癌A549细胞体外增殖凋亡及VEGF和TNF-α分泌的影响[J]. 肿瘤防治研究,2010, 37 (4) : 387 –391. |
| [17] | Johnson G L, Lapadat R. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases[J]. Science,2002, 298 (5600) : 1911 –1912. DOI:10.1126/science.1072682 |
| [18] | Lu J, Luo Q, Cheng P, et al. The role of matrine and mitogen-ativated protein kinase/extracellular signal-regulated kinase signal transduction in the inhibition of the proliferation and migration of human umbilical veins endothelial cells induced by lung cancer cells[J]. Zhongguo Fei Ai Za Zhi,2009, 12 (7) : 747 –752. DOI:10.3779/j.issn.1009-3419.2009.07.002 |



