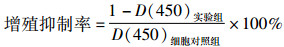2. 400016 重庆,重庆医科大学分子肿瘤及表观遗传学重庆市重点实验室
2. Chongqing Key Laboratory of Molecular Oncology and Epigenetics, Chongqing Medical University, Chongqing, 400016, China
据统计,在全球范围内膀胱癌发病率居全身恶性肿瘤第11位。欧美国家膀胱癌发病率居男性恶性肿瘤第4位,位列前列腺癌、肺癌、结肠癌之后;我国膀胱癌发病率居于泌尿生殖系统恶性肿瘤之首,其患病人数每年均呈上升趋势[1]。吉西他滨(gemcitabine,GEM)是一种抑制DNA合成的脱氧胞嘧啶核苷类似物抗癌药物[2],具有抗脱氧胞嘧啶核苷酸代谢的作用。GEM在脱氧胞嘧啶核苷酸激酶的作用下转化为具有活性的二磷酸及三磷酸核苷,发挥抗肿瘤的作用;并可在DNA聚合酶作用下整合人正在复制的DNA,形成错配,致DNA合成停止,从而抑制肿瘤细胞的生长。GEM还有自我强化的作用,进一步提高细胞内活性复合物浓度[3-4]。因其具有抗瘤谱广、作用机制独特、毒性反应低、与其他化疗药物无交叉耐药且毒性反应无叠加等特点,被广泛应用于非肌层浸润膀胱癌膀胱灌注化疗和肌层浸润性膀胱癌的静脉全身化疗。膀胱癌在组织病理学上以尿路上皮癌最常见,占90%以上, 尿路上皮癌已被证明对吉西他滨、铂类以及紫杉醇类化疗药物敏感[5-6], 因此,吉西他滨在膀胱癌的治疗上占有非常重要的地位。然而化疗耐药却成为影响吉西他滨治疗效果的重要因素。引起化疗耐药的因素很多。已有研究证实自噬(autophagy)是导致化疗耐药的重要机制,而抑制自噬可以增强肿瘤对化疗药物的敏感性[7]。本实验旨在研究吉西他滨在诱导膀胱癌T24细胞凋亡的同时是否引起自噬的产生,并探讨自噬对其所产生的作用,以期为克服化疗耐药提供新的治疗思路。
1 材料与方法 1.1 材料人膀胱癌T24细胞株由重庆医科大学表观遗传与肿瘤实验室赠予;1640培养基购自美国HyClone公司;胎牛血清购自美国Gibco公司;吉西他滨购自江苏豪森药业股份有限公司,用0.9% NaCl注射液溶解,配制成储存液存放于-30 ℃;CCK-8购自北京碧云天生物技术研究所;兔抗人LC3-Ⅱ抗体购自美国Sigma公司;鼠抗人P62抗体、鼠抗人PARP、兔抗人Caspase-3抗体均购自美国BD公司;鼠抗人JNK1抗体、兔抗人P-JNK抗体、兔抗人Bcl-2抗体均购自美国Cell Signaling Technology公司;Actin抗体购自钟鼎生物公司;山羊抗兔、山羊抗鼠二抗购自美国Abgent公司;氯喹(chloroquine,CQ)购自美国Selleck公司;3-甲基腺嘌呤(3-methyladenine,3MA)购自美国Sigma公司;显影发光液购自美国Millipore公司;凝胶成像仪(法国Fusion FX),酶标仪(美国Themo公司),透射电镜(日本Olympus公司),流式细胞仪(美国Becton Dickinson公司)。
1.2 方法 1.2.1 细胞培养人膀胱癌T24细胞用含10%胎牛血清的1640细胞培养基培养,于37 ℃,5% CO2饱和湿度细胞培养箱中常规传代培养。取处于对数生长期的细胞用于实验。
1.2.2 CCK-8检测不同浓度对T24细胞增殖的影响取对数生长期的T24细胞,以5.0×103/孔接种于96孔板中,待细胞贴壁后分别进行不同浓度药物干预(0、0.01、0.1、1.0、10、100 μg/mL),每孔设置5个复空,每孔终体积200 μL,37 ℃孵箱中培养24 h后取出,每孔加入20 μL CCK-8试剂,继续孵育1 h。用酶标仪于450 nm波长条件下测定各孔光密度值[D(450)]。实验重复3次,取均值。计算各组细胞增殖抑制率,并筛选出细胞处理浓度。
1.2.3 流式细胞仪Annexin V/PI双标法测细胞凋亡取对数生长期的人膀胱癌T24细胞,设置空白对照组、吉西他滨(1.0 μg/mL)组、3MA (10 mmol/L)组、3MA (10 mmol/L)+吉西他滨(1.0 μg/mL)组,各组分别经药物处理24 h后,消化、离心(1 000 r/min,5 min)并收集处理后的细胞,按Annexin V-PI凋亡检测试剂盒操作说明进行操作,1 h内上流式细胞仪检测细胞凋亡情况。
1.2.4 透射电镜扫描取对数生长期的人膀胱癌T24细胞,分为对照组、吉西他滨(1.0 μg/mL)组,处理4 h后收集细胞。PBS离心洗涤2次(1 000 r/min,5 min/次),然后将细胞收集于离心管中,加入2.5%戊二醛固定2 h,PBS洗3遍,再用4 ℃预冷的1%锇酸固定1 h,丙酮脱水,树脂包埋,超薄切片(50 nm),经乙酸双氧铀和枸橼酸铅双染色后,透射电镜观察细胞内超微结构并摄像。
1.2.5 Western blot检测分别收集各组细胞,经PBS洗涤,离心(1 000 r/min, 5 min),细胞裂解后提取蛋白。并用BCA检测蛋白浓度,加热变性后每组取等量蛋白(40 μg)进行SDS-PAGE电泳分离,将蛋白转移至PDVF膜上,脱脂奶粉封闭1.5 h后,加入适当稀释浓度的一抗,4 ℃过夜,复温1 h,TBS-T缓冲液洗膜3次,每次10 min,再滴加适当稀释的二抗,结合2 h,TBS-T缓冲液洗膜后显色、曝光。
1.3 统计学方法应用SPSS 19.0统计软件,计量资料用x±s表示,进行单因素方差分析,组间两两比较采用LSD-t检验,检验水准α=0.05。
2 结果 2.1 不同浓度对T24细胞增殖的影响用不同浓度GEM (0、0.01、0.1、1.0、10、100 μg/mL)处理T24细胞24 h,CCK-8法检测细胞增殖抑制率,结果显示随GEM浓度上升,T24细胞增殖抑制率逐渐上升(P < 0.05,图 1),IC50=(1.103 24±0.055 91)μg/mL,选择1.0 μg/mL作为后续实验的处理浓度。

|
| 1:对照组;2~6:0.01、0.1、1.0、10、100 μg/mL吉西他滨处理组;a:P < 0.05,与对照组比较 图 1 CCK-8法检测不同GEM浓度对T24细胞增殖的影响 |
2.2 GEM处理不同时间诱导T24细胞凋亡
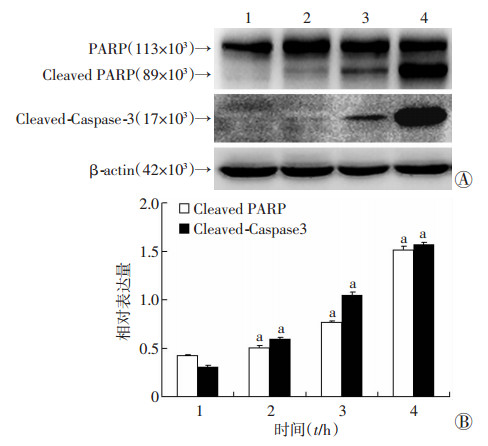
GEM (1.0 μg/mL)处理T24细胞0、12、24、48 h,Western blot结果显示凋亡相关蛋白Caspase-3和PARP随着时间增加活化增强(P < 0.05,图 2),表明GEM可以明显诱导膀胱癌T24细胞凋亡。
|
| A:Western blot检测结果;B:半定量分析结果1:0 h;2:12 h;3:24 h;4:48 h;a:P < 0.05,与0h比较 图 2 Western blot检测GEM处理不同时间诱导T24细胞凋亡情况 |
2.3 GEM诱导T24细胞产生自噬
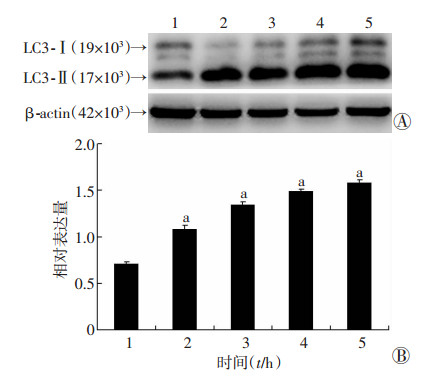
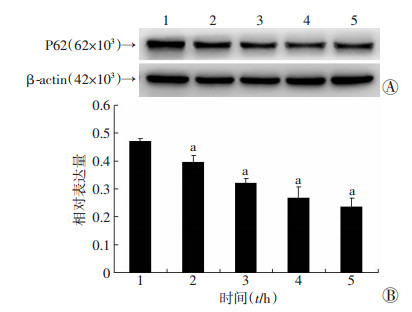
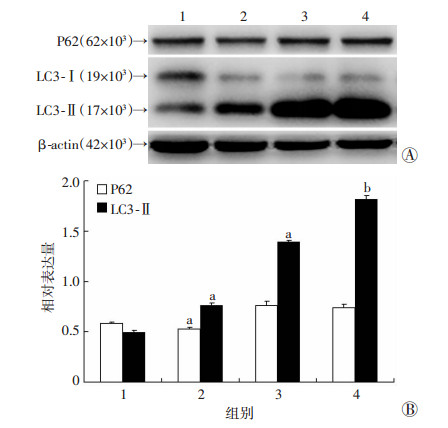
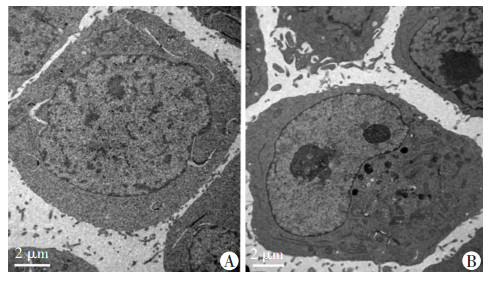
GEM (1.0 μg/mL)处理T24细胞0、1、2、4、8 h,Western blot检测结果显示自噬标志蛋白LC3-Ⅱ随时间增加表达增加(图 3),相同浓度处理T24细胞0、8、16、24、48 h,自噬底物蛋白P62随时间增加降解增加(图 4)。为进一步证实LC3-Ⅱ的表达增强是由自噬发生所诱导,溶酶体抑制剂氯喹(CQ, 20 μmol/L)预处理T24细胞0.5 h后加入GEM (1.0 μg/mL)联合处理4 h后检测自噬潮,结果显示CQ+GEM组LC3-Ⅱ表达量较CQ单药组高,GEM组则较低,表明GEM引起LC3-Ⅱ的表达是由自噬引起的,而非自噬下游通路受阻,LC3-Ⅱ降解障碍所导致(图 5)。通过透射电镜观察,GEM (1.0 μg/mL)处理T24细胞4 h后与对照组相比可出现明显增多的自噬小体(图 6)。提示GEM可以诱导T24细胞发生自噬。
|
| A:Western blot检测结果;B:半定量分析结果1:0 h;2:1 h;3:2 h;4:4 h;5:8 h a:P < 0.05,与0 h比较 图 3 Western blot检测GEM处理不同时间诱导T24细胞LC3-Ⅱ的表达 |
|
| A:Western blot检测结果;B:半定量分析结果1:0 h;2:8 h;3:16 h;4:24 h;5:48 h a:P < 0.05,与0 h比较 图 4 Western blot检测GEM处理不同时间诱导T24细胞P62的表达 |
|
| A:Western blot检测结果;B:半定量分析结果1:对照组;2:GEM处理组;3:CQ处理组;4:CQ+GEM联合处理组a:P < 0.05,与对照组比较;b:P < 0.05,与GEM处理组比较 图 5 Western blot检测GEM联合CQ处理T24细胞引起自噬潮及LC3-Ⅱ、P62的表达 |
|
| A:对照组;B:GEM处理组 图 6 透射电镜观察两组自噬小体变化 |
2.4 JNK信号通路参与调控GEM诱导T24细胞发生自噬
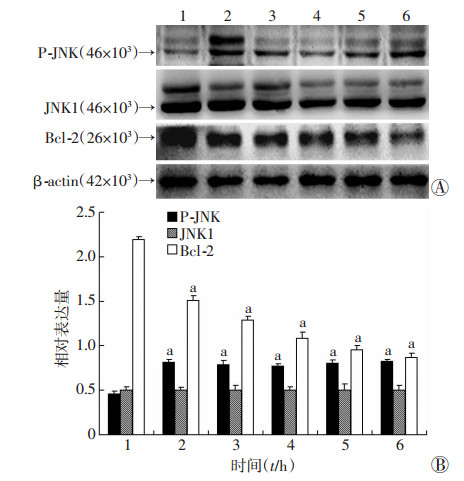
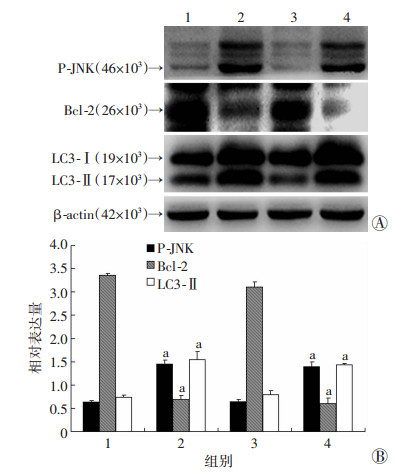
GEM (1.0 μg/mL)处理T24细胞0、0.5、1、2、4、8 h, Western blot检测JNK信号通路相关蛋白JNK1、P-JNK、Bcl-2,结果随时间增加,P-JNK出现活化,Bcl-2逐渐降解(图 7);应用Jnk通路抑制剂SP600125(10 μmol/L)、P38 MAPK信号通路抑制剂SB203580(5 μmol/L)预处理T24细胞0.5 h后加入GEM (1.0 μg/mL)联合处理4 h,Western blot检测P-JNK、Bcl-2及自噬标志蛋白LC3-Ⅱ的表达,结果显示SP600125(SP)+GEM组LC3-Ⅱ表达被抑制,GEM单药组和SB203580(SB)+GEM组LC3-Ⅱ依然出现活化,SP600125(SP)+GEM组P-JNK未表达,Bcl-2未发生降解(图 8),进一步证实JNK信号通路参与调控GEM诱导T24细胞发生自噬。
|
| A:Western blot检测结果;B:半定量分析结果1: 0 h; 2: 0.5 h; 3: 1 h; 4: 2 h; 5: 4 h; 6: 8 h a:P < 0.05,与0 h比较 图 7 Western blot检测GEM作用T24细胞后激活JNK信号通路 |
|
| A:Western blot检测结果;B:半定量分析结果1:对照组;2:GEM组;3:SP+GEM联合处理组;4:SB+GEM联合处理组a:P < 0.05,与对照组比较 图 8 Western blot检测抑制JNK通路后检测自噬表达情况 |
2.5 GEM诱导T24细胞产生保护性自噬
应用自噬抑制剂3MA (10 mmol/L)预处理T24细胞0.5 h后加入GEM (1.0 μg/mL)联合处理4 h后Western blot检测LC3-Ⅱ和P62的表达,结果显示GEM组LC3-Ⅱ表达增加,P62发生降解,3MA组与3MA+GEM组LC3-Ⅱ及P62均未发生明显变化(图 9);相同分组处理24 h后检测凋亡相关蛋白Caspase-3和PARP,结果显示3MA+GEM组Caspase-3与PARP的活化较GEM单药组明显增强(图 10)。上述分组处理T24细胞24 h后流式细胞仪检测凋亡也得到了类似结果,3MA+GEM组凋亡率(38.17±1.43)%较GEM单药组(27.01±1.39)%增高(P < 0.05),对照组(3.78±0.27)%及3MA单药组(4.29±0.92)% T24细胞的凋亡率均处于低水平。这提示抑制GEM诱导的自噬后T24细胞的凋亡水平明显增加,该自噬对T24细胞起保护作用。
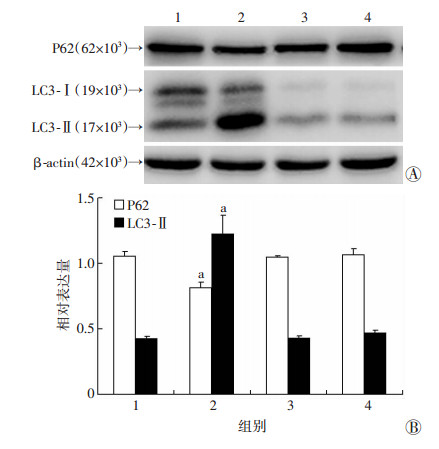
|
| A:Western blot检测结果;B:半定量分析结果1:对照组;2:GEM处理组;3:3MA处理组;4:3MA+GEM联合处理组a:P < 0.05,与对照组及3MA+GEM联合处理组比较 图 9 Western blot检测GEM联合3MA抑制自噬的发生 |
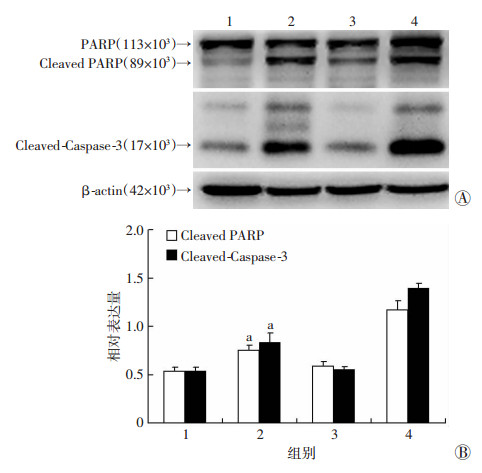
|
| A:Western blot检测结果;B:半定量分析结果1:对照组;2:GEM处理组;3:3MA处理组;4:3MA+GEM联合处理组a:P < 0.05,与对照组及3MA+GEM联合处理组比较 图 10 Western blot检测凋亡相关蛋白表达情况 |
3 讨论
近年来膀胱癌的发病率及病死率已居占我国泌尿外科肿瘤的首位[8-9],化疗在膀胱癌的治疗中占有非常重要的地位。Kilani等[10]研究发现,GEM选择性地对人和鼠的膀胱移行细胞癌细胞株产生细胞毒作用,提示是治疗尿路移行细胞癌的有效药物。GEM作为一种新型脱氧胞嘧啶核苷类似物,目前已被广泛应用于膀胱癌的化疗,特别是对于肌层浸润性膀胱癌,已把GEM列为标准方案的一线化疗用药。然而肿瘤耐药却成为化疗失败的常见原因,如何提高化疗药物的化疗敏感性是近年来的研究热点。自噬又称为Ⅱ型程序性细胞死亡,广泛存在于真核细胞,是以胞质内出现双层膜结构包裹长寿命蛋白和细胞器的自噬体为特征的细胞“自我消化”的一系列生化过程,对细胞的生长发育和调节细胞内环境的稳定起着重要作用[11]。目前普遍认为自噬是一种防御和应激调控机制,当肿瘤细胞受到各种损伤因素作用时,自噬可以成为细胞应激条件下的一种保护反应[12]。自噬与肿瘤的发生和发展具有重要关系, 是当前国际肿瘤研究中的热题。大量研究表明,大多数抗肿瘤药物在诱导肿瘤细胞凋亡的同时也诱导了肿瘤细胞发生自噬[13-14],该自噬可以成为细胞应激条件下的一种保护性反应[15],使细胞维持自身微环境的稳态,从而耐受化疗药物的细胞毒性;而通过使用CQ、3MA、羟基氯喹等自噬抑制剂或者通过沉默自噬相关基因ATG5、ATG6、ATG7、ATG8等手段抑制自噬均能显著提高化疗的敏感性[16-17]。这提示肿瘤细胞发生的保护性自噬可能是肿瘤耐药的重要机制,这也使得自噬成为肿瘤治疗的一个新靶点。
以酶原形式存在于细胞质中的Caspase-3被激活生成活性片段cleaved-Caspase-3,以及多聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)活化被看作是细胞发生凋亡的标志[18]。LC3-Ⅱ是哺乳动物细胞中酵母Atg8的同源物,定位于自噬体膜上,是自噬体的标志分子[19]。P62是一个泛素结合蛋白,由自噬溶酶体降解,与自噬水平呈负相关,同样可用于自噬的检测[20]。在自噬的检测手段中,电镜可以定性的检测细胞自噬发生的一系列超微结构(如隔离膜、自噬泡、自噬溶酶体)变化,被视为检测自噬发生的金标准[21]。C-Jun氨基末端蛋白激酶(C-jun N-terminal protein kinase,JNK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族中的一员,是最常见的Bcl-2激酶并以非环状结构形式在T69,S70及S87多位点调节Bcl-2多位点的磷酸化,导致Bcl-2与Beclin 1的分离,从而调节自噬的发生,是目前研究较多的自噬信号通路之一[22]。当前国内外大多数研究表明自噬在肿瘤的放疗、化疗以及靶向治疗中呈现出保护作用[23-24],是导致肿瘤出现耐药的重要原因。本实验重点探究GEM诱导T24凋亡的同时是否也引起自噬的发生,并探讨该自噬与凋亡之间的关系。
本实验结果显示:用GEM处理膀胱癌T24细胞后,CCK-8检测结果显示T24细胞增殖抑制率与GEM呈浓度相关性,Western blot检测结果显示随着时间增加cleaved-Caspase-3、PARP和LC3-Ⅱ均出现表达量增加,而P62的表达量逐渐下降,表明GEM在诱导T24细胞凋亡的同时也诱导了自噬的发生。透射电镜下观察到的自噬小体以及“自噬潮”的出现也进一步证实GEM诱导T24发生自噬。参与调控自噬发生的机制复杂,是目前的研究热点。文献[22]报道细胞在饥饿状态下可通过激活JNK信号通路而诱导自噬的发生, 为了探究JNK信号通路是否参与GEM诱导T24所发生的自噬,Western blot检测结果显示JNK信号通路相关蛋白被激活,提示JNK信号通路可能参与GEM诱导T24产生的自噬,使用JNK通路抑制剂SP600125抑制JNK信号通路后LC3-Ⅱ的表达受到抑制,进一步证实GEM诱导T24细胞产生的自噬受JNK信号通路的调控。为了探讨GEM诱导的自噬与凋亡的关系,本实验应用自噬抑制剂3MA抑制自噬后通过Western blot检测凋亡标志蛋白及流式细胞术检测凋亡,结果显示抑制自噬后T24发生的凋亡率较GEM单药组高,表明GEM诱导的自噬对T24起保护作用。
综上所述,GEM在诱导人膀胱癌T24细胞凋亡的同时还诱导产生自噬,该自噬对T24细胞起保护作用,JNK信号通路参与调控其自噬的发生,抑制其自噬后可以增强T24对GEM化疗敏感性即凋亡增加。本实验的开展对增强GEM抗肿瘤疗效有一定的参考价值。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin,2014, 64 (1) : 9 –29. DOI:10.3322/caac.21208 |
| [2] | Reddy L H, Couvreur P. Novel approaches to deliver gemcitabine to cauces[J]. Curr Pharm Des,2008, 14 (11) : 1124 –1137. DOI:10.2174/138161208784246216 |
| [3] | Paola E D, Alonso S, Giuliani R, et al. An open-label, dose-finding study of the combination of satraplatin andgemcitabine in patients with advanced solid tumors[J]. Front Oncol,2012, 2 : 175 . DOI:10.3389/fonc.2012.00175 |
| [4] | Zhang J, Wang Z, Hu X, et al. Cisplatin and gemcitabine as the first line therapy in metastatic triple negative breast cancer[J]. Int J Cancer,2015, 136 (1) : 204 –211. DOI:10.1002/ijc.28966 |
| [5] | 顾方六.尿路上皮肿瘤的诊断和治疗//吴阶平主编.吴阶平泌尿外科学.济南:山东科学技术出版社, 2004: 959-980. |
| [6] | 叶定伟, 戴波, 方银忠, 等. 吉西他滨联合顺铂方案治疗晚期尿路上皮移行细胞癌18例报告[J]. 中华泌尿外科杂志,2005, 26 : 331 –333. DOI:10.3760/j:issn:1000-6702.2005.05.014 |
| [7] | Sui X, Chen R, Wang Z, et al. Autophagy and chemotherapy resistance: a promising therapeutic target for cancer treatment[J]. Cell Death Dis,2013, 4 : e828 . DOI:10.1038/cddis.2013.350 |
| [8] | 温登瑰, 单保恩, 张思维, 等. 2003-2007年中国肿瘤登记地区膀胱癌的发病与死亡分析[J]. 肿瘤,2012, 32 (4) : 256 –262. DOI:10.3781/j.issn.1109-0721.2012.04.006 |
| [9] | 那彦群, 叶章群. 中国泌尿外科疾病诊断治疗指南手册[M]. 北京: 人民卫生出版社, 2014 . |
| [10] | Kilani R T, Tamimi Y, Karmali S, et al. Selective cytotoxicity of gemcitabine in bladder cancer cell lines[J]. Anticancer Drugs,2002, 13 (6) : 557 –566. DOI:10.1097/00001813-200207000-00002 |
| [11] | Klionsky D J. Autophagy revisited: a conversation with Christian de Duve[J]. Autophagy,2008, 4 (6) : 740 –743. DOI:10.4161/auto.6398 |
| [12] | Mizushima N, Levine B, Cuervo A M, et al. Autophagy fights disease through cellular self-digestion[J]. Nature,2008, 451 (7182) : 1069 –1075. DOI:10.1038/nature06639 |
| [13] | Kaminskyy V O, Zhivotovsky B. Free radicals in cross talk between autophagy and apoptosis[J]. Antioxid Redox Signal,2014, 21 (1) : 86 –102. DOI:10.1089/ars.2013.5746 |
| [14] | Mani J, Vallo S, Rakel S, et al. Chemoresistance is associated with increased cytoprotective autophagy and diminished apoptosis in bladder cancer cells treated with the BH3 mimetic (-)-Gossypol (AT-101)[J]. BMC Cancer,2015, 15 : 224 . DOI:10.1186/s12885-015-1239-4 |
| [15] | 吴亚冉, 倪振洪, 闫小晶, 等. 盐酸吡柔比星通过上调ATG4B增强HeLa细胞保护性自噬[J]. 第三军医大学学报,2016, 38 (2) : 129 –135. DOI:10.16016/j.1000-5405.201506001 |
| [16] | Liang B, Liu X, Liu Y, et al. Inhibition of autophagy sensitizes MDR-phenotype ovarian cancer SKVCR cells to chemotherapy[J]. Biomedecine & pharmacotherapie,2016, 82 : 98 –105. DOI:10.1016/j.biopha.2016.04.054 |
| [17] | He W, Wang Q, Xu J, et al. Attenuation of TNFSF10/TRAIL-induced apoptosis by an autophagic survival pathway involving TRAF2-and RIPK1/RIP1-mediated MAPK8/JNK Activation[J]. Autophagy,2012, 8 (12) : 1811 –1821. DOI:10.4161/auto.22145 |
| [18] | Napso T, Fares F. Zebularine induces prolonged apoptosis effects via the caspase-3/PARP pathway in head and neck cancer cells[J]. Int J Oncol,2014, 44 (6) : 1971 –1979. DOI:10.3892/ijo.2014.2386 |
| [19] | Holt S V, Wyspianska B, Randall K J, et al. The development of an immunohistochemical method to detect the autophagy-associated protein LC3-Ⅱ in human tumor xenogrufts[J]. Toxicol Pathol,2011, 39 (3) : 516 –523. DOI:10.1177/0192623310396903 |
| [20] | Katsuragi Y, Ichimura Y, Komatsu M. p62/SQSTM1 functions as a signaling hub and an autophagy adaptor[J]. FEBS J,2015, 282 (24) : 4672 –4678. DOI:10.1111/febs.13540 |
| [21] | 郝刚, 孙天胜, 李绍光. 哺乳动物自噬检测技术的研究进展[J]. 中华临床医师杂志(电子版),2012, 6 (6) : 1531 –1533. DOI:10.3877/cma.j.issn.1674-0785.2012.06.041 |
| [22] | Wei Y, Pattingre S, Sinha S, et al. JNK1-mediated phosphorylation of Bcl-2 regulates starvation-inducedautophagy[J]. Mol Cell,2008, 30 (6) : 678 –688. DOI:10.1016/j.molcel.2008.06.001 |
| [23] | 彭文颖, 杨宇. 保护性自噬介导肿瘤细胞对化疗耐药研究进展[J]. 医学临床研究,2015, 32 (12) : 2407 –2411. DOI:10.3969/j.issn.1671-7171.2015.12.037 |
| [24] | 秦利燕, 王滨, 倪振洪, 等. 索拉非尼诱导肝癌HepG2细胞自噬的机制及意义[J]. 第三军医大学学报,2013, 35 (22) : 2435 –2438. DOI:10.16016/j.1000-5404.2013.22.025 |