2. 063000 河北 唐山,华北理工大学基础医学院病理学教研室
2. Department of Pathology, College of Basic Medicine, North China University of Science and Technology, Tangshan, Hebei Province, 063000, China
破骨细胞(osteoclast)在牙周炎、骨质疏松、骨肿瘤等许多疾病的骨破坏中发挥着关键作用[1-2]。Ca2+/calmodulin/NFATc1信号通路对破骨细胞分化至关重要,而钙离子/钙调蛋白依赖性蛋白激酶Ⅱ(Ca2+/Calmodulin dependent kinase Ⅱ,CaMKⅡ)是其中Ca2+信号传递的关键分子[3-5]。活化T细胞核因子蛋白c1(nuclear factor of activated T cells type c1,NFATc1)作为破骨细胞重要调节因子,参与许多破骨细胞特异性基因(如cathepsin K、TRAP、integrinβ3、c-Src)表达的调控。国外学者研究表明,在CaMKⅡα、β、γ、δ 4个异构体中,异构体δ在破骨细胞分化中表达最高[6],提示其在破骨细胞分化中可能扮演关键角色,但其发挥的作用及可能的分子机制目前尚不清楚。本研究通过对CaMKⅡδ进行RNA干扰,探索其对下游相关基因表达及破骨细胞分化的影响,以证实CaMKⅡδ在破骨细胞分化中的关键作用,揭示破骨细胞分化的分子调控机制,为骨过度吸收性疾病的治疗提供实验依据。
1 材料与方法 1.1 实验材料核因子-κB受体激活因子配体(receptor activatior of nuclear factor kappa B ligand, RANKL),美国Biovision公司;小鼠RAW264.7细胞株,北京军事医学科学院;α-MEM培养基,中国四季青公司;兔抗鼠CaMKⅡδ、NFATc1、TRAP、c-Src多克隆抗体及β-actin单克隆抗,美国Santa Cruz公司;抗酒石酸酸性磷酸酶(TRAP)染色试剂盒、异硫氰酸荧光素(FITC)、碘化丙啶(PI),美国Sigma公司;PCR引物,上海生工;激光聚焦显微镜(LSCM),日本Olympus公司;PCR扩增仪,美国PERKIN ELMER;Rotor-Gene 3000荧光定量PCR仪,美国Gene company limited。
1.2 CaMKⅡδ干扰载体构建及转染效率测定根据GenBank数据库CaMKⅡδ(NM-00102543 8)基因序列并参考文献[7],确定干扰靶点为5′-TTCTGGAGAAAGATACCCAGGTGTG-3′;将合成的干扰序列与慢病毒载体pGCSIL-GFP (green fluorescent protein)连接形成重组干扰载体,并与辅助载体pHelper 2.0共转染293T细胞进行包装;提取重组病毒液,-80 ℃储存备用。以上实验操作由上海吉凯基因公司完成。
应用包装好的重组病毒在感染复数(multiplicity of infection,MOI)值分别为1、10、30、50下转染小鼠RAW264.7细胞。转染12 h后更换新鲜培养基,转染5 d后激光共聚焦显微镜(LSCM)下观察;确定转染效率高、细胞状态好的最佳MOI值;并根据如下公式确定转染效率:GFP阳性细胞数/所测细胞总数×100%。
1.3 实验分组RAW264.7细胞分为3组:对照组、空白载体组和干扰组。细胞接种24 h后分别应用空白载体及干扰载体进行转染,12 h后更换含50 μg/L RANKL的α-MEM培养基,继续培养5d后收获细胞,进行相关检测。
1.4 干扰效率测定 1.4.1 Real-time PCR检测TRIzol提取细胞总RNA,逆转录合成cDNA;在Rotor-Gene3000荧光定量PCR仪上进行变性、退火、延伸;引物序列:CaMKⅡδ(409 bp),正义链5′-CAGTGGAGCTGTCTGTCGTT-3′,反义链5′-GCAGACTACCACGCAACTCA-3′;β-actin (186 bp),正义链5′-GTTG GAGCAAACATCCCCCA-3′,反义链5′-CGCGA CCATCCTCCTCTTAG-3′。反应条件:95 ℃ 30 s;95 ℃ 15 s,55 ℃ 20 s,72 ℃ 20 s,40 cylces。分析软件Rotor-Gene处理后得数据,计算目的基因mRNA相对表达量,每组设3个复孔,实验重复3次。
1.4.2 Western blot检测提取细胞总蛋白,测定蛋白浓度,加入上样缓冲液后,煮沸变性,蛋白上样后,凝胶电泳,转膜,室温封闭1 h,一抗4℃过夜,二抗37℃孵育2 h,ECL显色仪上显色1 min。用Image-Pro Plus分析软件检测膜上条带光密度值;每组设3个复孔,实验重复3次。
1.5 CaMKⅡδ RNA干扰对NFATc1、TRAP、c-Src基因表达的影响 1.5.1 免疫荧光化学检测按2×104个/cm2密度接种细胞爬片,再分组处理(同实验1.3)。细胞收获后,4%多聚甲醛固定,0.4%的Triton X-100 PBS室温孵育15 min,多克隆抗体一抗4 ℃过夜,异硫氰酸荧光素(FITC)标记的羊抗兔IgG为二抗,37 ℃避光孵育90 min,碘化丙啶(PI)复染胞核,甘油封片,激光共聚焦显微镜观察,每组检测3个细胞爬片,实验重复3次。
1.5.2 Real-time PCR检测实验方法同1.4,所用引物见表 1。
| GenBank号 | 基因 | 引物序列(5′→3′) | 产物长度(bp) |
| NM_001164112.1 | NFATc1 | 正义链: CTCACCACAGGGCTCACTATG 反义链: TTCTTCCTCCCGATGTCCGT |
364 |
| NM_006509946.1 | TRAP | 正义链: AGATTTGTGGCTGTGGGCGA 反义链: AAGTCAGCGCCCATCGTCTG |
116 |
| NM_006499067.2 | c-SRc | 正义链: ACTGTCACCTCCCCACAAAG 反义链: GACATTCCACCTTCCTCGTGT |
154 |
| NM_007393.3 | β-actin | 正义链: GTTGGAGCAAACATCCCCCA 反义链: CGCGACCATCCTCCTCTTAG |
186 |
1.5.3 Western blot检测
实验方法同1.4。
1.6 破骨细胞生成及功能检测 1.6.1 TRAP染色按2×104个/cm2密度接种细胞爬片,再分组处理(同实验1.3)。细胞收获后,按照TRAP染色试剂盒说明进行染色。光镜200倍下随机选取6个视野,计数TRAP+多核细胞数目(胞核≥3个),取平均值[8]。每组检测5个细胞爬片。
1.6.2 骨吸收陷窝检测用新鲜离体牙制备厚约0.2mm的牙本质磨片,高温高压灭菌,细胞接种密度为2×104个/cm2,再分组处理(同实验1.3)。细胞收获后,扫描电镜(SEM)观察,500倍下每个磨片上选取6个视野,测量吸收陷窝总数目及总面积[8],取平均值,作为该磨片的吸收陷窝数目及面积。每组检测5个牙本质磨片。
1.7 统计学分析用SPSS 17.0统计软件对数据进行单因素方差分析,计量数据用x±s表示;两组间比较采用LSD法;检验水准设为α=0.05。
2 结果 2.1 转染最佳MOI值及转染效率重组干扰载体转染RAW264.7细胞5d后,当MOI值分别为1、10、30、50时,转染效率分别为5.3%、43.6%、78.0%和89.4%;随着MOI值增加,转染效率逐步增加。MOI值为50时,转染效率虽然最高,但部分细胞出现变形、脱落;故本实验最佳MOI值为30,转染效率为78.0%(P < 0.05)。
2.2 干扰效率测定经Real-time PCR检测,对照组、空白载体组和干扰组CaMKⅡδ mRNA水平分别为(1.094±0.101)、(0.986±0.007)和(0.214±0.004);干扰组较前两组mRNA水平分别下降了80.4%和78.3%;即干扰效率>78%,满足实验要求。
经Western blot检测,3组CaMKⅡδ蛋白条带见图 1。对照组、空白载体组和干扰组CaMKⅡδ蛋白相对水平(与β-actin的比值)分别为1.052、1.016和0.300;干扰组蛋白表达较前两组分别下降了71.5%和70.4%;即蛋白水平干扰效率>70%,进一步印证CaMKⅡδ RNA干扰的有效性。
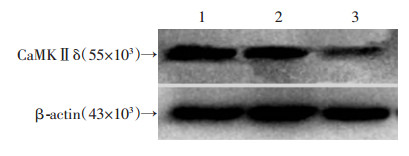
|
| 1:对照组;2:空白载体组;3:干扰组 图 1 Western blot检测3组细胞中CaMKⅡδ蛋白表达 |
2.2 CaMKⅡδ RNA干扰对下游因子NFATc1、TRAP、c-Src基因表达的影响 2.2.1 经免疫荧光细胞化学检测
NFATc1、TRAP、c-Src在对照组和空白载体组中均呈强阳性表达,而在干扰组中表达明显较弱(图 2)。上述结果说明,CaMKⅡδ RNA干扰显著抑制了破骨细胞分化中NFATc1、TRAP、c-Src的蛋白表达。

|
| FITC标记靶蛋白(绿色);PI标记细胞核(红色) 图 2 免疫荧光细胞化学检测NFATc1、TRAP、c-Src在3组破骨细胞中表达(LSCM×400) |
2.2.2 Real-time PCR检测
3组细胞NFATc1、TRAP、c-Src mRNA水平差异有统计学意义(P < 0.01,表 2);其中干扰组NFATc1、TRAP、c-Src基因mRNA水平较对照组分别下降了53.3%、49.1%和54.6%,较空白载体组分别下降了47.8%、43.3%和48.5%。上述结果说明,CaMKⅡδ RNA干扰显著下调了下游因子NFATc1、TRAP、c-Src mRNA水平。
| 组别 | NFATc1 | TRAP | c-Src |
| 对照组 | 1.101±0.104a | 1.097±0.102a | 1.114±0.120a |
| 空白载体组 | 0.985±0.005a | 0.984±0.004a | 0.983±0.004a |
| 干扰组 | 0.514±0.014 | 0.558±0.006 | 0.506±0.003 |
| a:P < 0.01,与干扰组比较 | |||
2.2.3 Western blot检测
3组细胞NFATc1、TRAP、c-Src蛋白条带见图 3A。干扰组NFATc1、TRAP、c-Src蛋白相对水平(与β-actin比值)显著低于前两组(图 3B);较对照组分别下降了61.1%、48.2%和39.6%(P < 0.01),较空载载体组分别下降了61.6%、46.3%、38.3%(P < 0.01);而对照组与空白载体组间则无统计学差异(P>0.05)。上述结果提示,CaMKⅡδ RNA干扰显著下调了破骨细胞分化中NFATc1、TRAP、c-Src的蛋白表达。
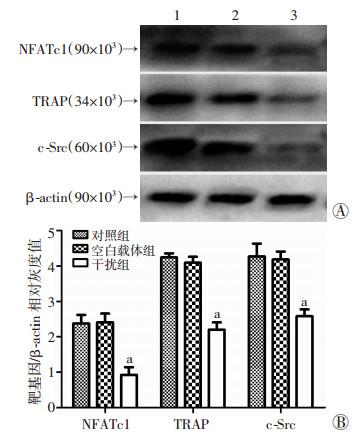
|
| A:Western blot检测结果;B:半定量分析结果1:对照组;2:空白载体组;3:干扰组a:P < 0.01,与对照组、空白载体组比较 图 3 Western blot检测3组细胞NFATc1、TRAP、c-Src蛋白的表达 |
2.3 CaMKⅡδ RNA干扰对破骨细胞分化和骨吸收的影响
经TRAP染色,3组细胞均有TRAP+多核破骨细胞产生(图 4);但干扰组破骨细胞数目较对照组和空白载体组显著减少(P < 0.01,表 3),分别下降了52.8%和49.3%。上述结果提示,CaMKⅡδ RNA干扰显著抑制了破骨细胞分化。
| 组别 | 破骨细胞数 (个) |
吸收陷窝计数 (个) |
吸收陷窝面积 (μm2) |
| 对照组 | 31.3±3.2a | 34.4±4.3a | 10152.8±210.6a |
| 空白载体组 | 28.6±1.5a | 33.4±4.0a | 10112.5±519.4a |
| 干扰组 | 15.7±1.5 | 18.0±4.6 | 3928.4±115.5 |
| a:P < 0.01,与干扰组比较 | |||
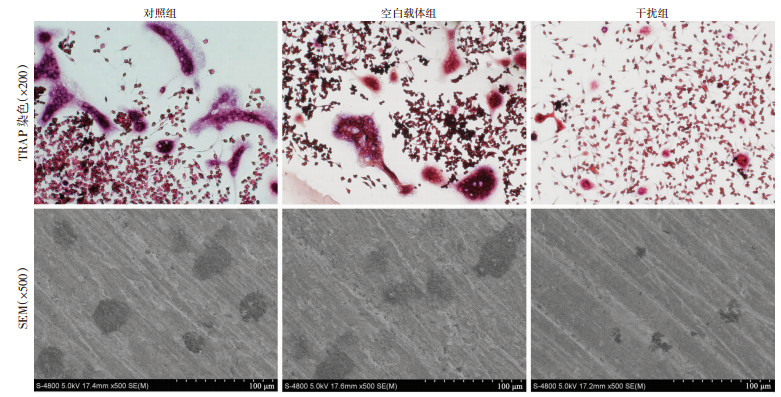
|
| 图 4 3组破骨细胞生成及牙本质吸收陷窝检测结果 |
扫描电镜观察,可见3组细胞均有牙本质吸收陷窝形成(图 4);但干扰组牙本质吸收陷窝数目和面积较对照组和空白载体组显著减少(P < 0.01,表 3),其中吸收陷窝数目分别下降了55.68%和53.3%,吸收陷窝面积分别下降了60.2%和57.7%。上述结果提示,CaMKⅡδ RNA干扰可显著抑制破骨细胞骨吸收功能。
3 讨论破骨细胞生成相关信号通路研究近年来取得了许多进展,其中Ca2+/Calmodulin /NFATc1信号通路的发现是一个重要突破[3-5, 9]。CaMKⅡ是该信号通路中Ca2+信号传递的关键分子。
CaMKⅡ有α、β、γ、δ 4个异构体。国外研究表明,异构体δ在破骨细胞分化中作用可能最为关键。Chang等[7]研究发现,在破骨细胞分化初期,CaMKⅡδ表达上升,其特异性siRNA可显著抑制破骨细胞生成。Yao等[6]研究也发现在4个异构体中,只有CaMKⅡδ在破骨细胞分化中呈高水平表达,且mRNA变化和蛋白相一致。本课题组前期研究也证实,CaMKⅡδ在破骨细胞形成的不同阶段呈时间依赖性持表达增强,其mRNA和蛋白表达趋势一致;因此推断CaMKⅡδ可能在破骨细胞分化信号调控中发挥着重要作用。
研究表明,CaMKⅡ与Ca2+/Calmodulin结合后,获得两个特性[4]:(1)对Calmodulin的亲和力提高1000倍;(2) CaMKⅡ在无Calmodulin时仍具备部分酶的活性。因而,CaMKⅡ在破骨细胞分化过程中可能发挥重要作用。本课题组前期研究发现,唑来膦酸可以时间依赖性抑制破骨细胞内Ca2+震荡(oscillation),并下调CaMKⅡ基因表达及蛋白活性[8];提示CaMKⅡ参与了唑唻膦酸对破骨细胞分化的抑制。
CaMKⅡδ在破骨细胞分化中到底发挥怎样的作用,目前还知之甚少。为此,本实验采用RNA干扰技术,特异性沉默CaMKⅡδ基因,以探讨其对破骨细胞生成的调控作用及涉及的下游信号分子。实验结果显示,CaMKⅡδ RAN干扰可明显抑制破骨细胞生成及骨吸收功能,使破骨细胞生成下降超过了49.8%,骨吸收陷窝数目下降超过了47.6%。上述结果提示,CaMKⅡδ在破骨细胞分化调控中作用极为关键。
NFATc1作为破骨细胞的主要调节基因,参与许多破骨细胞特异性基因表达的调控,包括cathepsin K、TRAP、integrinβ3、c-Src、DC-STAMP (dendritic cell-specific transmembra-ne protein)、Atp6v0d2等,对破骨细胞分化及骨吸收功能至关重要[3-4, 9-10]。NFATc1及上述基因表达异常会导致破骨细胞生成及功能严重障碍[11]。本研究发现,CaMKⅡδ RAN干扰可显著降低破骨细胞分化中NFATc1、TRAP、c-Src蛋白和mRNA水平,从而说明CaMKⅡδ对破骨细胞生成的抑制可能是通过调控NFATc1、TRAP、c-Src基因表达来发挥作用。
然而,CaMKⅡδ是通过下游哪些信号分子来调控NFATc1、TRAP、c-Src基因表达,从而影响破骨细胞生成的,目前尚存在争议。Chang等[7]认为,CaMKⅡ与CaMKⅣ一样[5],是通过cAMP反应元件结合蛋白信号通路来发挥作用;Yao等[6]和Park-Min等[12]一致认为,CaMKⅡ是通过MEK-ERK信号通路来发挥作用。鉴于此,CaMKⅡδ下游信号调控通路,尚待进一步研究探讨。本研究证实,CaMKⅡδ RNA干扰可有效抑制破骨细胞生成,并下调下游分子NFATc1、TRAP、c-Src基因表达;CaMKⅡδ可能通过影响上述基因表达发挥对破骨细胞分化的关键调控作用。
| [1] | Cho Y A, Jue S S, Bae W J, et al. PIN1 inhibition suppresses osteoclast differentiation and inflammatory responses[J]. J Dent Res,2015, 94 (2) : 371 –380. DOI:10.1177/0022034514563335 |
| [2] | Yavropoulou M P, Yovos J G. Osteoclastogenesis-current knowledge and future perspectives[J]. J Musculoskelet Neuronal Interact,2008, 8 (3) : 204 –216. |
| [3] | Negishi-Koga T, Takayanagi H. Ca2+-NFATc1 signaling is an essential axis of osteoclast differentiation[J]. Immunol Rev,2009, 231 (1) : 241 –256. DOI:10.1111/j.1600-065X.2009.00821.x |
| [4] | Zhang L, McKenna M A, Said-Al-Naief N, et al. Osteoclastogenesis: the role of calcium and calmodulin[J]. Crit Rev Eukaryot Gene Expr,2005, 15 (1) : 1 –13. DOI:10.1615/CritRevEukaryotGeneExpr.v15.i1.10 |
| [5] | Sato K, Suematsu A, Nakashima T, et al. Regulation of osteoclast differentiation and function by the CaMK-CREB pathway[J]. Nat Med,2006, 12 (12) : 1410 –1416. DOI:10.1038/nm1515 |
| [6] | Yao C H, Zhang P, Zhang L. Differential protein and mRNA expression of CaMKs during osteoclastogenesis and its functional implications[J]. Biochem Cell Biol,2012, 90 (4) : 532 –539. DOI:10.1139/o2012-002 |
| [7] | Chang E J, Ha J, Huang H, et al. The JNK-dependent CaMK pathway restrains the reversion of committed cells during Osteoclast differentiation[J]. J Cell Sci,2008, 121 (Pt 15) : 2555 –2564. DOI:10.1242/jcs.028217 |
| [8] | 李鹏, 林珏杉, 张鹏, 等. 唑来膦酸对破骨细胞分化中钙调蛋白和钙调蛋白依赖性激酶Ⅱ基因表达的影响[J]. 中华口腔医学杂志,2013, 48 (11) : 694 –698. DOI:10.3760/cma.j.1ssn.1002-0098.2013.11.012 |
| [9] | Seales E C, Micoli K J, McDonald J M. Calmodulin is a critical regulator of osteoclast differentiation, function, and survival[J]. J Cell Biochem,2006, 97 (1) : 45 –55. DOI:10.1002/jcb.20659 |
| [10] | Zhao Q, Wang X, Liu Y, et al. NFATc1: Functions in osteoclasts[J]. Int J Biochem Cell Biol,2010, 42 (5) : 576 –579. DOI:10.1016/j.biocel.2009.12.018 |
| [11] | Takayanagi H, Kim S, Koga T, et al. Induction and activation of the transcription factor NFATc1 (NFAT2) integrate RANKL signaling in terminal differentiation of osteoclasts[J]. Dev Cell,2002, 3 (6) : 889 –901. DOI:10.1016/S1534-5807(02)00369-6 |
| [12] | Park-Min K H, Ji J D, Antoniv T, et al. IL-10 suppresses calcium-mediated costimulation of receptor activator NF-kappa B signaling during human osteoclast differentiation by inhibiting TREM-2 expression[J]. J Immunol,2009, 183 (4) : 2444 –2455. DOI:10.4049/jimmunol.0804165 |



