肝癌是全世界最常见的恶性肿瘤之一,在肿瘤相关性死亡中位居第3位[1]。目前肝癌治疗是以手术为主的综合治疗模式,但很多患者就诊时已失去手术机会,且术后复发率较高。肿瘤细胞的侵袭转移是导致这一结果的重要原因[2]。目前有研究认为,上皮-间质转化(epithelial-mesenchymal transitions,EMT)能促进肝癌的侵袭和转移[3],因此抑制EMT现象成为抑制肿瘤侵袭转移的新途径。维生素D3是一种类固醇类化合物,不仅调节钙磷代谢,而且其具有抑制EMT的作用[4]。EB1089作为一种最新研制的维生素D类似物,在诱导肿瘤细胞凋亡和抑制肿瘤细胞增殖方面有着明显效果[5-6],同时与一些抗肿瘤药物具有协同作用,加强抗肿瘤效果[7],有重要的临床应用前景。本研究旨在探讨EB1089对TGF-β1诱导肝癌细胞SMMC-7721上皮-间质转化现象的影响,进一步寻找抑制肿瘤侵袭转移的新途径。
1 材料与方法 1.1 材料人肝癌细胞株SMMC-7721由重庆医科大学生命科学研究院实验室提供;新鲜胎牛血清、DMEM高糖培养基、青霉素/链霉素溶液均购自美国HyClone公司;兔抗人E-cadherin多克隆抗体和兔抗人N-cadherin多克隆抗体,鼠抗人Vimentin单克隆抗体,辣根过氧化物酶标记的山羊抗兔IgG及山羊抗鼠IgG二抗均购自Immunoway公司;鼠抗人GAPDH单克隆抗体(内参)购自碧云天生物技术研究所;引物由宝生物工程(大连)有限公司合成,反转录试剂盒购自宝生物工程(大连)有限公司;蛋白质印迹及蛋白质提取相关试剂购自碧云天生物技术研究所;EB1089购自Tocris生物公司,TGF-β1购自PeproTech公司。
1.2 方法 1.2.1 细胞培养肝癌细胞SMMC-7721用含10%胎牛血清的DMEM培养液进行培养,用对数生长期的细胞制成单细胞悬液,以1×105个细胞/瓶的密度接种于细胞培养瓶中。当细胞密度为30%~40%时,更换培养液为含1%血清的DMEM培养液继续培养24 h。对照组细胞加入含0.1%乙醇(纯度100%)培养基,目的组细胞分别加入含不同浓度EB1089(1、10、100、1 000 nmol/L)的培养基培养不同时间(6、12、24、48 h),筛选出EB1089作用于肝癌细胞SMMC-7721后上皮标志物E-cadherin表达水平变化显著的浓度和时间。然后将细胞分为4个组,其中3组分别加入含10 ng/mL TGF-β1、1 000 nmol/L EB1089、1 000 nmol/L EB1089+10 ng/mL TGF-β1的5% DMEM培养液,空白对照组加入含0.1%乙醇的5% DMEM培养液,作用48 h。
1.2.2 RT-PCRTRIzol法提取细胞总RNA,按反转录试剂盒提供的实验步骤反转录为cDNA,随后行实时荧光定量PCR检测E-cadherin、N-cadherin、Vimentin的表达。E-cadherin基因上游引物序列为5′-CCAAAGCCTCAGGTCATAAACAT -3′,下游引物序列为5′-TGAGATTGATTTTGTAGTCACCCAC -3′;N-cadherin基因上游引物序列为5′-CCATCAAGCCTGTGGGAATC -3′,下游引物序列为5′-GCCGCTTTAAGGCCCTCAT -3′;Vimentin基因上游引物序列为5′-TCTGGATTCACTCCCTCTGGTT -3′,下游引物序列为5′-ATCGTGATGCTGAGAAGTTTCGT -3′;内参照GAPDH基因的上游引物序列为5′-CTTTGGTATCGTGGAAGGACTC -3′,下游引物序列为5′-GTAGAGGCAGGGATGATGTTCT -3′。扩增条件:第1步95 ℃ 1 min;第2步95 ℃ 10 s、60 ℃ 30 s、65 ℃ 5 s,共39个循环;最后75 ℃延伸7 min。采用CFX96Real-time System软件,定量分析目的基因E-cadherin、N-cadherin、Vimentin及内参照GAPDH的Ct值。采用2-ΔΔCt法计算目的基因的相对表达量并进行统计学分析。实验重复3次。
1.2.3 Western blot不同组细胞处理一定时间后,分别提取各组细胞总蛋白,用BCA法测定蛋白浓度后,各取30 μg蛋白行10% SDS-PAGE分离蛋白,并转移至聚偏二氟乙烯膜上,室温条件下在摇床上用封闭液封闭处理1.5 h,加入兔抗人E-cadherin、N-cadherin多克隆抗体(体积稀释比例为1:1 000)、Vimentin单克隆抗体(体积稀释比例为1:1 000)和内参鼠抗人GAPDH单克隆抗体(体积稀释比例为1:1 000),4 ℃反应过夜,用PBST洗膜3次后,加入二抗[辣根过氧化物酶标记的山羊抗兔IgG或山羊抗鼠IgG(体积稀释比例为1:8000)],37 ℃反应1 h,用PBST洗膜3次后,曝光成像。用Quantity one软件分析E-cadherin、N-cadherin、Vimentin和GAPDH蛋白条带的灰度值,以E-cadherin、N-cadherin、Vimentin蛋白和GAPDH蛋白灰度值的比值表示E-cadherin、N-cadherin、Vimentin蛋白的相对表达量并进行统计分析。实验重复3次。
1.2.4 细胞形态学观察将SMMC-7721细胞分别以1×105/孔接种于6孔板,培养24 h之后更换为含1%血清的DMEM培养液进行饥饿化处理约24 h。再将细胞分为4组并培养48 h (同上)。于图 1每组细胞的形态并拍照,每组拍摄不低于4张照片。实验重复3次。
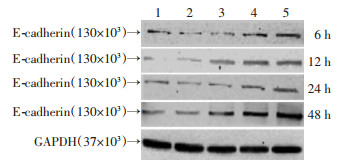
|
| 图 1 Western blot检测不同浓度的EB1089作用于肝癌细胞SMMC-7721不同时间E-cadherin蛋白水平的变化 |
1.2.5 细胞Transwell小室侵袭迁移实验
Transwell小室迁移实验时,将4个不同处理组的SMMC-7721细胞消化离心,并用无血清培养基吹打均匀;将不同组含约1×105个细胞的200μL无血清培养基的细胞悬液分别接种于24孔板中不同小室的上室,小室膜的直径为8.0 μm,下室加入600 μL含10% DMEM的高糖培养基,放入37 ℃、5% CO2的培养箱中继续培养约24 h,将不同组的小室用4%多聚甲醛固定30 min,之后用0.1%结晶紫染色15 min,用双蒸水洗3次,显微镜下成像,随机选5个视野进行拍照。Transwell小室侵袭实验步骤基本同前,但加入细胞悬液前,将基质胶按1:8的比例稀释后加入小室,放入培养箱中48 h。实验重复3次。
1.3 统计学方法应用SPSS 17.0统计软件进行数据统计分析,用GraphPad Prism 5软件制图。实验数据以x±s表示,两独立样本间的比较采用t检验,多组之间比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准为α=0.05。
2 结果 2.1 EB1089作用浓度和时间的筛选1、10、100、1 000 nmol/L EB1089作用于SMMC-7721细胞6、12、24、48 h,同时设置对照组,Western blot检测E-cadherin蛋白表达水平。结果表明当EB1089的浓度为1 000 nmo/L,作用时间为48 h时,SMMC-7721细胞E-cadherin蛋白表达相对于对照组差异最为显著(P < 0.05,P < 0.01, 图 1),故选择EB1089浓度为1 000 nmol/L,作用时间为48 h用于后续实验。
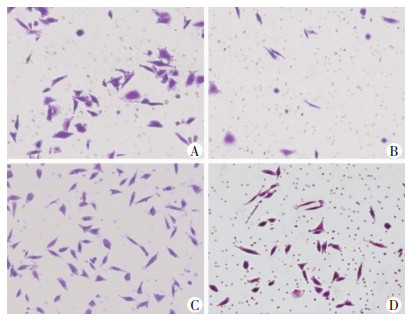
2.2 TGF-β1、EB1089引起SMMC-7721细胞形态的改变TGF-β1组SMMC-7721细胞形态由原来的不规则多边形变为长梭形,并伸出较多触角,与其他3组差别较大。与空白对照组相比,EB1089组SMMC-7721细胞形态变化不明显。与TGF-β1组相比,EB1089+TGFβ1组SMMC-7721细胞长梭形变化不明显,且触角减少(图 2)。
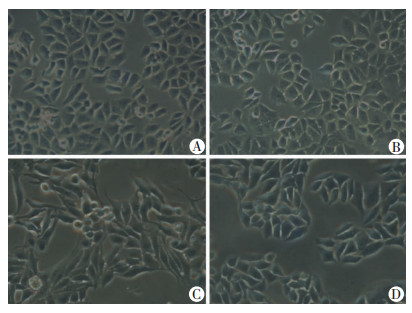
|
| A:对照组;B: EB1089组;C:TGF-β1组;D:EB1089+TGF-β1组 图 2 相差倒置显微镜观察不同处理组肝癌细胞SMMC-7721形态变化(×200) |
2.3 EB1089作用SMMC-7721细胞后相关标志物的mRNA与蛋白表达
Western blot和实时荧光定量PCR实验检测4组细胞。结果显示,与空白对照组相比,TGF-β1诱导48 h后,间质细胞标志物N-cadherin和Vimentin的mRNA和蛋白表达明显增加(P < 0.05),上皮细胞标志物E-cadherin的mRNA和蛋白表达明显降低(P < 0.05);EB1089组E-cadherin的mRNA和蛋白表达增加,N-cadherin和Vimentin的mRNA和蛋白表达下降(P < 0.05,图 3A)。与TGF-β1组相比,EB1089+TGF-β1组N-cadherin和Vimentin的mRNA和蛋白表达明显下降,E-cadherin的mRNA和蛋白表达明显回升(P < 0.05),但与对照组相比,EB1089+TGF-β1组N-caherin和Vimentin的mRNA和蛋白表达增加,E-cadherin的mRNA和蛋白表达明显减少(P < 0.05,图 3B)。
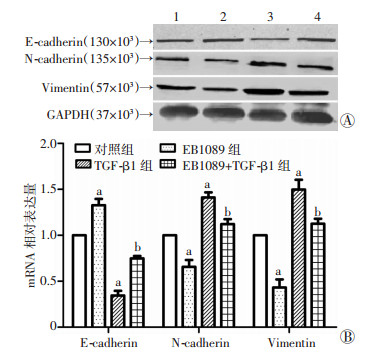
|
| 1:对照组;2: EB1089组;3: TGF-β1组;4: EB1089+TGF-β1组A:Western blot检测结果;B:实时荧光定量PCR检测结果a:P < 0.05, 与对照组比较, b:P < 0.05, 与TGF-β1组比较 图 3 不同处理组E-cadherin、N-cadherin、Vimentin蛋白和mRNA表达情况 |
2.4 EB1089对TGF-β1诱导SMMC-7721细胞侵袭和迁移能力的影响
Transwell小室侵袭、迁移实验检测4组细胞侵袭、迁移能力。结果显示,与空白对照组相比,TGF-β1组SMMC-7721细胞穿膜细胞数明显增加(P < 0.05),而EB1089组穿膜细胞数明显减少(P < 0.05)。与TGF-β1组相比,EB1089+TGF-β1组穿膜细胞数明显减少(P < 0.05, 图 4~7)。
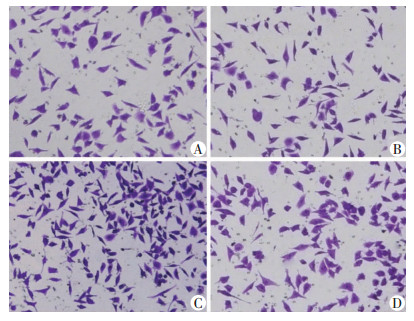
|
| A:对照组;B EB1089组;C: TGF-β1组;D: EB1089+TGF-β1组 图 4 显微镜观察EB1089对SMMC-7721细胞迁移能力的影响(结晶紫×100) |
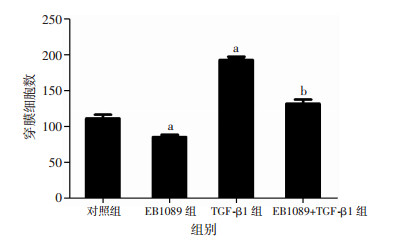
|
| a:P < 0.05,与对照组比较;b:P < 0.05,与TGF-β1组比较 图 5 Transwell检测EB1089对SMMC-7721细胞迁移能力的影响 |
|
| A:对照组;B: EB1089组;C: TGF-β1组;D: EB1089+TGF-β1组 图 6 显微镜观察EB1089对SMMC-7721细胞侵袭能力的影响(结晶紫×100) |
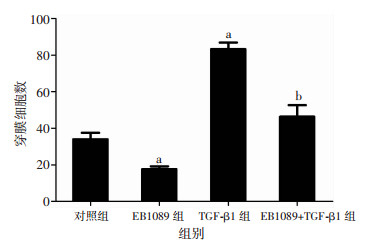
|
| a:P < 0.05,与对照组比较;b:P < 0.05,与TGF-β1组比较 图 7 Transwell检测EB1089对SMMC-7721细胞侵袭能力的影响 |
3 讨论
EMT是在特定的生理和病理情况下,上皮细胞向间充质细胞分化的现象。E-cadherin是上皮细胞的一种标志性蛋白, 在维持组织形态、细胞极性、细胞间连接方面起着关键作用。E-cadherin低表达与肿瘤细胞侵袭性增加和不良预后有关[8]。N-cadherin和Vimentin为间质细胞特征性蛋白,表达上调与上皮性肿瘤细胞转移性增强有关[9-10]。在EMT发生过程中,E-cadherin表达下调、N-cadherin和Vimentin表现为上调趋势。EMT的发生可受环境刺激和众多调节因子的影响,其机制相当复杂。TGF-β1是一个重要促EMT因子,已有研究表明在体外培养的肝癌细胞系、原代肝细胞以及大鼠肝细胞,均能通过TGF-β1诱导出典型的EMT现象[11]。Xu等[12]研究发现,10 ng/mL TGF-β1作用于肝癌细胞48 h时,其诱导EMT效果最佳。本实验中,我们观察到10 ng/mL TGF-β1作用于肝癌细胞SMMC-7721 48h后,细胞形态由不规则多边形向长梭形的“间质样细胞”转变;Real-time PCR和Western blot结果表明在TGF-β1作用下E-cadherin表达下调、N-cadherin和Vimentin表达上调, 这些变化均提示肝癌细胞SMMC-7721发生EMT。
维生素D为固醇类衍生物,维持体内的钙、磷代谢平衡。近年有研究表明,维生素D3能抑制TGF-β1诱导结肠癌细胞的EMT现象,减弱结肠癌细胞的侵袭、迁移能力[13]。同时,维生素D3的类似物MART-10对胰腺癌、乳腺癌细胞EMT现象表现出比维生素D3更强的抑制作用[14-15]。本实验中,我们观察到肝癌细胞SMMC-7721在TGF-β1作用下发生典型的EMT现象。但在加入1000 nmol/L EB1089干预48 h后,细胞形态向“间质样”转变的趋势明显减缓;同时,Real-time PCR和Western blot结果提示上皮细胞标志物E-cadherin蛋白和mRNA表达与TGF-β1组比较明显上调,间质细胞标志物N-cadherin和Vimentin蛋白和mRNA表达则明显下调,表明1 000 nmol/L EB1089对于TGF-β1诱导的肝癌细胞SMMC-7721发生EMT表现出抑制作用。EB1089干预后肝癌细胞SMMC-7721侵袭、迁移能力的明显下降,亦恰好印证了这点。
EB1089能减少机体50%钙代谢,同时,对多种肿瘤表现出生长抑制及促进分化的作用,是一种非常有潜力的抗肿瘤药物。目前相关研究多集中在其对细胞周期的调控、诱导细胞凋亡等方面,而其对肝癌细胞发生EMT的影响,尚少见相关报道。本研究中我们证实了TGF-β1能诱导肝癌细胞SMMC-7721发生EMT现象;同时,发现在EB1089的干预下,TGF-β1诱导肝癌细胞SMMC-7721发生的EMT明显减弱,细胞侵袭、迁移能力也受到明显抑制,其具体机制尚不明确。目前大多观点认为TGF-β通过多种途径诱导肿瘤EMT发生,机制主要是通过Smad依赖通路和非Smad依赖通路完成。相关研究表明维生素D类似物帕立骨化醇通过抑制TGF-β1的Smad信号通路来抑制EMT现象[16]。Debra等[17]的实验发现在慢性移植肾肾病中,维生素D的活性形式1, 25-(OH)2D3能通过下调TGF-β1/Smad的信号通路中Smad2的表达,上调Smad7的表达来减轻TGF-β1引起的纤维化。因此,我们认为在TGF-β1诱导SMMC-7721细胞EMT的Smad信号通路中可能存在EB1089的作用靶点。此外,TGF-β1也可通过丝裂原活化的蛋白激酶(mitogen activated protein kinase, MAPK)途径激活下游的细胞外调节蛋白激酶(extracellular regulated protein kinase, Erk), 从而诱导肿瘤EMT形成。文献[18]报道,维生素D可以下调表皮细胞生长因子受体的表达,通过抑制MAPK达到促进肿瘤细胞分化、凋亡并抑制其生长。EB1089是否也对TGF-β1激活的MAPK途径产生影响,目前尚不明确。Wnt通路也能与TGF-β1/Smad通路作用,上调EMT诱导因子Snail和Twist, 抑制E-cadherin的表达, 同时激活了β-catenin/TCF/LEF复合物, 间接导致Vimentin等间质标志物的表达, 共同协调对肿瘤EMT的调节。EB1089是否通过中间环节调节EMT,目前少见相关报道。同时,调节肝癌细胞SMMC-7721中TGF-β1及其受体的表达,也可能是EB1089影响TGF-β1诱导的EMT现象的一种机制。总之,TGF-β1诱导肝癌细胞SMMC-7721发生EMT是一个复杂的过程,EB1089对该过程的影响也可能存在多种途径,其具体机制有待进一步研究。
| [1] | Forner A, Llovet J M, Bruix J, et al. Hepatocellular carcinoma[J]. Lancet,2012, 379 (9822) : 1245 –1255. DOI:10.1016/S0140-6736(11)61347-0 |
| [2] | Gupta G P, Massague J. Cancer metastasis: building a framework[J]. Cell,2006, 127 (4) : 679 –695. DOI:10.1016/j.cell.2006.11.001 |
| [3] | 吴黎雳, 宦宏波, 温旭东, 等. 迷走神经递质P物质对人类肝癌细胞侵袭转移能力的影响及其分子机制[J]. 第三军医大学学报,2015, 37 (7) : 643 –648. DOI:10.16016/j.1000-5404.201410116 |
| [4] | Fischer K D, Agrawal D K. Vitamin D regulating TGF-β induced epithelial-mesenchymal transition[J]. Respiratory Research,2014, 15 (1) : 146 –157. DOI:10.1186/s12931-014-0146-6 |
| [5] | Wang W, Zhao C H, Zhang N, et al. Vitamin D Analog EB1089 Induces Apoptosis in a Subpopulation of SGC-7901 Gastric Cancer Cells Through a Mitochondrial-Dependent Apoptotic Pathway[J]. Nutrition and Cancer Letters,2013, 65 (7) : 1067 –1075. DOI:10.1080/01635581.2013.811273 |
| [6] | Ghous Z, Akhter J, Morris D L, et al. Inhibition of Hepatocellular Cancer by EB1089: In Vitro and In Vivo Study[J]. Anticancer Res,2008, 28 (6) : 3757 –3761. |
| [7] | Segovia-Mendoza M, Diaz L, Gonzalez-Gonzalez M E. Calcitriol and its analogues enhance the antiproliferative activity of gefitinib in breast cancer cells[J]. J Steroid Biochem Mol Biol,2015, 148 (11) : 122 . DOI:10.1016/j.jsbmb.2014.12.006 |
| [8] | Tsanou E, Peschos D, Batistatou A. The E-cadherin adhesion molecule and colorectal cancer[J]. A global literature approach. Anticancer Res,2008, 28 (6) : 3815 –3826. |
| [9] | Derycke L D, Bracke M E. N-cadherin in the spotlight of cell-cell adhesion, differentiation, embryogenesis, invasion and signalling[J]. Int J Dev Biol,2004, 48 (6) : 463 –476. DOI:10.1387/ijdb.041793ld |
| [10] | Yoon W H, Song I S, Lee B H. Differential regulation of vimentin mRNA by 12-O-tetradecanoylphorb01 13-acetate and all-trans-retinoic acid correlates with motility of Hep 3B human hepatocellular carcinoma cells[J]. Cancer Letters,2004, 203 (1) : 99 –105. DOI:10.1016/j.canlet.2003.08.004 |
| [11] | Yang Y, Pan X, Lei W, et al. Regulation of transforming growth factor-beta 1-induced apoptosis and epithelial-to-mesenchymal transition by protein kinase A and signal transducers and activators of transcription 3[J]. Cancer Res,2006, 66 (3) : 8617 –8624. DOI:10.1158/0008-5472.CAN-06-1308 |
| [12] | Xu Z, Shen M X, Ma D Z, et al. TGF-β1 -promoted epithelial-to-mesenchymal transformation and cell adhesion contribute to TGF-β1 -enhanced cell migration in SMMC-7721 cells[J]. Cell Research,2003, 13 (5) : 343 –350. DOI:10.1038/sj.cr.7290179 |
| [13] | Chen S, Zhu J, Zuo S, et al. 1, 25(OH)2D3 attenuates TGF-β1/β2-induced increased migration and invasion via inhibiting epithelial-mesenchymal transition in colon cancer cells[J]. Biochem Biophys Res Commun,2015, 468 (1) : 130 –135. DOI:10.1016/j.bbrc.2015.10.146 |
| [14] | Chiang K C, Cheh S C, Yeh C N, et al. MART-10, a less calcemic vitamin D analog, is more potent than1, 25-dihydroxyvitamin D3 in inhibiting the metastatic potentialof MCF-7 breast cancer cells in vitro[J]. Journal of Steroid Biochemistry & Molecular Biology,2014, 139 (1) : 54 –60. DOI:10.1016/j.jsbmb.2013.10.005 |
| [15] | Chiang K C, Yeh C N, Hsu J T, et al. The vitamin D analog, MART-10, represses metastasis potential via downregulation of epithelial-mesenchymal transition in pancreatic[J]. Cancer Letters,2014, 345 (2) : 235 . DOI:10.1016/j.canlet.2014.08.019 |
| [16] | Tan X, Li Y, Liu Y. Paricalcitol attenuates renal interstitial fibrosis in obstructive nephropathy[J]. J Am Soc Nephrol,2006, 17 (12) : 3382 –3393. DOI:10.1681/ASN.2006050520 |
| [17] | Hullett D A, Laeseke P F, Malin G, et al. Prevention of chronic allograft nephropathy with vitamin D[J]. Transpl Int,2005, 18 (10) : 1175 –1186. DOI:10.1111/j.1432-2277.2005.00187.x |
| [18] | Deeb K K, Trump D L, Johnson C S. Vitamin D signalling pathways in cancer: potential for anticancer therapeutics[J]. Nat Rev Cancer.England,2007, 7 (9) : 684 –700. DOI:10.1038/nrc2196 |



