口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)是发生在头颈部,临床上较为常见的预后较差的恶性肿瘤,其发生率在口腔癌中占90%。尽管当前治疗手段在不断进步,OSCC患者的5年及10年生存率并未有明显改善,严重影响人类健康。当前研究表明原癌基因和抑癌基因的失调是肿瘤发生、发展的最主要原因[1-2]。磷酸酶及张力蛋白同源基因蛋白(phosphatase and tensin homology deleted on chromosome ten,PTEN)是首个被发现的具有双特异性磷酸酶活性的抑癌基因, 具有调节细胞周期,诱导肿瘤凋亡以及抑制肿瘤细胞生长、侵袭和转移等功能,与OSCC发生、发展关系密切[3-5]。本实验采用Western blot、qRT-PCR和免疫组化分析30例OSCC及30例对应2cm外癌旁组织中PTEN的表达,并结合PTEN与0SCC患者临床病理学特征来初步探讨PTEN作为一种生物标记物在OSCC临床早期诊断和判断预后的潜在可能性。
1 资料与方法 1.1 标本来源和处理收集2015年6月至2016年6月期间重庆医科大学附属口腔医院颌面外科病房和黏膜科明确诊断为口腔鳞状细胞癌并接受外科手术患者的新鲜标本,共计30例,包括男性17例和女性13例,年龄31~85岁,平均62.7岁。所有患者无化疗、放疗史及其他癌症治疗史,知情研究内容及研究目的并签署了知情同意书。根据临床TNM分类(UICC 2010年制定),有淋巴结受累6例,无淋巴结受累24例;肿瘤分期Ⅰ+Ⅱ期9例,Ⅲ+Ⅳ期21例;高分化者19例,中低分化11例。手术中切取癌组织及相应的癌旁组织(距肿瘤组织边缘>2 cm)。所有组织均在术中行冰冻切片证明为癌组织和癌旁组织。切取的组织部分即时放入液氮中瞬时冷冻后存放于-80 ℃中保存备用,部分放于福尔马林中固定,并进行石蜡包埋备用。
1.2 主要材料与试剂一抗(适用于免疫组化、Western blot;艾博抗贸易有限公司,商品号ab154812),二抗(适用于Western blot;南京生兴生物技术有限公司,商品号SN134),β-actin内参(南京钟鼎生物技术有限公司,商品号ABM-0001),ECL化学发光试剂盒(超敏,碧云天生物技术),BSA (碧云天生物技术)。TRIzol (天根生化科技有限公司),逆转录试剂盒(TaKaRa大连宝生物公司)。SYBRGreen发光试剂(TaKaRa大连宝生物公司)。引物由上海生工公司设计合成,PTEN上游引物5′-TTCACATCCTACCCCTTTGC-3′, 下游引物5′-TCTGAGCATTCCCTCCATTC-3′;内参β-actin上游引物:5′-TTCACATCCTACCCCTTTGC-3′,下游引物:5′-TCTGAGCATTCCCTCCATTC-3′。免疫组化试剂盒(通用型S-P-9001,北京中杉金桥生物技术有限公司), 免疫组化DAB显色剂(北京中衫金桥生物技术有限公司)。
1.3 Western blot检测取200 mg组织,液氮研磨后加入400 μL RIPA裂解液及4 μL PMSF,充分混匀震荡后室温放置1 h,12 000 r/min, 4 ℃离心15 min,BCA法测蛋白浓度后进行蛋白定量,按蛋白样本总体积的1/5加入蛋白上样缓冲液,沸水煮5 min使蛋白充分变性,10%的SDS-PAGE胶60V电泳0.5 h,后转为120V电泳1 h,0.45 μm的PVDF膜转膜1.5 h,5% BSA室温封闭2 h,一抗(浓度为1/2 000)4 ℃摇床孵育过夜,PBST洗膜3次,每次10 min,二抗(浓度为1/3 000)室温孵育1.5 h,PBST洗膜3次,每次10 min,PBS洗膜1次, 超敏ECL化学发光显影。
1.4 实时荧光定量PCR检测将样本从-80 ℃冰箱取出后即时用液氮研磨,每40~100 mg样本加入1 mL TRIzol,依照TRIzol试剂说明书提取样本总RNA。使用紫外分光光度计测定RNA浓度及光密度值。使用TaKaRa逆转录试剂盒将RNA逆转录为cDNA。根据SYBRGreenⅠ试剂盒说明书,2 μL的cDNA在20 μL反应体系中作为模板来进行荧光定量PCR反应,每个样本均设置3个反应副孔。
1.5 免疫组化染色观察蜡块在切片机上切片,厚4 μm, 切片均置于60 ℃恒温箱中干燥24 h后于二甲苯中脱蜡,梯度酒精中水化后自来水冲洗5 min。抗原修复:将装有0.01 mol/L枸橼酸盐缓冲液(pH=6.0)的容器置于96 ℃水浴锅中加热,后将组织切片放于加热后的缓冲液中30 min。室温放置冷却后PBS洗涤3次(每次5 min)。3% H2O2滴于切片上来消除过氧化物酶活性,PBS洗涤3次后将组织切片置于湿盒中,5% BSA室温下封闭30 min,甩去多余封闭液,滴加一抗(浓度1/200),37 ℃恒温敷箱内放置1 h, PBS洗涤3次后滴加生物素化二抗工作液,37 ℃恒温敷箱内放置30 min,PBS洗涤3次后滴加辣根酶标记链霉卵白工作液,37 ℃恒温敷箱内放置30 min,PBS洗涤3次后滴加新鲜配制的DAB显色液,流动水下冲洗10 min,苏木精复染5 min后脱水、透明、中性树脂封片。每个切片样本均设置阴性对照组,阴性对照组中使用PBS代替一抗,其余操作步骤一样。
1.6 结果判定PTEN蛋白含量用目的蛋白灰度值与内参β-actin的灰度值之比表示,灰度值分析采用Quantity one软件。
PTEN基因的mRNA表达水平用相对定量计算方法,计算公式如下:△Cq=Cq(PTEN)-Cq(β-actin),△△Cq=△Cq 癌组织的平均值 -△Cq正常组织的平均值,PTEN mRNA的相对表达量用2-△△Cq表示[6]。
石蜡切片置于光学显微镜下成像,随机选取5个高倍镜视野(×400),以细胞内出现淡黄色、棕黄色或者棕褐色颗粒为阳性结果,无着色为阴性结果。
1.7 统计学分析所有数据均用SPSS 20.0进行统计学分析。计量资料用x±s表示, 两配对、两独立样本资料分析采用不同种类t检验,多独立样本资料采用单因素方差分析,双侧P < 0.05为差异具有统计学意义。
2 结果 2.1 Western blot检测PTEN蛋白含量PTEN在30例口腔鳞癌组织和对应癌旁组织中均有不同程度的表达(图 1)。PTEN蛋白在口腔鳞癌组织和癌旁组织的相对表达水平分别为(0.97±0.37)、(1.91±0.72),说明PTEN蛋白在口腔鳞癌组织中的表达明显低于癌旁组织,两组差异具有统计学意义(P < 0.05)。
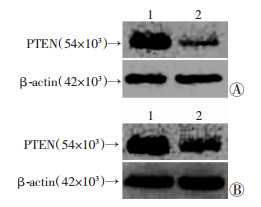
|
| A:有淋巴转移; B:无淋巴转移1:癌旁组织;2:癌组织 图 1 PTEN蛋白在口腔鳞癌组织和癌旁组织中的表达 |
2.2 实时荧光定量PCR检测PTEN mRNA的表达
PTEN mRNA在口腔鳞癌组织和癌旁组织的相对表达水平分别为(0.85±0.25)、(1.48±0.69),PTEN mRNA在癌组织的表达水平明显低于癌旁组织,两组差异具有统计学意义(P < 0.05)。
2.3 免疫组化定性检测PTEN蛋白在细胞内定位与表达免疫组化结果显示,PTEN蛋白阳性表达为细胞浆内棕黄色或棕褐色染色,少数细胞膜和细胞核出现染色。PTEN蛋白在癌旁组织细胞中多显示为棕黄色或棕褐色,呈阳性表达,主要是基底细胞、棘层细胞胞浆中可见染色;在OSCC细胞中多显示为未着色,呈阴性表达(图 2)。
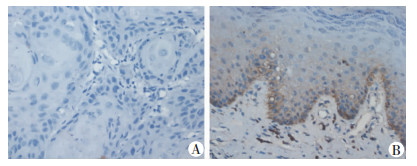
|
| A:PTEN在OSCC组织中阴性表达;B:PTEN在癌旁组织中阳性表达 图 2 免疫组化检测口腔鳞癌、癌旁组织PTEN的表达(S-P×400) |
2.4 PTEN (蛋白、mRNA)表达水平与OSCC患者临床病理特征关系
PTEN (蛋白、mRNA)表达在不同性别(P=0.214、P=0.409)、不同年龄(P=0.193、P=0.445)以及不同发生部位(P=0.905、P=0.662)并未有明显区别。其表达与患者的分化程度(P=0.000、P=0.008)、有无淋巴结受累(P=0.011、P=0.021)以及肿瘤分期(P=0.021、P=0.007)紧密相关。高分化组较中低分化组表达高,无淋巴结受累的较有淋巴结受累的表达高,临床分期Ⅰ+Ⅱ期较Ⅲ+Ⅳ期表达高,差异均有统计学意义(P.05,表 1)。
| 临床参数 | 例数 | 蛋白表达 | P | mRNA表达 | P |
| 性别 | |||||
| 男 | 17 | 1.04±0.39 | 0.214 | 0.98±0.31 | 0.409 |
| 女 | 13 | 0.87±0.35 | 0.83±0.18 | ||
| 年龄 | |||||
| ≥60 | 18 | 0.89±0.35 | 0.193 | 0.86±0.25 | 0.445 |
| <60 | 12 | 1.08±0.40 | 1.00±0.31 | ||
| 部位 | |||||
| 牙龈 | 10 | 0.92±0.34 | 0.905 | 0.88±0.32 | 0.662 |
| 舌 | 7 | 1.05±0.36 | 1.10±0.20 | ||
| 口底 | 8 | 0.96±0.46 | 1.00±0.23 | ||
| 其他 | 5 | 0.94±0.40 | 0.87±0.39 | ||
| 分化程度 | |||||
| 高分化 | 19 | 1.17±0.29 | 0.000 | 1.06±0.21 | 0.008 |
| 中低分化 | 11 | 0.61±0.18 | 0.62±0.17 | ||
| 有无淋巴结受累 | |||||
| 有 | 6 | 0.63±0.26 | 0.011 | 0.59±0.23 | 0.021 |
| 无 | 24 | 1.05±0.35 | 1.09±0.36 | ||
| 分期 | |||||
| Ⅰ+Ⅱ | 21 | 1.09±0.42 | 0.021 | 1.61±0.11 | 0.007 |
| Ⅲ+Ⅳ | 9 | 0.75±0.18 | 1.04±0.18 |
3 讨论
在头颈部肿瘤中约有10%为口腔鳞状细胞癌[1]。抽烟、饮酒、嚼槟榔以及一些感染是导致基因改变从而致使口腔癌症发生的高危因素[7]。研究肿瘤发生的分子机制在提高肿瘤患者的生存率方面至关重要。当前研究发现原癌基因和抑癌基因的失调是肿瘤发生、发展的最主要原因[2]。为了实验的精准性,本实验选取同一患者的OSCC组织与正常组织作为同组对照,因癌症患者口腔黏膜正常组织的获得会增加患者不必要的痛苦,故本实验采用患者OSCC对应2 cm外癌旁正常组织作为对照。
PTEN是首个被发现具有双特异性磷酸酶活性的抑癌基因, 其被称为继p53基因另一个较为广泛地与肿瘤发生密切相关的抑癌基因[5]。Depowski等[8]研究发现PTEN在乳腺癌中缺失率为48%,PTEN的低表达与淋巴结转移、疾病死亡具有相关性。尽管PTEN抑制肿瘤的机制尚未完全清楚,大量研究结果表明PTEN主要通过PI3K-AKT-mTOR经典信号通路发挥其抑癌作用:①PTEN是PI3K-AKT-mTOR通路的负性调节因子,可通过PIP3脱磷酸而阻断PI3K/AKT信号通路,使AKT活性下降。因AKT支配了下游包括凋亡的抑制、肿瘤细胞的增殖以及DNA修复等多个过程,PTEN的表达使AKT介导的提高细胞生存的效应发生逆转而促进细胞凋亡[9-10]。有研究者发现,在乳腺癌中低水平的PIP-3和磷酸化的Akt介导的凋亡和高水平的PTEN基因相关[11]。相反,PTEN表达的缺失会导致Akt活性的增强,以及后续的细胞存活和细胞增生的活跃。② PTEN能通过上调p27从而诱导细胞周期蛋白D1的下调,导致细胞周期阻滞。③ PTEN在细胞外基质的相互作用中也起了重要作用,其通过磷酸化FAK和MAPK来抑制细胞黏附、迁移[12-14]。
本实验结果显示,PTEN染色主要位于黏膜基底细胞层和棘细胞层,蛋白表达多位于细胞浆,少量位于细胞核和细胞膜。PTEN (mRNA和蛋白)表达在鳞癌组织明显低于对应癌旁组织, 表明PTEN可能在口腔鳞癌的发生、发展中起重要作用。PTEN (mRNA和蛋白)的表达水平随着口腔鳞癌组织学分级的降低和临床分期的升高而明显降低,提示在OSCC发生、发展中,PTEN可能对肿瘤细胞增殖及对细胞周期起到一定的抑制作用。无淋巴结受累PTEN (mRNA和蛋白)的表达较有淋巴结受累表达高,表明PTEN表达的减少或缺失可能减弱了对FAK和MAPK等的磷酸化作用,导致细胞的黏附、迁移作用增强,从而引起癌症细胞的恶性增殖,促进了肿瘤的发展。上述这些因素形成了对PTEN和AKT通路其他元素作为潜在的早期诊断和预后指标的基础。Squarize等[15]用免疫组化方法研究PTEN在OSCC中的表达,认为具有高侵袭性的恶性肿瘤不表达PTEN,且PTEN与OSCC的组织学和行为学相关,其可作为OSCC的预后标志物。在临床实践中,早期发现并及时治疗口腔鳞状细胞癌在提高患者生存率及生活质量方面具有重大意义。本实验结果显示,PTEN与OSCC的恶性增殖、侵袭和转移过程密切相关,故在临床工作中检测OSCC患者PTEN的表达水平可能有利于OSCC早期诊断并判断其侵袭转移能力,并对判断患者预后情况具有指导意义。
| [1] | Markopoulos A K. Current aspects on oral squamous cell carcinoma[J]. Open Dent J,2012, 6 (1) : 126 –130. DOI:10.2174/1874210601206010126 |
| [2] | Khan Z, Bisen P S. Oncoapoptotic signaling and deregulated target genes in cancers: special reference to oral cancer[J]. Biochim Biophys Acta,2013, 1836 (1) : 123 –145. DOI:10.1016/j.bbcan.2013.04.002 |
| [3] | Xu Z, Stokoe D, Kane L P, et al. The inducible expression of the tumor supprssor gene PTEN promotes apoptosis and decreases cell size by inhibiting the PI3K/Akt pathway in jurkat T cells[J]. Cell Growth & Diferentiation,2002, 13 (7) : 285 –296. |
| [4] | Hagenbeek T J, Naspetti M, Malergue F, et al. The loss of PTEN allows TCR lineage thymocytes to bypass IL-7 and Pre-TCR-mediated signaling[J]. J Exp Med,,2004, 200 (7) : 883 –894. DOI:10.1084/jem.20040495 |
| [5] | Huang S H, O'Sullivan B. Oral cancer: Current role of radiotherapy and chemotherapy[J]. Med Oral Patol Oral Cir Bucal,2013, 18 (2) : e233 –e240. DOI:10.4317/medoral.18772 |
| [6] | Sartini D, Lo Muzio L, Morganti S, et al. Pokemon proto-oncogene in oral cancer: potential role in the early phase of tumorigenesis[J]. Oral Diseases,2015, 21 (4) : 462 –469. DOI:10.1111/odi.12304 |
| [7] | Lauritano D, Lucchese A, Contaldo M, et al. Oral squamous cell carcinoma: diagnostic markers and prognostic indicators[J]. J Biol Regul Homeost Agents,2016, 30 (2 Suppl 1) : 169 –176. |
| [8] | Depowski P L, Rosenthal S I, ROSS J S. Loss of expression of the PTEN gene protein product is associated with poor outcome in breast cancer[J]. Mod Pathol,2001, 14 (7) : 672 –676. DOI:10.1038/modpathol.3880371 |
| [9] | Leslie N R, Kriplani N, Hermida M A, et al. Hermida, et al. The PTEN protein: cellular localization and post-translational regulation[J]. Biochem Soc Trans, 2016, 44(1): 273-278. DOI: 10.1042/BST20150224 |
| [10] | Chow L M, Baker S J. PTEN function in normal and neoplastic growth[J]. Cancer Lett,2006, 241 (2) : 184 –196. DOI:10.1016/j.canlet.2005.11.042 |
| [11] | Lu Y, Lin Y Z, LaPushin R, et al. The PTEN/MMAC1/TEP tumor suppressor gene decreases cell growth and induces apoptosis and inoikis in breast cancer cells[J]. Oncogene,1999, 18 (50) : 7034 –7045. DOI:10.1038/sj.onc.1203183 |
| [12] | Yamada K M, Araki M. Tumor suppressor PTEN: modulator of cell signaling, growth, migration and apoptosis[J]. J Cell Sci,2001, 114 (13) : 2375 –2382. |
| [13] | Stiles B L. Phosphatase and tensin homologue deleted on chromosome 10: extending its PTENtacles[J]. Int J Biochem Cell Biol,2009, 41 (4) : 757 –761. DOI:10.1016/j.biocel.2008.09.022 |
| [14] | Song M S, Salmena L, Pandolfi P P. The functions and regulation of the PTEN tumour suppressor[J]. Nat Rev Mol Cell Biol,2012, 13 (5) : 283 –296. DOI:10.1038/nrm3330 |
| [15] | Squarize C H, Castilho R M, Santos Pinto D Jr. Immunohistochemical evidence of PTEN in oral squamous cell carcinoma and its correlation with the histological malignancy grading system[J]. J Oral Pathol Med,2002, 31 (7) : 379 –384. DOI:10.1034/j.1600-0714.2002.00142.x |



