神经病理性疼痛是由于外周或中枢神经损伤或功能紊乱引起的慢性疼痛,其发病机制复杂,涉及多个受体、神经递质及信号通路的相互作用,尚缺乏有效的治疗措施[1]。槲皮素是一种多羟基黄酮类化合物,具有抗炎、抗氧化、抗抑郁等作用[2]。近年来,有研究发现槲皮素能有效减轻慢性神经疼痛[3],但其镇痛机制还尚未明确。因此,本研究通过建立坐骨神经慢性缩窄性损伤(chronic constriction injury,CCI)大鼠模型,探究槲皮素对神经病理性疼痛的影响及其可能的机制。
1 材料与方法 1.1 材料SPF级雄性SD大鼠80只(8~10周,体质量180~220 g),由河南省实验动物中心提供。所有动物实验均获得南阳市中心医院动物伦理委员会的批准。槲皮素(Que,纯度(98.5,索莱宝科技,北京)。2390型Electronic von Frey触觉测痛仪,Ⅱ T336型甩尾足底测试仪(ⅡTC,美国);鼠抗iNOS、COX-2、Wnt3a、β-catenin多克隆抗体,β-actin鼠抗单克隆抗体,羊抗鼠二抗(HRP)(Abcam,英国);ELISA试剂盒(TNF-α,IL-1β),BCA试剂盒(碧云天,南京)。
1.2 实验方法 1.2.1 动物模型的建立参照Bennett[4]方法建立CCI模型。将SD大鼠根据体质量从小到大排列按随机数字表分为正常组(control,n=8),假手术组(sham,n=18)和模型组(CCI,n=56)。实验前大鼠适应环境1周,室温22~24℃,保证12 h明暗交替光照,自由饮水摄食。将CCI大鼠腹腔注射4%的水合氯醛(400 mg/kg)麻醉,俯卧位固定,于右侧大腿外侧中下1/3处平行股骨处分离肌肉皮肤,在坐骨神经干近分叉处5 mm,用4-0丝线做4道结扎,间距1~2 mm,以神经微下陷,肢体不抽搐为准。Sham组只分离神经,不结扎。所有动物缝合肌肉皮肤后肌注青霉素4×104 IU以预防感染。分别于术前1 d及术后1、3、7、14、21 d检测大鼠机械缩足反射阈值(mechanical withdrawal threshold, MWT)。术后7dMWT较基础痛阈下降40%以上者视为CCI模型成功,可以进行后续实验。
1.2.2 药物治疗手术后7 d,将SD大鼠分为假手术组(Sham+Veh),假手术+槲皮素组[Sham+Que (50 mg/kg)],CCI组(CCI+Veh),CCI+槲皮素组[CCI+Que (30 mg/kg),CCI+Que (50 mg/kg),CCI+Que (100 mg/kg)],分别灌胃给药,并在给药3、7、14、21、28 d后检测其机械缩足反射阈值和热缩足反射潜伏期(thermal withdrawal latency, TWL)水平。
为了验证Wnt/β-catenin通路的作用,在给药3 d后,CCI组及CCI+Que组大鼠尾静脉注射SB216763(50 μg/kg, 溶于DMSO,Wnt/β-catenin通路激活剂)。各组大鼠于给药后7 d完成行为学测定后断头处死,取术侧L4~L6脊髓组织,立即置于液氮中,后转移至-70 ℃冰箱内保存,用于后续实验。
1.2.3 行为学检测MWT:置大鼠于透明的有机玻璃箱,底部为铁丝网,实验前使之适应15 min,手持压力传感器垂直刺激大鼠后肢足底中部皮肤,匀速而缓慢地增加力度,若大鼠出现缩足、舔足、甩尾等则为阳性反应,记录此时电子显示器上的数值,单位为g,每次间隔5 s,连续10次,左右两后肢足底交替测试,诱发4~6次缩足反应作为50%反应率,其压力值即为阈值。
TWL:置大鼠于底部为厚玻璃板的有机玻璃箱,实验前使之适应15 min,用卤素投光灯照射大鼠后肢足底中部皮肤,记录从照射开始至大鼠出现抬腿、回避,时间即为TWL,每次间隔5 min,左右两侧交替进行,每只测3次,第1次数值波动较大,取后5次的平均值。
1.2.4 ELISA检测炎性因子水平取各组脊髓组织用微量研磨器磨碎制成匀浆液,将匀浆液进行30倍稀释,按ELISA试剂盒说明检测TNF-α和IL-1β的水平。
1.2.5 Western blot检测蛋白表达取各组脊髓组织,提取总蛋白,BCA法测定蛋白浓度,煮沸5 min变性后,进行SDS-PAGE电泳,上样量为80 μg。然后以150 mA 3h转PVDF膜。3%脱脂奶粉封闭抗原1h后,一抗孵育(均为1 :1 000),4 ℃过夜,用TBST洗膜,每次5 min,共3次。加入二抗室温孵育1 h,TBST洗膜,每次5 min,共3次,加入ECL显色液曝光显影。
CCI手术后7 d,将SD大鼠分为假手术组(Sham+ Veh),CCI组(CCI+Veh),槲皮素组[CCI+Que (100 mg/kg)],Wnt激动剂组(CCI+SB216763),槲皮素+Wnt激动剂组(CCI+Que+SB216763),分别灌胃给药,14 d后处死,取术侧L4~L6脊髓组织,按照上述方法检测iNOS、COX-2、β-catenin的蛋白水平。
1.2.6 RT-PCR检测mRNA表达取各组脊髓组织,TRIzol法提取细胞总RNA,并检测其纯度以及完整性。反转录合成cDNA,以cDNA为模板,进行PCR扩增,2%~3%琼脂糖凝胶上电泳,依据2-ΔΔCT法计算各组mRNA的相对表达量。引物由上海生工生物工程公司合成,序列见表 1。
| 基因 | 引物序列 | 产物长度(bp) |
| iNOS | 上游: 5′-CCCTTCCGAAGTTTCTGGCAGCAGC-3′ | 497 |
| 下游: 5′-GGGTGTCAGAGTCTTGTGCCTTTGG-3′ | ||
| COX-2 | 上游: 5′-CTGTATCCCGCCCTGCTGGTG-3′ | 282 |
| 下游: 5′-ACTTGCGTTGATGGTGGCTGTCTT-3′ | ||
| Wnt3a | 上游: 5′-GGCATCTGTGGCTGCAGCAGCCG-3′ | 338 |
| 下游: 5′-CGGTGCTTCTCCACCACCATCTCCG-3′ | ||
| β-catenin | 上游: 5′-GACATGGCCATGGAACCAGAC-3′ | 324 |
| 下游: 5′-GATGAGCAGCATCAAACTGTGTAG-3′ | ||
| β-actin | 上游: 5′-GTGGGGCGCCCCAGGCACCA-3′ | 539 |
| 下游: 5′-CTCCTTAATGTCACGCACGATTTC-3′ |
1.3 统计学分析
计量资料用x±s表示,应用SPSS 17.0统计软件进行统计学分析,多组间比较采用方差分析,各组均数间两两比较采用SNK-q检验,以P < 0.05为差异具有统计学意义。
2 结果 2.1 神经病理性疼痛模型的建立MWT测定结果显示,手术造模以后,随着时间的增长,正常组(Control)与假手术组(Sham)的MWT比较差异无统计学意义。而与Control组相比,模型组(CCI)大鼠的MWT在各个时间点均显著缩短(P < 0.05,图 1),并在术后第7天数值达到平台期,较基础痛阈下降约50%。结果表明手术诱发了大鼠的机械性痛觉超敏,CCI模型成功,可用于后续实验。
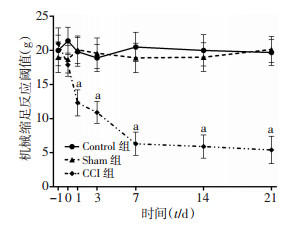
|
| a:P < 0.05,与Control组比较 图 1 CCI手术对大鼠机械缩足反射阈值的影响 |
2.2 槲皮素提高CCI大鼠MWT和TWL值
MWT与TWL结果显示,槲皮素对Sham组小鼠的MWT与TWL并无明显影响。用药后7 d,槲皮素显著提高了CCI大鼠的MWT和TWL值(P < 0.05,表 2),并呈现时间与剂量依赖的效应。结果表明,槲皮素显著提高CCI大鼠的机械痛阈和热痛阈。
| 组别(mg/kg) | 基础值 | 给药后 | ||||
| 3 d | 7 d | 14 d | 21 d | 28 d | ||
| MWT (g) | ||||||
| Sham+Veh | 23.5±1.6 | 22.3±1.8 | 21.9±1.7 | 21.7±1.9 | 22.2±1.5 | 23.3±1.9 |
| Sham+Que (50) | 22.7±1.4 | 23.2±1.6 | 22.2±1.4 | 20.8±2.1 | 23.1±1.6 | 22.0±1.1 |
| CCI+Veh | 10.3±1.4b | 9.8±0.7b | 6.7±0.6b | 5.3±0.8b | 5.2±0.8b | 5.0±0.8b |
| CCI+Que (30) | 11.5±1.0b | 12.7±1.0abc | 13.6±0.8abc | 15.4±0.8abc | 16.8±1.2abc | 18.7±1.2abc |
| CCI+Que (50) | 10.4±1.1b | 13.7±0.8abc | 14.3±0.6abc | 16.0±1.1abc | 17.2±0.9abc | 19.0±1.4abc |
| CCI+Que (100) | 10.4±1.3b | 14.2±1.5abc | 16.4±1.6abc | 17.8±1.4abc | 19.7±1.3abc | 21.2±1.4abc |
| TWL (s) | ||||||
| Sham+Veh | 16.3±1.1 | 17.9±0.7 | 16.7±0.6 | 17.2±0.8 | 16.6±0.8 | 16.9±0.8 |
| Sham+Que (50) | 15.1±1.5 | 16.2±0.8 | 17.1±0.7 | 16.4±0.9 | 15.9±0.9 | 16.8±0.7 |
| CCI+Veh | 7.3±1.1b | 6.9±0.9b | 5.7±0.6b | 5.2±0.8b | 4.6±0.8b | 4.7±0.8b |
| CCI+Que (30) | 7.2±0.5b | 8.6±0.6abc | 9.4±0.5abc | 10.2±0.6abc | 11.7±0.4abc | 12.7±0.7abc |
| CCI+Que (50) | 6.9±0.8b | 8.2±0.5abc | 9.4±0.7abc | 11.2±0.8abc | 12.8±0.5abc | 14.4±0.4abc |
| CCI+Que (100) | 7.3±0.9b | 9.2±0.4abc | 10.9±0.4abc | 12.2±0.9abc | 13.1±0.6abc | 15.4±0.5abc |
| a:P < 0.05, 与基础值比较; b:P < 0.05, 与Sham+Veh组比较; c:P < 0.05, 与CCI+Veh组比较 | ||||||
2.3 槲皮素降低CCI大鼠炎性因子及疼痛相关分子的表达
Western blot与qRT-PCR检测结果显示,用药后7 d,槲皮素显著降低了CCI大鼠脊髓中炎性因子TNF-α和IL-1β的水平,并呈现时间与剂量依赖效应(P < 0.05,图 2A、B)。另外,脊髓中iNOS与COX-2水平在CCI模型中显著升高,而槲皮素则显著降低其水平,并呈现剂量依赖效应(P < 0.05,图 2C~E)。结果表明,槲皮素降低CCI大鼠脊髓炎性因子及疼痛相关分子的表达。
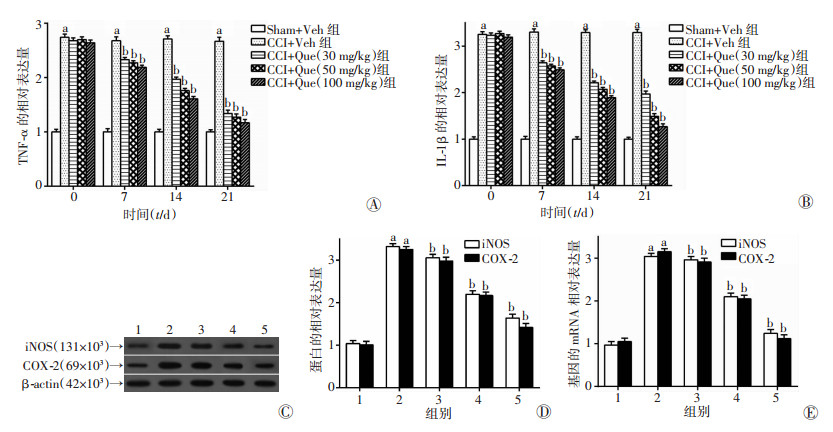
|
| A:TNF-α的相对表达;B:IL-1β的相对表达;C:Western blot检测结果;D:半定量分析结果;E:qRT-PCR检测结果1:Sham+ Veh组;2: CCI+Veh组;3: CCI+Que (30 mg/kg)组;4: CCI+Que (50 mg/kg)组;5: CCI+Que (100 mg/kg)组a:P < 0.05,与Sham+Veh组比较;b:P < 0.05,与CCI+Veh组比较 图 2 槲皮素对CCI大鼠炎性因子和iNOS、COX-2表达的影响 |
2.4 槲皮素抑制Wnt/β-catenin通路的激活
Western blot与qRT-PCR检测结果显示,用药后7 d,槲皮素显著降低了Wnt3a和β-catenin的水平,并呈现剂量依赖效应(图 3A~C),而Wnt激动剂SB216763处理后抑制了槲皮素的作用,显著提高了大鼠脊髓中β-catenin、iNOS与COX-2的水平(图 3D~F)。另外,SB216763使槲皮素降低的大鼠脊髓炎性因子的水平显著上升(P < 0.05,图 3G)。结果表明,槲皮素可能通过抑制Wnt/β-catenin通路降低CCI大鼠脊髓中炎性因子和疼痛相关分子的表达。
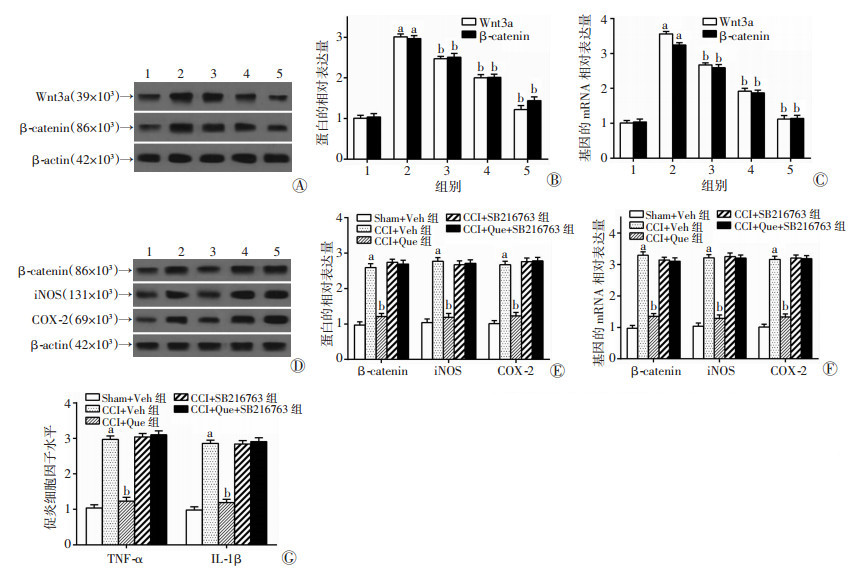
|
| A: Western blot检测结果;B :半定量分析结果;C : Wnt3a、β-catenin蛋白的mRNA相对表达;D:Wnt/β-catenin通路激活剂作用后β-catenin、iNOS及COX-2蛋白表达;E:β-catenin、iNOS及COX-2蛋白表达的半定量分析结果;F:β-catenin、iNOS及COX-2蛋白的mRNA相对表达;L:促炎细胞因子水平l:Sham+Veh组;2m CCI+Veh组;3m CCI+>ue (30 mg/kg)组;4m CCI+>ue (50 mg/kg)组;5: CCI+>ue (100 mg/kg)组;6m CCI+SB216763组;7m CCI+Que+SB216763组a:p < 0.05, 与Sham+Veh组比较; b:p < 0.05, 与CCI+Veh组比较 图 3 槲皮素对CCI大鼠Wnt/β-catenin通路分子表达的影响 |
3 讨论
神经病理性疼痛的发生机制复杂,多种因素参与其中。近年来研究发现,脊髓小胶质细胞是神经病理性疼痛的重要参与者。神经损伤可以导致脊髓小胶质细胞异常激活,小胶质细胞激活后,产生大量细胞因子、炎性介质、神经生长因子和自由基等,进而增强脊髓背角神经元的兴奋性,过量的这些物质积聚在脊髓背角,使病理性疼痛进一步发展和持续[5-6]。本研究发现,CCI模型大鼠的机械痛阈和热痛阈在术后明显下降,至7 d之后降至最低,符合神经病理性疼痛模型的痛敏规律。
槲皮素作为一个典型的黄酮类化合物,具有抗病毒、降糖降压、免疫调节及心血管保护作用等生物活性[2]。近年来,有研究表明,槲皮素对酒精诱导的神经损伤小鼠具有保护作用[7]。槲皮素已经被发现能够提高小鼠的痛阈[8],但其机制少见报道。本研究证明,槲皮素作用于CCI大鼠后,显著升高了大鼠的机械痛阈和热痛阈,说明槲皮素能够缓解CCI大鼠神经病理性疼痛,并呈现一定的剂量依赖效应。
激活的胶质细胞释放的炎症因子直接作用于神经病理性疼痛的病理生理过程。已知在慢性坐骨神经缩窄性损伤模型中,炎症因子TNF-α和IL-1β的表达水平显著升高[9],与本实验结果一致。高浓度的TNF-α在中枢可以被看作是一种神经毒性多肽,可以在中枢诱导氧自由基生成,过度表达TNF-α的小鼠可发生严重的炎症、脑病和神经退行性病变[10]。本研究发现,槲皮素能显著降低CCI大鼠炎性因子的表达水平。NO是一种新的神经递质和炎症递质,由一氧化氮合酶催化生成,分为内皮型一氧化氮合酶(eNOS/NOS3)、神经元型NOS (nNOS/NOS1)、诱导型NOS (iNOS/NOS2)。NO具有极强扩张血管和增加血管通透性的作用,从而在炎症反应中起重要作用,并能增强痛觉感受和传导的敏感性,过高浓度的NO会导致脊髓中枢疼痛的增强和炎性反应[11]。动物实验结果显示,COX-2作为疼痛相关基因的一种,在神经病理性疼痛模型中过表达[12]。因此,给予选择性COX-2抑制剂能够有效地抑制神经病理性疼痛的发展[13]。本实验结果表明,槲皮素使CCI大鼠脊髓组织iNOS与COX-2的表达水平均显著下降,并呈现一定的剂量依赖效应。
神经系统发育过程中,对神经轴突再生等起重要调节作用的WNT蛋白家族,在神经病理性疼痛的发病机制中扮演重要角色。WNT信号通路的激活能够刺激促炎因子TNF-α和IL-1β的产生,加重神经病理性疼痛的进展[14]。另外,COX-2作为Wnt/β-catenin通路下游的靶分子[15],能够通过调节iNOS的表达影响细胞功能[16]。有研究表明,在CCI大鼠鞘内注射WNT通路抑制剂能有效降低大鼠的机械痛敏和热痛敏[17]。另外,槲皮素通过抑制WNT通路调节抑制癌细胞的迁移和黏附[18]。本实验结果表明,槲皮素可能通过抑制Wnt/β-catenin通路降低CCI大鼠脊髓中炎性因子和疼痛相关分子iNOS和COX-2的表达。抑制NF-κB信号通路能有效地减轻CCI大鼠的神经病理性疼痛[19]。而有研究发现槲皮素通过抑制NF-κB通路减轻大鼠神经损伤[20]。在众多癌症中,NF-κB通路能够调节Wnt5A的表达[21],因此我们推测,槲皮素可能通过抑制NF-κB与Wnt通路之间相互作用从而缓解大鼠神经病理性疼痛,但其具体机制还需进一步的实验研究。
综上所述,本实验通过构建CCI大鼠模型,探究了槲皮素对神经病理性疼痛的影响,结果表明槲皮素可能通过抑制Wnt/β-catenin通路抑制疼痛相关分子的表达,从而缓解CCI大鼠的神经病理性疼痛。本研究深入阐明了槲皮素缓解神经病理性疼痛的机制,为治疗神经病理性疼痛提供了新的思路。
| [1] | Jarvis M F, Boyce-Rustay J M. Neuropathic pain: models and mechanisms[J]. Curr Pharm Des,2009, 15 (15) : 1711 –1716. DOI:10.2174/138161209788186272 |
| [2] | 孙涓, 余世春. 槲皮素的研究进展[J]. 现代中药研究与实践,2011, 25 (3) : 85 –88. |
| [3] | Azevedo M I, Pereira A F, Nogueira R B, et al. The antioxidant effects of the flavonoids rutin and quercetin inhibit oxaliplatin-induced chronic painful peripheral neuropathy[J]. Mol Pain,2013, 9 : 53 . DOI:10.1186/1744-8069-9-53 |
| [4] | Bennett G J, Xie Y K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J]. Pain,1988, 33 (1) : 87 –107. DOI:10.1016/0304-3959(88)90209-6 |
| [5] | Ji R R, Berta T, Nedergaard M. Glia and pain: is chronic pain a gliopathy?[J]. PAIN,2013, 154 (Suppl 1) : S10 –S28. DOI:10.1016/j.pain.2013.06.022 |
| [6] | Kiguchi N, Kobayashi Y, Kishioka S. Chemokines and cytokines in neuroinflammation leading to neuropathic pain[J]. Curr Opin Pharmacol,2012, 12 (1) : 55 –61. DOI:10.1016/j.coph.2011.10.007 |
| [7] | Raygude K S, Kandhare A D, Ghosh P, et al. Evaluation of ameliorative effect of quercetin in experimental model of alcoholic neuropathy in rats[J]. Inflammopharmacology,2012, 20 (6) : 331 –341. DOI:10.1007/s10787-012-0122-z |
| [8] | 龚珊, 张玉英, 俞光第, 等. 槲皮素镇痛作用的观察[J]. 中草药,1996, 10 : 612 –613. |
| [9] | 胡传银, 陈小萍, 赵云涛. 岩藻聚糖硫酸酯对大鼠神经病理性疼痛的镇痛作用及其机制[J]. 解剖学杂志,2014, 37 (2) : 188 –191. DOI:10.3969/j.issn.1001-1633.2014.02.015 |
| [10] | Dai Z K, Lin T C, Liou J C, et al. Xanthine derivative KMUP-1 reduces inflammation and hyperalgesia in a bilateral chronic constriction injury model by suppressing MAPK and NFkappaB activation[J]. Mol Pharm,2014, 11 (5) : 1621 –1631. DOI:10.1021/mp5000086 |
| [11] | Huang S H, Wu S H, Lee S S, et al. Fat Grafting in Burn Scar Alleviates Neuropathic Pain via Anti-Inflammation Effect in Scar and Spinal Cord[J]. PLoS One,2015, 10 (9) : e0137563 . DOI:10.1371/journal.pone.0137563 |
| [12] | Fu E S, Zhang Y P, Sagen J, et al. Transgenic inhibition of glial NF-kappa B reduces pain behavior and inflammation after peripheral nerve injury[J]. Pain,2010, 148 (3) : 509 –518. DOI:10.1016/j.pain.2010.01.001 |
| [13] | 周国斌, 李红英, 吉锦泉, 等. COX抑制剂对神经病理性疼痛大鼠镇痛效果及机制[J]. 南方医科大学学报,2011, 31 (10) : 1764 –1766. |
| [14] | Itokazu T, Hayano Y, Takahashi R, et al. Involvement of Wnt/beta-catenin signaling in the development of neuropathic pain[J]. Neurosci Res,2014, 79 : 34 –40. DOI:10.1016/j.neures.2013.12.002 |
| [15] | Araki Y, Okamura S, Hussain S P, et al. Regulation of cyclooxygenase-2 expression by the Wnt and ras pathways[J]. Cancer Res,2003, 63 (3) : 728 –734. |
| [16] | Hori M, Kita M, Torihashi S, et al. Upregulation of iNOS by COX-2 in muscularis resident macrophage of rat intestine stimulated with LPS[J]. Am J Physiol Gastrointest Liver Physiol,2001, 280 (5) : G930 –G938. |
| [17] | Xu Z, Chen Y, Yu J, et al. TCF4 Mediates the Maintenance of Neuropathic Pain Through Wnt/beta-Catenin Signaling Following Peripheral Nerve Injury in Rats[J]. J Mol Neurosci,2015, 56 (2) : 397 –408. DOI:10.1007/s12031-015-0565-y |
| [18] | Mojsin M, Vicentic J M, Schwirtlich M, et al. Quercetin reduces pluripotency, migration and adhesion of human teratocarcinoma cell line NT2/D1 by inhibiting Wnt/beta-catenin signaling[J]. Food Funct,2014, 5 (10) : 2564 –2573. DOI:10.1039/c4fo00484a |
| [19] | Chu L W, Chen J Y, Yu K L, et al. Neuroprotective and anti-inflammatory activities of atorvastatin in a rat chronic constriction injury model[J]. Int J Immunopathol Pharmacol,2012, 25 (1) : 219 –230. DOI:10.1177/039463201202500124 |
| [20] | Gholami M, Khayat Z K, Anbari K, et al. Quercetin ameliorates peripheral nerve ischemia-reperfusion injury through the NF-kappa B pathway[J]. Anat Sci Int,2016 . DOI:10.1007/s12565-016-0336-z |
| [21] | Du Q, Geller D A. Cross-Regulation Between Wnt and NF-kappaB Signaling Pathways[J]. For Immunopathol Dis Therap,2010, 1 (3) : 155 –181. DOI:10.1615/ForumImmunDisTher.v1.i3 |



