糖尿病肾病(diabetic nephropathy, DN)是糖尿病微血管病变的主要并发症之一。早期糖尿病肾病血管病变主要表现为病理性血管新生,而新生血管结构和功能不成熟,表现为内皮通透性增加、血浆蛋白外渗,进而出现系膜基质增多、血管腔狭窄、纤维帽和微动脉的玻璃样变等DN特征性的改变。目前,糖尿病肾病肾脏出现异常血管新生的发病机制仍然不完全清楚。已知DN肾小球肥大、内皮高通透性、内皮一氧化氮合成酶(eNOS)低表达、尿蛋白增多与血管内皮生长因子(vascular endothelial growth factor, VEGF)高表达密切相关[1]。体外实验也证实VEGF能促进内皮细胞增生、迁移和内皮成管[2]。动物实验研究显示抗VEGF治疗会缓解和改善DN病理变化[3],说明抗血管新生可能对早期DN治疗有帮助。然而抗VEGF治疗也会带来许多不良副作用,如微血管堵塞、高血压和蛋白尿的发生[4],因此需要深入研究高糖条件下血管新生的调控机制,找到治疗DN血管新生的新策略。
近年Slit2/Robo1信号通路在血管新生的调节作用开始得到广泛关注[5-6]。Slit2主要表达于血管内皮细胞和平滑肌细胞,相对分子质量约为200×103。Slit2通过不同的Robo受体调节内皮细胞多样的生物学表现[7]。Robo家族是一类单通道的跨膜受体,在哺乳动物中包括4个成员:Robol、Robo2、Robo3和Robo4。Robo1和Robo4均可表达于血管内皮细胞和平滑肌细胞,且更容易与Slit2配体结合。研究表明Slit2/Robo1信号通路参与糖尿病视网膜血管新生[8],但是否也参与早期DN肾脏的血管生成尚少见报道。因此,本研究通过检测正常和早期DN肾组织中的Slit2、Robo1和血管内皮细胞标记物CD31的表达变化,结合相应临床生化检测指标,探讨Slit2/Robo1信号通路在早期DN肾小球血管新生中的作用及其可能的临床意义。
1 资料与方法 1.1 研究对象收集2011年9月至2016年1月本科收治的2型糖尿病DN患者的临床资料和病理肾活检标本,依据Mogensen’s糖尿病肾病临床分型[9],结合2010年Tervaert’s糖尿病肾病病理分型标准[10],将糖尿病患者24 h尿蛋白>30 mg且<500 mg, 肾活检镜下肾小球系膜轻度增生, 系膜增生面积小于毛细血管袢腔面积的(相当于Tervaert’s糖尿病肾病病理分型Ⅱa期),肾小球滤过率(estimated glomerular filtration rate,eGFR)>90 mL/(min·1.73 m2),纳入为早期糖尿病肾病患者。共筛选早期DN患者19例,其中男性14例,女性5例,年龄(49.9±7.2)岁, 发现糖尿病时间平均4.2年,有不规则口服降糖药物治疗史。取15例肾癌患者癌旁正常组织(对照组),其中男性9例,女性6例,年龄(48.1±9.3)岁。早期DN组及对照组均排除合并其他肾脏疾病。本研究通过本院伦理委员会批准,患者签署知情同意书。
1.2 临床及实验数据临床数据和肾脏病理资料均为患者在我院初次确诊为DN时的临床资料和肾活检结果。临床数据包括性别、年龄和发现糖尿病时间;生化检测指标包括糖化血红蛋白(HbA1c)、血尿素氮、血肌酐水平及24 h尿蛋白量,估算eGFR根据Kong等[11]提出的适合中国人群eGFR估算公式进行计算。
1.3 主要试剂人Slit2、Robo1和CD31兔多克隆抗体均购自Proteintech公司,PV-6000免疫组化试剂盒及浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司,HE染色试剂盒购自碧云天生物技术有限公司,PAS染色试剂盒购自索莱宝科技有限公司。
1.4 肾组织HE染色、PAS染色和电镜拍照4 μm肾组织石蜡切片进行HE染色和PAS染色,实验步骤依据试剂盒说明书进行。进行透射电镜样品制备的肾组织,2.5%戊二醛固定后交电镜室进行后续固定、漂洗、脱水、包埋、固化、超薄切片及铀-铅双重染色,最后JEM-1400 Plus透射电镜观察并拍照。
1.5 免疫组化学检测Slit2、Robo1和CD31的表达免疫组化依据试剂盒说明书进行操作,二抗由北京中杉金桥生物技术有限公司提供。阴性对照以PBS代替一抗,其他操作步骤同前。切片染色成功后在光学显微镜下观察并拍照,每张切片随机选取5个高倍镜视野(×400)的肾小球,使用Image-Pro Plus 6.0彩色图像分析处理系统对Slit2、Robo1和CD31在肾小球中的表达(不包括肾小球囊壁)用累积光密度值(IOD)进行半定量分析,取平均值反映样本指标的表达量。
1.6 统计学分析采用SPSS 21.0统计软件,计量资料以x±s表示,两两比较采用t检验或秩和检验,相关性分析采用Pearson相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 病例的临床特点对照组和早期DN组年龄差异无统计学意义(P>0.05)。早期DN组患者发现糖尿病最短1年,最长14年,平均4.2年。早期DN组糖化血红蛋白和24 h尿蛋白均显著性高于对照组(P < 0.05);尿素氮两组差异无统计学意义(P>0.05);早期DN组血肌酐略低于正常对照组,而eGFR略高于对照组,差异无统计学意义(P>0.05,表 1)。
| 组别 | 例数 | 年龄(岁) | 糖化血红蛋白(%) | 尿蛋白(mg/24 h) | 尿素氮(mmol/L) | 血肌酐(μmol/L) | eGFR[mL/(min·1.73 m2)] |
| 对照组 | 15 | 48.1±9.3 | 5.34±0.42 | 17.94±5.48 | 5.33±1.40 | 70.69±8.91 | 100.08±12.36 |
| 早期DN组 | 19 | 49.9±7.2 | 7.53±0.89a | 236.27±92.63a | 5.31±1.32 | 62.32±10.83 | 108.03±10.89 |
| a: P < 0.05, 与对照组比较 | |||||||
2.2 光镜和电镜观察早期DN患者肾小球形态结构的变化
HE染色结果显示早期DN肾小球肥大,肾小球毛细血管扩张;PAS染色结果显示早期DN组肾小球肥大,肾小球系膜轻度增生;透射电镜检测结果显示早期DN组肾小球基底膜增厚,内皮细胞增大以及数量相对增多(图 1,表 2)。
| 组别 | 例数 | 肾小球直径(μm) | 肾小球系膜增生指数评分 | 肾小球基底膜厚度(nm) | 肾小球单个血管腔内皮细胞个数 |
| 对照组 | 15 | 198.93±25.16 | 0.37±0.10 | 323.45±44.63 | 0.93±0.11 |
| 早期DN组 | 19 | 288.35±33.18a | 2.85±0.92a | 508.16±45.09a | 1.95±0.24a |
| a: P < 0.05, 与对照组比较 | |||||
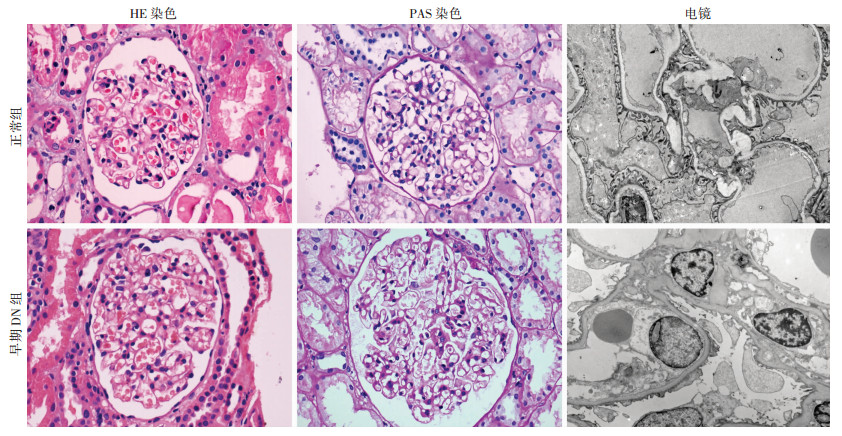
|
| 图 1 两组肾小球组织形态学变化(HE×400,PAS×400,×8 000) |
2.3 2组肾小球组织中Slit2、Robo1和CD31的表达
免疫组化结果显示,Slit2表达于肾小球血管内皮、肾小管上皮和系膜细胞区域;Robo1受体表达于肾小球血管内皮、肾小管上皮和足细胞区域;CD31表达于肾小球血管内皮。与正常组相比,早期DN组肾小球中Slit2、Robo1和CD31的表达都显著性增高(P < 0.01,图 2,表 3)。
| 组别 | 例数 | Slit2 | Robo1 | CD31 |
| 对照组 | 15 | 6 853.02±1 535.97 | 6 665.84±1 799.75 | 17 942.57±2 257.39 |
| 早期DN组 | 19 | 20 169.25±3 302.96a | 17 985.63±2 325.46a | 46 088.12±5 399.36a |
| a: P < 0.01, 与对照组比较 | ||||
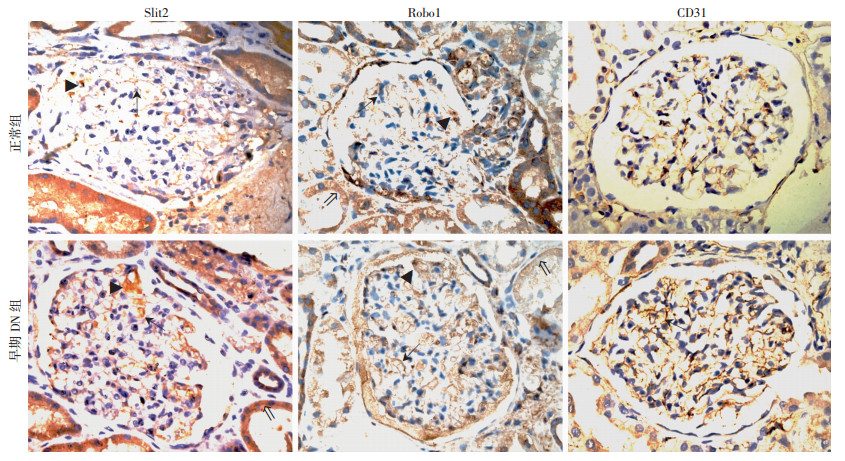
|
| 单箭头示内皮细胞区域,双箭头示肾小管上皮区域,Slit2图中短箭头示系膜细胞区域,Robo1图中短箭头示足细胞区域 图 2 两组肾小球组织中Slit2、Robo1和CD31的表达(×400) |
2.4 早期DN组肾小球Slit2/Robo1表达、CD31表达、24 h尿蛋白以及eGFR的相关性分析
相关性分析结果(图 3)显示,早期DN组肾小球中Slit2和Robo1的表达与血管内皮细胞标记物CD31表达呈正相关(r=0.73,P < 0.01;r=0.72,P < 0.01),提示Slit2/Robo1信号通路可能参与了早期DN肾小球血管内皮细胞增生;早期DN组肾小球中Slit2、Robo1和CD31表达与eGFR呈正相关(r=0.78,P < 0.01;r=0.81,P < 0.01;r=0.57,P < 0.05),提示Slit2和Robo1表达增高发生在早期DN高eGFR时期,CD31表达增高反映血管内皮细胞增生并可能促进血管新生从而增加eGFR;早期DN肾小球中Slit2、Robo1和CD31表达与24 h尿蛋白也呈正相关(r=0.46,P < 0.05;r=0.49,P < 0.05;r=0.47,P < 0.05),提示Slit2/Robo1信号通路可能通过参与血管内皮增生促进病理性血管生成,从而促进蛋白尿的进展。
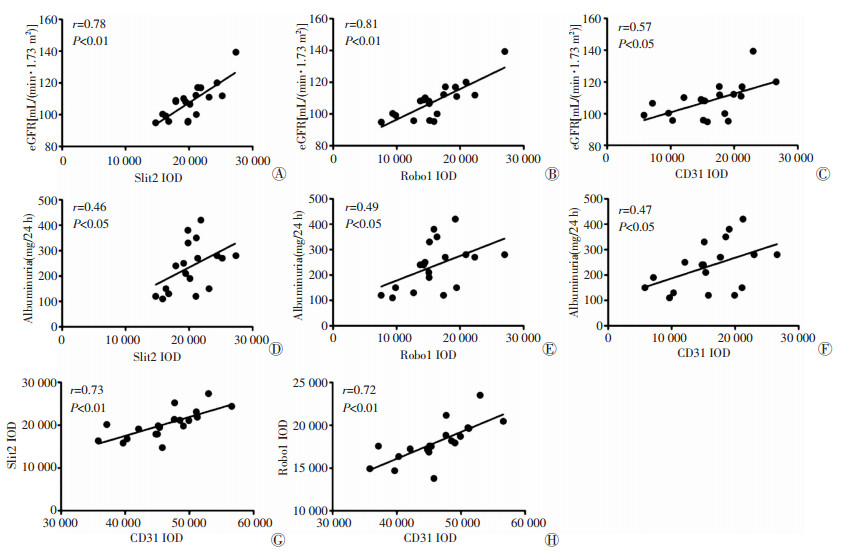
|
| A~C:分别表示Slit2、Robo1和CD31在早期DN组肾小球中的表达与DN患者eGFR的相关性;D~F:分别表示Slit2、Robo1和CD31在早期DN组肾小球中的表达与DN患者24 h尿蛋白的相关性;G~H:分别表示Slit2和Robo1在早期DN组肾小球中的表达与CD31表达的相关性 图 3 两组肾小球Slit2/Robo1表达、CD31表达、24 h尿蛋白以及eGFR相关性分析 |
3 讨论
通常早期DN的定义是指Mogensen等[9]1983年发布的DN分期的第3期,又称“持续微量白蛋白尿期”,即尿蛋白排泄率为15~300 μg/min, 此期eGFR仍然超过正常水平,患者血压可轻度升高。Mogensen将24 h尿蛋白定量>0.5 g的患者分到第4期,即显性糖尿病肾病期(overt diabetic nephropathy)。由于该分期是针对1型糖尿病肾病所作分期,部分标准并不完全适合2型糖尿病肾病的情况,存在诸多不足。以尿蛋白为主要标准进行分期可能会导致一些已经出现eGFR降低、尿蛋白不高的2型糖尿病肾病患者分入早期糖尿病肾病,从而影响患者的治疗和对预后的判断。尽管这样,2014年我国糖尿病肾病防治指南中2型糖尿病肾病临床分期[12]仍然是参照Mogensen的分期,并未提出准确的定义。随着近年肾活检技术的开展和进步,2010年2月美国肾脏病杂志发表了糖尿病肾病病理的Tervaert[10]分型标准,为DN的临床诊断和研究提供了标准化的依据,该分型方案优点是对1和2型DN均适用,而且建立了量化的标准,如Ⅰ期DN肾小球基底膜厚度男性(年龄≥9岁)>430 nm,女性(年龄≥9岁)>395 nm;Ⅱa期轻度系膜基质增生>25%观察的系膜区等量化标准。但该分型仅提出病理分级标准,未提及临床表现和尿蛋白水平。为此,我们结合上述二个经典分期标准,将Tervaert分型Ⅱa期和24 h尿蛋白>30 mg且<500 mg,同时eGFR>90 mL/(min·1.73 m2),并排除有其他肾脏疾病的糖尿病患者纳为早期DN患者。纳入标准包括部分Mogensen 4期(24 h尿蛋白<500 mg)患者和Tervaert分型Ⅱa期以下患者,既包括Mogensen以尿蛋白分级原则也体现了Tervaert分型对早期DN的分级原则。入组的19例早期DN患者,年龄(49.9±7.2)岁, 2组年龄差异无统计学意义(P>0.05)。发现糖尿病时间平均4.2年。早期DN组的糖化血红蛋白显著性高于对照组,说明患者血糖水平控制不佳。早期DN组血肌酐略低于对照组,而eGFR略高于对照组,差异均无统计学意义(P>0.05),早期DN组患者尿蛋白水平(236.27±92.63) mg/24 h,<300 μg/min,说明入组患者符合Mogensen糖尿病肾病早期临床分型。
Tervaert分型方案也增加了血管损伤分级,如动脉血管玻璃样变,无计0分,一个动脉玻璃样变计1分,超过1个计2分;内膜增厚,无计0分,内膜增厚未超过膜厚度计1分,超过计2分。该血管分级评分对判断慢性DN患者的预后和蛋白尿发生的程度很有帮助,但未提出早期DN血管损伤更详细的分级标准,因此,需要更深入研究早期DN血管损伤的病理特点和发生机制。本研究采用HE染色、PAS染色和透射电镜观察发现早期DN肾小球相对肥大、系膜基质轻度增生、基底膜增厚、毛细血管扩张、血管内皮细胞体积增大和数目增多,这些结果与动物和人早期DN肾小球病理改变基本一致[13-14]。同时,CD31染色结果显示早期DN组CD31的表达也明显高于对照组,这意味着早期DN肾脏存在血管内皮增生,而内皮增生是血管生成的一个关键环节,这意味着早期DN可能存在血管新生[15]。早期DN新生血管结构和功能不成熟,存在肾小球内皮高通透性,进而出现持续微量白蛋白尿、系膜基质增多、动脉玻璃样变等DN特征性改变[16]。DN血管新生与VEGF的活性和表达增高有关[1],但VEGF增多的刺激因素多,因此,寻找高糖血管损伤病变的启动因素仍然需要更多的研究。
我们前期研究[17]了ROBO4/ARF6信号通路蛋白在人糖尿病肾病肾小球中的表达变化,发现DN肾小球内皮细胞存在低表达Robo4,提示内皮细胞高通透性和微量白蛋白尿的发生与Robo4表达下降有关。Robo4是Robo家族中具有血管稳定作用的跨膜蛋白,配体Slit2通过Robo4信号途径可抑制内皮增殖、迁移和成管等血管新生作用,而经Robo1途径与Robo4途径作用刚好相反。因此,需要进一步观察Robo1和上游配体Slit2的表达变化,以便全面了解Slit2/Robo系统在DN的作用。已经发现Slit2/Robo1信号通路参与了不同的生理和病理条件下的血管新生。如Sli2/Robo1信号通路活化参与了心脏管型形成[18]、视网膜血管新生[19]、病理性肿瘤血管生成[20]和糖尿病视网膜血管新生[8]等。但该信号通路是否参与了早期DN病理性血管新生仍不清楚,本研究免疫组化结果显示,Slit2表达于肾小球血管内皮、肾小管上皮和系膜细胞区域;Robo1受体表达于肾小球血管内皮、肾小管上皮和足细胞区域,提示Slit2/Robo1信号通路蛋白可能广泛参与肾脏细胞的信号调控。早期DN组中Slit2与Robo1的表达显著性高于对照组,相关分析显示Slit2与Robo1的表达与CD31表达成显著正相关,说明Slit2/Robo1信号通路在早期DN肾小球中被激活,有可能参与了病理性血管内皮增生和血管新生。
近年研究认为早期DN出现微量蛋白尿与异常血管新生有关联[21],因此我们分析了早期DN组中CD31的表达与24 h尿蛋白的相关性,结果发现CD31与24 h尿蛋白正相关,意味着血管内皮增生可能促进了蛋白尿的进展。分析Slit2和Robo1表达与24 h尿蛋白的相关性发现其也与尿蛋白呈正相关,由此推测Slit2/Robo1信号通路可能通过促进早期DN肾小球血管内皮增生从而促进血管新生并加速蛋白尿的进展。结合我们前期研究Robo4在DN表达的结果,我们认为早期DN可能存在高表达的Slit2、高表达的Robo1和低表达的Robo4,Robo1-Robo4平衡失衡,Robo4负反馈机制缺失,由此产生由Slit2/Robo1途径活化参与的血管新生和肾小球高通透性等病理生理结果,但这仅仅是推测,需要进一步体外实验研究证实。
总之,本实验证实Slit2/Robo1信号通路在早期DN肾小球中被激活,Slit2和Robo1表达与肾小球血管内皮标记物CD31的表达显著正相关,与24 h尿蛋白和eGFR正相关,这些结果提示该信号通路可能参与了早期DN肾小球血管内皮增生并促进血管新生,阻断Slit2/Robo1信号通路有可能成为治疗早期DN病理性血管新生的新策略。
| [1] | Nakagawa T, Sato W, Kosugi T, et al. Uncoupling of VEGF with endothelial NO as a potential mechanism for abnormal angiogenesis in the diabetic nephropathy[J]. J Diabetes Res,2013, 2013 : 184539 . DOI:10.1155/2013/184539 |
| [2] | Sun T, Cao H, Xu L, et al. Insulin-like growth factor binding protein-related protein 1 mediates VEGF-induced proliferation, migration and tube formation of retinal endothelial cells[J]. Curr Eye Res,2011, 36 (4) : 341 –349. DOI:10.3109/02713683.2010.545498 |
| [3] | Mironidou-Tzouveleki M, Tsartsalis S, Tomos C. Vascular endothelial growth factor (VEGF) in the pathogenesis of diabetic nephropathy of type 1 diabetes mellitus[J]. Curr Drug Targets,2011, 12 (1) : 107 –114. DOI:10.2174/138945011793591581 |
| [4] | Machado F G, Kuriki P S, Fujihara C K, et al. Chronic VEGF blockade worsens glomerular injury in the remnant kidney model[J]. PLoS One,2012, 7 (6) : e39580 . DOI:10.1371/journal.pone.0039580 |
| [5] | Li S, Huang L, Sun Y, et al. Slit2 Promotes Angiogenic Activity via the Robo1-VEGFR2-ERK1/2 Pathway in Both In Vivo and In Vitro Studies[J]. Invest Ophthalmol Vis Sci,2015, 56 (9) : 5210 –5217. DOI:10.1167/iovs-14-16184 |
| [6] | 张明慧, 周希瑗. 腺病毒介导slit2基因转染人视网膜色素上皮细胞对RF/6A细胞迁移及管腔形成的影响[J]. 第三军医大学学报,2015 (16) : 1619 –1623. DOI:10.16016/j.1000-5404.201411197 |
| [7] | Yang Y C, Chen P N, Wang S Y, et al. The differential roles of Slit2-exon 15 splicing variants in angiogenesis and HUVEC permeability[J]. Angiogenesis,2015, 18 (3) : 301 –312. DOI:10.1007/s10456-015-9467-4 |
| [8] | Zhou W, Yu W, Xie W, et al. The role of SLIT-ROBO signaling in proliferative diabetic retinopathy and retinal pigment epithelial cells[J]. Mol Vis,2011, 17 : 1526 –1536. |
| [9] | Mogensen C E, Christensen C K, Vittinghus E. The stages in diabetic renal disease. With emphasis on the stage of incipient diabetic nephropathy[J]. Diabetes,1983, 32 (Suppl 2) : 64 –78. DOI:10.2337/diab.32.2.S64 |
| [10] | Tervaert T W, Mooyaart A L, Amann K, et al. Pathologic classification of diabetic nephropathy[J]. J Am Soc Nephrol,2010, 21 (4) : 556 –563. DOI:10.1681/ASN.2010010010 |
| [11] | Kong X, Ma Y, Chen J, et al. Evaluation of the Chronic Kidney Disease Epidemiology Collaboration equation for estimating glomerular filtration rate in the Chinese population[J]. Nephrol Dial Transplant,2013, 28 (3) : 641 –651. DOI:10.1093/ndt/gfs491 |
| [12] | 中华医学会糖尿病学分会微血管并发症学组. 糖尿病肾病防治专家共识(2014年版)[J]. 中华糖尿病杂志,2014, 6 (11) : 792 –801. DOI:10.3760/cma.j.issn.1674-5809.2014.11.004 |
| [13] | Dessapt-Baradez C, Woolf A S, White K E, et al. Targeted glomerular angiopoietin-1 therapy for early diabetic kidney disease[J]. J Am Soc Nephrol,2014, 25 (1) : 33 –42. DOI:10.1681/ASN.2012121218 |
| [14] | Najafian B, Alpers C E, Fogo A B. Pathology of human diabetic nephropathy[J]. Contrib Nephrol,2011, 170 : 36 –47. DOI:10.1159/000324942 |
| [15] | Tian S, Tang J, Liu H, et al. Propyl gallate plays a nephroprotective role in early stage of diabetic nephropathy associated with suppression of glomerular endothelial cell proliferation and angiogenesis[J]. Exp Diabetes Res,2012, 2012 : 209567 . DOI:10.1155/2012/209567 |
| [16] | Nakagawa T, Kosugi T, Haneda M, et al. Abnormal angiogenesis in diabetic nephropathy[J]. Diabetes,2009, 58 (7) : 1471 –1478. DOI:10.2337/db09-0119 |
| [17] | 官涛, 郑科, 刘军辉, 等. ROBO4/ARF6信号通路在糖尿病肾病患者肾小球组织的表达及意义[J]. 解放军医学杂志,2016 (04) : 267 –272. DOI:10.11855/j.issn.0577-7402.2016.04 |
| [18] | Fish J E, Wythe J D, Xiao T, et al. A Slit/miR-218/Robo regulatory loop is required during heart tube formation in zebrafish[J]. Development,2011, 138 (7) : 1409 –1419. DOI:10.1242/dev.060046 |
| [19] | Rama N, Dubrac A, Mathivet T, et al. Slit2 signaling through Robo1 and Robo2 is required for retinal neovascularization[J]. Nat Med,2015, 21 (5) : 483 –491. DOI:10.1038/nm.3849 |
| [20] | Ao J Y, Chai Z T, Zhang Y Y, et al. Robo1 promotes angiogenesis in hepatocellular carcinoma through the Rho family of guanosine triphosphatases' signaling pathway[J]. Tumour Biol,2015, 36 (11) : 8413 –8424. DOI:10.1007/s13277-015-3601-1 |
| [21] | Zhang B H, Wang W, Wang H, et al. Promoting effects of the adipokine, apelin, on diabetic nephropathy[J]. PLoS One,2013, 8 (4) : e60457 . DOI:10.1371/journal.pone.0060457 |



