2. 400038 重庆,第三军医大学西南医院麻醉科 ;
3. 401420 重庆,綦江区人民医院麻醉科
2. Department of Anesthesiology, Southwest Hospital, Third Military Medical University, Chongqing, 400038 ;
3. Department of Anesthesiology, Qijiang Distract People’s Hospital, Chongqing,401420, China
目前,针对减轻器官缺血再灌注损伤(ischemia-reperfusion injury,IRI)的预防措施主要有两大类:手术和药物治疗,手术治疗主要是通过缺血预处理,但由于伦理及技术的限制,在临床操作中未得到广泛推广;药物治疗指各类器官保护药物[1]。七氟烷(sevoflurane,SEVO),一种高效吸入麻醉药,具有可控性强,对呼吸道刺激、血流动力学及交感神经活动影响小等优点,临床应用广。目前,越来越多的研究表明,SEVO可以对脑[2]、心肌[3]、肝脏[4]、肾脏[5]、肠道[6]等器官缺血再灌注损伤产生保护作用。文献[7]报道称其对LIRI也具有保护作用,但相关研究甚少。本实验中,我们探讨SEVO是否对LIRI具有肺保护作用。
1 材料与方法 1.1 动物分组与处理SPF级健康成年雄性SD大鼠由第三军医大学实验动物中心提供,实验动物许可证号:SCXK渝2012-0005,体质量220~250 g。将75只大鼠编号后按随机数字表法分为5组,假手术组(Sham),缺血再灌注组(I/R),七氟烷预处理组(SEVO),LY294002组(LY)及七氟烷预处理+LY294002组(PI3K抑制剂)(SEVO+LY),各15只。
参照Ng等[8]的方法进行大鼠肺IRI建模。对于Sham组大鼠仅开胸游离肺门,不做夹闭处理;I/R组大鼠以无创血管夹夹闭左肺门,1 h后开放血管,关胸;SEVO组大鼠于夹毕肺门前30 min吸入 2.1%七氟烷[9];LY组大鼠夹毕肺门前30 min腹腔给予LY294002 0.3 mg/kg(PI3K抑制剂)[10];SEVO+LY组大鼠夹毕肺门前30 min吸入 2.1%七氟烷(批号:H20130816,Maruishi Pharmaceutical公司,日本),且腹腔给予LY294002 0.3 mg/kg[10]。于再灌注120 min后分别开胸取肺保存。
1.2 大鼠肺组织湿/干质量比(W/D)的测定取各组大鼠左上肺组织,生理盐水洗净血迹,滤纸搽干表面水迹,以电子天平称取即湿质量(wet),再置入80 ℃烤箱中,24 h后称取即干质量(dry),二者之比即W/D。
1.3 Western blot法检测大鼠肺组织Beclin-1、LC3Ⅱ/Ⅰ、P62和p-PI3K的表达抽提各组大鼠左肺组织蛋白并用BCA 法测其浓度。按照Western blot法[11],分别取40 μg蛋白进行上样,电泳,转膜,BSA血清封闭2 h,分别加入一抗(Beclin-1、LC3Ⅱ/Ⅰ、P62和 p-PI3K,稀释度1∶1 000)于4 ℃冰箱孵育过夜,取出PVDF膜,TBST漂洗3次,二抗(1∶5 000)孵育2 h,化学发光法显色。用Image J软件测其灰度值,以目的蛋白灰度值与内参β-actin 灰度值的比值反映 Beclin-1、LC3Ⅱ/Ⅰ、P62和p-PI3K的表达情况
1.4 统计学处理采用统计软件SPSS 13.0进行分析。所有数据均以x±s表示。多组间比较采用双因素方差分析。
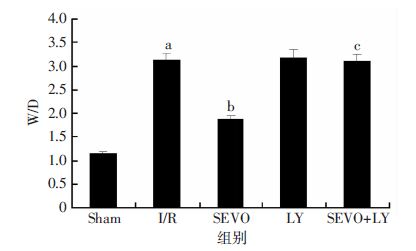
2 结果 2.1 大鼠肺组织湿/干质量比值(W/D)与Sham组比较,I/R组的 W/D值增加(P<0.05);与I/R组比较,SEVO组W/D值显著降低(P<0.05),而LY组与I/R组之间没有明显差异(P>0.05);SEVO+LY组W/D值高于SEVO组(P<0.05,图 1)。
|
| a:P<0.05,与Sham组比较;b:P<0.05,与I/R组比较;c:P<0.05,与SEVO组比较 图 1 各组大鼠肺组织湿重/干重比值(n=15,x±s) |
2.2 Western blot法检测大鼠肺组织自噬水平表达
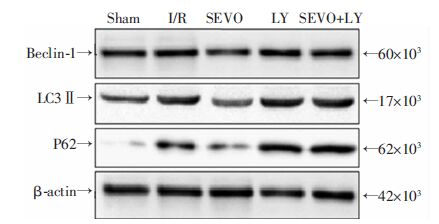
I/R组大鼠肺组织Beclin-1、LC3Ⅱ/Ⅰ、P62表达明显高于Sham组(P<0.05);与I/R组比较,SEVO组Beclin-1、LC3Ⅱ/Ⅰ、P62表达显著降低(P<0.05),LY组与I/R组之间差异没有统计学意义(P>0.05);SEVO+LY组Beclin-1、LC3Ⅱ/Ⅰ、P62表达高于SEVO组(P<0.05,图 2,表 1)。
|
| 图 2 Western blot检测各组大鼠肺组织Beclin-1、LC3Ⅱ/Ⅰ、P62 的表达情况 |
| 组别 | Beclin-1 | LC3Ⅱ/Ⅰ | P62 |
| Sham组 | 0.42±0.01 | 0.32±0.02 | 0.11±0.01 |
| I/R组 | 0.63±0.06a | 0.81±0.08a | 0.33±0.08a |
| SEVO组 | 0.37±0.03ab | 0.42±0.04ab | 0.24±0.03ab |
| LY组 | 0.66±0.11ac | 0.73±0.08ac | 0.53±0.08ac |
| SEVO+LY组 | 0.71±0.11ac | 0.83±0.08ac | 0.55±0.07ac |
| a:P<0.05,与Sham组比较;b:P<0.05,与I/R组比较;c:P<0.05,与SEVO组比较 | |||
2.3 Western blot检测大鼠肺组织p-PI3K表达
与Sham组比较,I/R组大鼠肺组织p-PI3K表达下调(P<0.05);与I/R组比较,SEVO组p-PI3K表达显著增加(P<0.05);LY组与I/R组比较,p-PI3K表达差异没有统计学意义(P>0.05);与SEVO组比较,SEVO+LY组p-PI3K表达明显降低(P<0.05,图 3)。

|
| A:Western blot检测结果;B:半定量分析 a:P<0.05,与Sham组比较;b:P<0.05,与I/R组比较;c:P<0.05,与SEVO组比较 图 3 Western blot检测各组大鼠肺组织p-PI3K 的表达情况 |
3 讨论
肺缺血再灌注损伤(lung ischemia reperfusion injury,LIRI)多发生于失血性休克、心肺复苏、体外循环、肺移植、一侧病变肺切除后,其中肺移植时,LIRI 发生率可高达25%[12]。肺组织缺血后的再灌注不仅不能恢复肺功能,反而加重肺结构破坏,最终可发展为急性肺损伤(ALI)或急性呼吸窘迫综合征(ARDS)。LIRI发生时,肺毛细血管内皮细胞受损,肺泡毛细血管屏障功能障碍,炎症细胞和炎性介质大量渗出,引起肺泡及间质发生水肿,组织细胞死亡。其中IRI引起细胞死亡的分子机制尚未阐明,目前较为统一的观点是细胞死亡分为坏死和凋亡两个过程,是否自噬性死亡参与其中有待证明。吸入麻醉药具有保护缺血再灌注损伤(IRI)组织器官的作用,已成为共识。Payne等[13]研究发现,细胞分裂活化蛋白激酶(MAPK)信号通路参与了吸入麻醉药的脑保护作用。Rancan[14]已证明,七氟烷对急性肺损伤的保护作用与抑制氧化应激反应和减少炎症介质释放有关。
自噬(autophagy)是真核生物进化高度保守的细胞自稳程序。非病理状态下,细胞内本身存在一定水平的自噬,维持内环境的稳定,而过度诱导的自噬能诱发细胞程序性死亡[15]。Beclin-1是哺乳动物启动自噬过程的特异性基因[15],当Beclin-1被活化后,在胞浆中逐渐产生C形的双层膜结构,参与自噬体的形成。另外,LC3 蛋白在正常情况下以LC3 Ⅰ的形式存在于胞浆中,在自噬发生时被切割和脂化成 LC3Ⅱ后,可以与自噬前体和自噬体的内外膜特异结合,且一直结合到自噬体与溶酶体融合,因此LC3Ⅱ目前被公认为是自噬的生物学标记物[15]。Zhang等[16]发现自噬在LIRI中起到了保护作用,可能与ERK1/2信号通路激活有关;另一方面,有研究指出LIRI发生时,过度蓄积的自噬体促进细胞凋亡[17]。本实验中,我们发现异常的自噬加重了LIRI,七氟烷预处理参与肺损伤过程细胞自噬调控,对LIRI有保护作用,机制可能与PI3K信号通路激活有关。
PI3K,普遍存在胞内的一种磷脂酰肌醇激酶,具有丝氨酸/苏氨酸(Ser/Thr)激酶的活性,可调节细胞增殖、分化、凋亡等。文献[18]报道PI3K被激活是调控脑IRI后神经细胞存活的关键环节,激活的PI3K使 Akt活化,活化的Akt又激活 P70S6K,最终抑制细胞凋亡。同时,PI3K信号转导通路也是诱导自噬产生的通路之一[19]。细胞内生长因子、营养状态及能量水平通过PI3K /Akt /PKB 通路调节TORC1活性,从而激活 mTOR,抑制细胞自噬[20]。完整的自噬过程分为两个阶段:①吞噬包裹所形成的自噬泡;②进一步与溶酶体结合消化,即完整的自噬流(autophagy flux)。P62 蛋白是一种接头蛋白,它可作为自噬受体与泛素化的蛋白质结合,同时与LC3Ⅱ相互作用,从而能够把泛素化的蛋白质运送到自噬体内降解。因此P62是反映自噬活性的标记蛋白之一,其含量间接反映自噬小体清除水平[21]。当自噬活性减弱或功能缺陷时,自噬流遭到破坏,P62会在细胞质中持续累积。Ma等[22]研究表明,IRI破坏了自噬泡与溶酶体正常结合过程,使自噬泡大量聚集,最终导致细胞死亡。Zhang等[23]报道了SEVO可以修复完整的自噬流,恢复再灌注期间溶酶体功能,发挥IRI心肌保护作用。本研究结果显示,大鼠发生LIRI后Beclin-1、LC3Ⅱ/Ⅰ蛋白表达上调,说明再灌注后肺组织细胞内自噬被激活,而P62蛋白表达上调,说明自噬流被破坏。由此推测IRI破坏了肺组织细胞内自噬流,使细胞内自噬体大量积聚,导致肺组织细胞自噬性死亡。同时本研究还显示SEVO可以显著降低LIRI后自噬体标记性蛋白Beclin-1、LC3Ⅱ/Ⅰ以及P62的表达,说明SEVO可以修复IRI过程中自噬流的破坏,进而抑制细胞死亡,有肺保护作用。在给予PI3K抑制剂LY294002后Beclin-1、LC3Ⅱ/Ⅰ和P62蛋白表达上调,肺损伤加重,保护作用消失。这启示我们,SEVO可能通过PI3K途径激活自噬,发挥肺保护作用,对于PI3K的磷酸化激活,可能主要是通过促进形成的自噬溶酶体,恢复了自噬流,使自噬发挥其消化降解、循环利用代谢产物的作用,而不是单纯地上调自噬活性,对LIRI损伤产生保护作用。
综上所述,SEVO对大鼠LIRI具有保护作用,其机制可能是通过激活PI3K信号转导通路,恢复再灌注期间自噬流的完整性,促进自噬体清除,进而抑制细胞死亡。
| [1] | 戴宁凰, 骆金华, 陈伟, 等. 不同剂量乌司他丁对离体兔肺保护作用的实验研究[J]. 实用心脑肺血管病杂志,2013, 21 (2) : 43 –44. DOI:10.3969/j.issn.1008-5971.2013.02.020 |
| [2] | Li D, Huang B, Liu J, et al. Decreased brain K(ATP) channel contributes to exacerbating ischemic brain injury and the failure of neuroprotection by sevoflurane post-conditioning in diabetic rats[J]. PLoS One,2013, 8 (8) : e73334 . DOI:10.1371/journal.pone.0073334 |
| [3] | Xu Y, Ma L L, Zhou C, et al. Hypercholesterolemic myocardium is vulnerable to ischemia-reperfusion injury and refractory to sevoflurane-induced protection[J]. PLoS One,2013, 8 (10) : e76652 . DOI:10.1371/journal.pone.0076652 |
| [4] | Yin Y, Yan M, Zhu T, et al. Minimum alveolar concentration of sevoflurane in rabbits with liver fibrosis[J]. Anesth Analg,2012, 114 (3) : 561 –565. DOI:10.1213/ANE.0b013e31823feca7 |
| [5] | Zhou S P, Liao W T, Yang L K, et al. Effects of sevoflurane pretreatment on renal Src and FAK expression in diabetic rats after renal ischemia/reperfusion injury[J]. Mol Cell Biochem,2013, 384 (1/2) : 203 –211. DOI:10.1007/s11010-013-1799-z |
| [6] | 李志鹏, 李玉娟, 何妹仪, 等. 七氟醚后处理对大鼠肠缺血再灌注损伤的影响[J]. 中华麻醉学杂志,2013, 33 (3) : 357 –359. DOI:10.3760/cma.j.issn.0254-1416.2013.03.026 |
| [7] | Watanabe K, Iwahara C, Nakayama H, et al. Sevoflurane suppresses tumour necrosis factor-alpha-induced inflammatory responses in small airway epithelial cells after anoxia/reoxygenation[J]. Br J Anaesth,2013, 110 (4) : 637 –645. DOI:10.1093/bja/aes469 |
| [8] | Ng C S, Hui C W, Wan S, et al. Lung ischaemia-reperfusion induced gene expression[J]. Eur J Cardiothorac Surg,2010, 37 (6) : 1411 –1420. DOI:10.1016/j.ejcts.2010.01.001 |
| [9] | 李永乐, 安海水, 邓默, 等. 不同浓度七氟烷对急性肺损伤大鼠的保护作用[J]. 中国医药科学,2013, 3 (6) : 24 –25. |
| [10] | 韩军, 宣佳利, 胡浩然, 等. 金丝桃苷预处理减轻大鼠心肌缺血再灌注损伤作用与PI3K/Akt信号通路的关系[J]. 中国中药杂志,2015, 40 (1) : 118 –123. DOI:10.4268/cjcmm20150123 |
| [11] | 陈洪涛, 雷春亮, 李宝金, 等. 七氟烷后处理对大鼠缺血/再灌注损伤心功能和ERK1/2表达的影响[J]. 中国药理学通报,2011, 27 (2) : 258 –264. |
| [12] | Villar J, Blanco J, Blanch L, et al. The ALIEN study: incidence and outcome of acute respiratory distress syndrome in the era of lung protective ventilation[J]. Intensive Care Med,2011, 37 (12) : 1932 –1941. DOI:10.1007/s00134-011-2380-4 |
| [13] | Payne R S, Akca O, Roewer N, et al. Sevoflurane-induced preconditioning protects against cerebral ischemic neuronal damage in rats[J]. Brain Res,2005, 1034 (1/2) : 147 –152. DOI:10.1016/j.brainres.2004.12.006 |
| [14] | Rancan L, Huerta L, Cusati G, et al. Sevoflurane prevents liver inflammatory response induced by lung ischemia-reperfusion[J]. Transplantation,2014, 98 (11) : 1151 –1157. DOI:10.1097/TP.0000000000000408 |
| [15] | Ryter S W, Choi A M. Autophagy in lung disease pathogenesis and therapeutics[J]. Redox Biol,2015, 4 (147) : 215 –225. DOI:10.1016/j.redox.2014.12.010 |
| [16] | Zhang D, Li C, Zhou J, et al. Autophagy protects against ischemia/reperfusion-induced lung injury through alleviating blood-air barrier damage[J]. J Heart Lung Transplant,2015, 34 (5) : 746 –755. DOI:10.1016/j.healun.2014.12.008 |
| [17] | Zhang J, Wang J S, Zheng Z K, et al. Participation of autophagy in lung ischemia-reperfusion injury in vivo[J]. J Surg Res,2013, 182 (2) : e79 –e87. DOI:10.1016/j.jss.2012.11.014 |
| [18] | Schulz R. A new paradigm: cross talk of protein kinases during reperfusion saves life[J]. Am J Physiol Heart Circ Physiol,2005, 288 (1) : H1 –H2. DOI:10.1152/ajpheart.00886.2004 |
| [19] | Xie F, Liu W, Feng F, et al. Apelin-13 promotes cardiomyocyte hypertrophy via PI3K-Akt-ERK1/2-p70S6K and PI3K-induced autophagy[J]. Acta Biochimica et Biophysica Sinica,2015, 47 (12) : 969 –980. DOI:10.1093/abbs/gmv111 |
| [20] | 杜涛, 黄海, 陈欣, 等. 脂多糖通过PI3K/Akt/mTOR通路调控巨噬细胞自噬[J]. 中国病理生理杂志,2014, 30 (4) : 675 –680. DOI:10.3969/j.issn.1000-4718.2014.04.018 |
| [21] | Sahani M H, Itakura E, Mizushima N, et al. Expression of the autophagy substrate SQSTM1/p62 is restored during prolonged starvation depending on transcriptional upregulation and autophagy-derived amino acids[J]. Autophagy,2014, 10 (3) : 431 –441. DOI:10.4161/auto.27344 |
| [22] | Ma X, Liu H, Foyil S R, et al. Impaired autophagosome clearance contributes to cardiomyocyte death in ischemia/ reperfusion injury[J]. Circulation,2012, 125 (25) : 3170 –3181. DOI:10.1161/CIRCULATIONAHA.111.041814 |
| [23] | Zhang Y L, Yao Y T, Fang N X, et al. Restoration of autophagic flux in myocardial tissues is required for cardioprotection of sevoflurane postconditioning in rats[J]. Acta Pharmacol Sin,2014, 35 (6) : 758 –769. DOI:10.1038/aps.2014.20 |



