2. 400014 重庆,重庆医科大学附属儿童医院儿童感染免疫重庆市重点实验室 ;
3. 400016 重庆,重庆医科大学附属第一医院:重症医学科
2. Key Laboratory of Pediatric Infection and Immunology,the Children’s Hospital of Chongqing Medical University, Chongqing,400014,China ;
3. Department of Critical Care Medicine,the First Affiliated Hospital of Chongqing Medical University,Chongqing,400016
动脉粥样硬化是导致多种心血管疾病的一个十分重要的因素,主要表现为血管内膜重建、硬变、损伤导致的血管狭窄,而血管钙化是动脉粥样硬化进展后期的突出表现,是心血管疾病的死亡预测因子[1]。人第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)是一种蛋白/脂肪磷酸酶,为抑癌基因,是蛋白激酶B(protein kinase B,PKB,又称AKT)上游的调节蛋白之一,可以负向调控AKT的活化[2]。研究证实AKT的活化可能参与血管钙化或动脉粥样硬化的形成[3]。文献[4-5]报道,部分敲除PTEN基因或通过化学药物诱导PTEN的过表达可以抑制动脉粥样硬化的进展。然而,目前尚少见血管特异性PTEN敲除在动脉血管钙化作用的研究。本研究主要建立血管特异性PTEN基因敲除小鼠,以研究PTEN在动脉血管钙化中的重要作用。
1 材料与方法 1.1 材料PTENf/f小鼠、SM22α Cre+/-小鼠、ApoE-/-小鼠均购自美国Jackson Laboratory;TRIzolTM试剂、RNA酶抑制剂、MMLV、Oligo(dt)和实时荧光定量PCR混合液均购自美国Invitrogen公司;PTEN抗体购自美国Cell Signaling Technology(9552);Alizarin Red S溶液(pH 4.2) 和β-甘油磷酸盐购自美国Sigma-Aldrich公司;DMEM培养基购自美国Invitrogen公司;引物定制于生工生物工程(上海)股份有限公司;实时荧光定量PCR分析仪购自Bio-Rad公司。
1.2 血管特异性PTEN基因敲除小鼠的构建方法[6]PTEN 5号外显子标记的C57BL/6小鼠(PTENf/f)与SM22α Cre+/-转基因C57BL/6小鼠进行杂交,以获得PTENf/f Cre-/-(PTENf/f)小鼠和PTENf/f Cre+/-(PTEN△/△)小鼠,SM22α Cre+/-基因主要于血管内表达,5号外显子为PTEN磷酸酶编码区域,为PTEN的功能片段,故PTEN△/△为血管特异性PTEN基因敲除。
1.3 ApoE全基因敲除小鼠的喂养8周龄ApoE全基因敲除(ApoE-/-)小鼠分为对照组和高脂饮食组,每组7只。对照组用普通饲料喂养,高脂饮食组用高脂饲料(含21.2%的脂肪和0.2%的胆固醇,Harlan Teklad 饲料,TD88137)喂养,30周后取其主动脉弓,用于Alizarin Red染色和PTEN免疫组化染色。
1.4 离体血管培养由于大部分PTEN△/△小鼠于30 d内死亡,通过体内实验获得血管钙化模型周期至少>6个月,因此只能通过培养4周龄左右的小鼠主动脉进行体外实验评估PTEN敲除后对动脉血管钙化的影响。
将小鼠胸主动脉于无菌条件下分离,无菌PBS冲洗3次,于显微镜下将动脉外膜剥离,并将血管切成3~4 mm长,将其培养于加有1%胎牛血清的钙化培养基中(DMEM中含0.25 mmol/L维生素C和10 mmol/L β-甘油磷酸盐),培养3周后取血管切片用于HE染色、Alizarin Red染色和Von Kossa染色。
1.5 Alizarin Red染色将冰冻切片组织放置于4%多聚甲醛中于室温下固定10 min,双蒸水清洗2~3次,用2%Alizarin Red染料进行着色10~20 s,双蒸水清洗2~3次,于显微镜下观察拍照。
1.6 Von Kossa染色将冰冻切片组织放置于4%多聚甲醛中于室温下固定10 min,双蒸水清洗2~3次,用5%硝酸银溶液着色30 min,双蒸水清洗1次,于显微镜下观察拍照。
1.7 免疫组化将临近于Alizarin Red染色前后3张的冰冻切片组织放置于4%多聚甲醛中固定10 min,PBS清洗后置于0.3%的过氧化氢甲醇溶液中30 min,PBS清洗,0.3%Triton X-100浸泡30 min,PBS清洗,PTEN一抗(1 ∶400)4 ℃孵育过夜,PBS清洗,加入辣根过氧化物酶标记二抗室温孵育2 h,PBS清洗,加入显色液15~30 min,进行免疫组织化学显色,封片,拍照。
1.8 实时荧光定量PCR用TRIzol提取主动脉组织总RNA,紫外分光光度计检测其纯度和浓度。采用合格的RNA标本,按M-MLV 逆转录酶说明书逆转录合成cDNA。然后以SYBR GreenⅠ作为荧光标记物,荧光定量PCR扩增mRNA。Runt相关转录因子2(Runt related transcription factor 2,Runx2)上游引物:5′-CGGCCCTCCCTGAACTCT-3′,下游引物:5′-TGCCTGCCTGGGATCTGTA-3′;骨钙蛋白上游引物:5′-TGCTTGTGACGAGCTATCAG-3′,下游引物:5′-GAGGACAGGGAGGATCAAGT-3′;骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)上游引物:5′-TGACTGGATCGTGGCACCTC-3′,下游引物:5′-CAGAGTCTGCACTATGGCATGGTTA-3′;GAPDH的上游引物:5′-AACACGGAAGGCCATGCCAG-3′,下游引物:5′-TGCATCCTGCACCACCAACT-3′。实时定量PCR仪循环设置:95 ℃ 10 min预变性,95 ℃ 15 s,60 ℃ 60 s,进行40个循环。进行反应后通过扩增曲线和熔解曲线分析,2-△△Ct进行相对定量。
1.9 统计学分析采用SPSS 17.0统计软件进行单因素方差分析,所有数据以x±s来表示,P<0.05代表差异有统计学意义。
2 结果 2.1 小鼠血管钙化后PTEN的表达明显下降8周龄ApoE-/-小鼠通过高脂饮食喂养30周后取主动脉根部,通过Alizarin Red染色评估血管钙化程度。用Image J分析软件评估血管内钙沉积区域和 PTEN表达区域的所占比例。与对照组相比,高脂饮 食组主动脉根血管内钙盐沉积明显增多,血管钙化面积比为对照组的3.5倍[(13.10±1.86)% vs (3.73±1.42)%,P=0.002]。同时,用钙化血管切片前后的3张空白切片行免疫组化评估PTEN的表达情况,结果显示,高脂饮食组血管钙化后PTEN的表达较对照组明显下降[(18.70±2.83)%vs (47.86±3.75)%,P<0.01]。结果见图 1。

|
| A~D:Alizarin Red 染色检测血管内钙盐沉积;E~H:免疫组化检测PTEN的表达情况(S-P);A、B、E、F:对照组;C、D、G、H:高脂饮食组;B、D、F、H:分别是A、C、E、G指定区域的放大图 图 1 小鼠血管钙化后血管内钙盐沉积及其PTEN的表达变化 |
2.2 血管特异性PTEN敲除促进血管钙化
5对4周龄PTEN△/△与PTENf/f小鼠主动脉于钙化培养基中体 外生长3周后,通过Alizarin Red染色和Von Kossa染色评估钙化程度,如图 2所示,PTEN敲除的主动脉几乎全血管钙化,而对照组血管未见明显钙化。
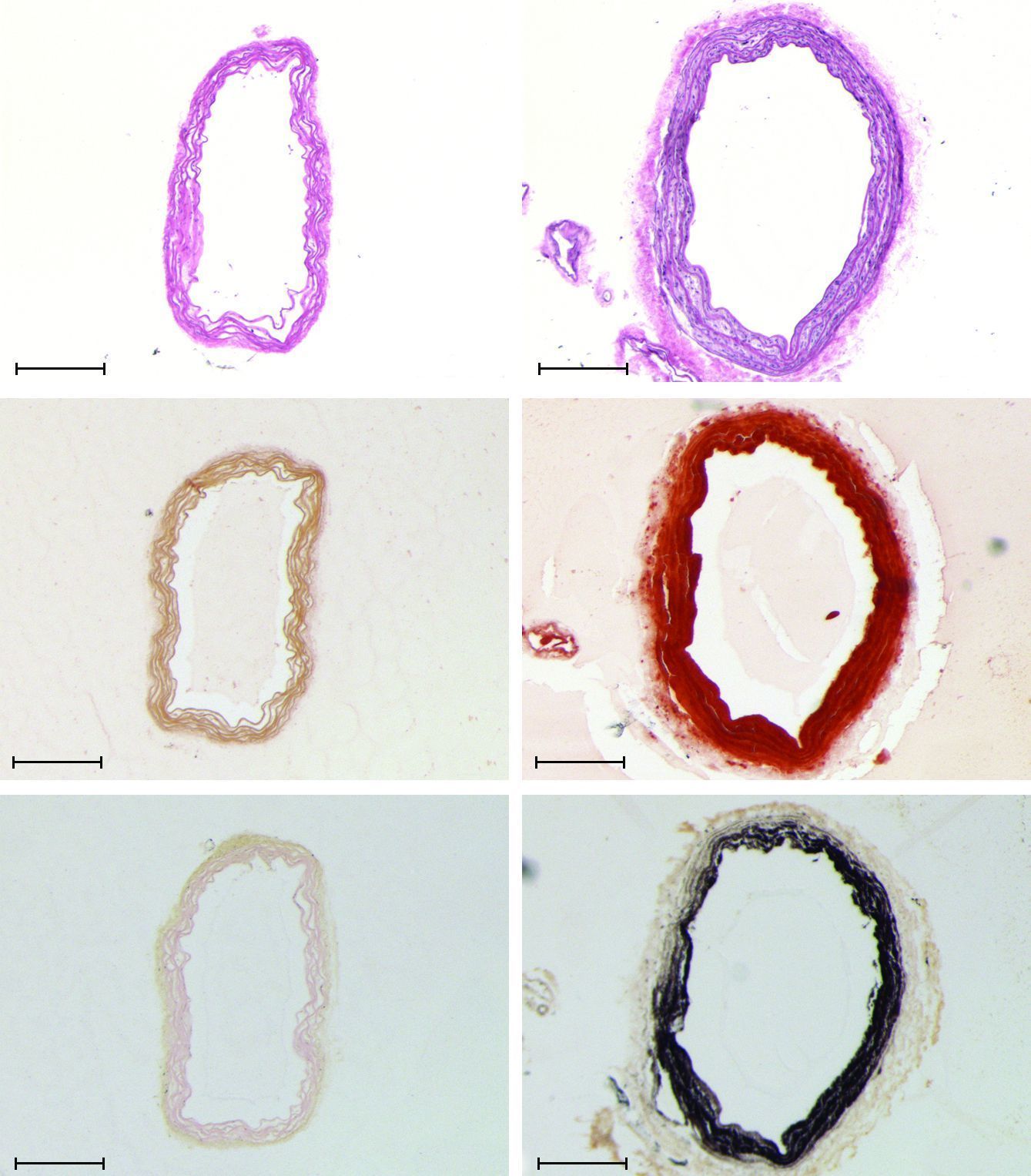
|
| 图 2 血管特异性PTEN敲除促进动脉血管钙化病理学观察 |
2.3 血管特异性PTEN敲除促进钙化标志物的表达
如表 1所示,PTEN敲除后,主动脉组织内血管钙化标志物Runx2、骨钙蛋白和BMP2的表达均升高,差异均具有统计学意义(P<0.05)。
| 钙化标志物 | PTENf/f | PTEN△/△ | P值 |
| Runx2 | 1.00±0.00 | 1.71±0.23 | 0.035 |
| 骨钙蛋白 | 1.00±0.00 | 2.23±0.65 | 0.031 |
| BMP2 | 1.00±0.00 | 2.59±0.31 | 0.028 |
3 讨论
PTEN作为一个蛋白/脂质磷酸酶在不同细胞中发挥不同功能,主要表现为抑癌作用,PTEN在动脉粥样硬化中可能发挥一定作用,如在剪切力介导的大鼠血管内膜增生模型中,过表达PTEN可以减轻血管内膜增生和炎症因子的浸润[1, 4];另外,诱导PTEN过表达可以抑制家兔动脉粥样硬化模型中血管平滑肌细胞的增殖和迁移,从而抑制血管动脉粥样硬化[5]。但也有研究表明,部分敲除PTEN基因对高脂饮食诱导ApoE-/-小鼠形成动脉粥样斑块没有抑制作用[1]。以 上研究均提示PTEN可能在血管动脉粥样硬化中发挥作用,但目前仍存在一定的矛盾及争议,且并无PTEN全基因敲除或组织特异性敲除后的研究论证其在血管动脉粥样硬化中的作用,因此,我们通过构建血管特异性敲除PTEN 5号外显子的小鼠模型来验证我们的设想。
高脂饮食喂养ApoE-/-敲除小鼠是制造动脉粥样硬化模型的重要方法之一。为了解PTEN在动脉粥样硬化中的作用,我们用高脂饲料喂养ApoE-/-小鼠后取动脉粥样硬化血管进行研究,发现其动脉血管钙化更为严重,并且PTEN表达明显下降,提示PTEN可能是动脉血管钙化形成过程中的一个重要调控蛋白,因此我们通过Cre-LoxP重组酶技术构建血管特异性PTEN基因敲除小鼠进一步研究其作用和重要性,结果显示血管特异性PTEN敲除后动脉血管严重钙化,几乎累及全血管,说明PTEN缺失或表达降低对动脉血管钙化形成起着十分关键的作用。
血管钙化主要为动脉粥样硬化形成过程中血管平滑肌细胞(vascular smooth muscle cells,VSMC)向成骨细胞分化后的结局,BMP2、骨钙蛋白和Runx2均是诱导VSMC向成骨细胞分化的重要调节蛋白[7]。BMP家族已被证实在血管生理过程中发挥重要作用。文献[8-10]报道在动脉粥样硬化斑块中发现了大量BMP2的存在,另外研究证实BMP2可以促进VSMC向成骨细胞转化,诱发血管钙化。Runx2是一个多功能转录蛋白,其在调节干细胞向成骨细胞分化中起着重要作用,同时,Runx2还能诱导成骨细胞标志蛋白的表达,如骨钙蛋白、胶原蛋白、BMP2等[11-12]。本研究发现血管特异性PTEN敲除后BMP2、骨钙蛋白和Runx2均显著升高,提示PTEN敲除后可能通过调控VSMC向成骨细胞分化促进血管钙化。
PTEN是AKT上游的调节蛋白,可以负向调控AKT的活化,而大量研究均证实AKT参与动脉血管钙化形成,同时AKT可以上调Runx2的表达,Runx2是一个重要的转录蛋白,可以促进VSMC向成骨细胞分化[3, 13-15]。因此,本研究提示PTEN是动脉血管钙化形成过程中一个重要的调控蛋白,可能通过调控AKT/Runx2信号通路而发挥作用,但其具体机制仍需进一步研究。
| [1] | Bennett M R, Sinha S, Owens G K. Vascular Smooth Muscle Cells in Atherosclerosis[J]. Circ Res,2016, 118 (4) : 692 –702. DOI:10.1161/CIRCRESAHA.115.306361 |
| [2] | Leslie N R, Kriplani N, Hermida M A, et al. The PTEN protein: cellular localization and post-translational regulation[J]. Biochem Soc Trans,2016, 44 (1) : 273 –278. DOI:10.1042/BST20150224 |
| [3] | Abeyrathna P, Su Y. The critical role of Akt in cardiovascular function[J]. Vascul Pharmacol,2015, 74 : 38 –48. DOI:10.1016/j.vph.2015.05.008 |
| [4] | Koide S, Okazaki M, Tamura M, et al. PTEN reduces cuff-induced neointima formation and proinflammatory cytokines[J]. Am J Physiol Heart Circ Physiol,2007, 292 (6) : H2824 –H2831. DOI:10.1152/ajpheart.01221.2006 |
| [5] | Chen W J, Lin K H, Lai Y J, et al. Protective effect of propylthiouracil independent of its hypothyroid effect on atherogenesis in cholesterol-fed rabbits: PTEN induction and inhibition of vascular smooth muscle cell proliferation and migration[J]. Circulation,2004, 110 (10) : 1313 –1319. DOI:10.1161/01.CIR.0000140764.15398.F3 |
| [6] | Lesche R, Groszer M, Gao J, et al. Cre/loxP-mediated inactivation of the murine Pten tumor suppressor gene[J]. Genesis,2002, 32 (2) : 148 –149. DOI:10.1002/gene.10036 |
| [7] | Thompson B, Towler DA. Arterial calcification and bone physiology: role of the bone-vascular axis[J]. Nat Rev Endocrinol,2012, 8 (9) : 529 –543. DOI:10.1038/nrendo.2012.36 |
| [8] | Zhao Y G, Meng F X, Li B W, et al. Gelatinases promote calcification of vascular smooth muscle cells by up-regulating bone morphogenetic protein-2[J]. Biochem Biophys Res Commun,2016, 470 (2) : 287 –293. DOI:10.1016/j.bbrc.2016.01.067 |
| [9] | Zhang M, Sara J D, Wang F L, et al. Increased plasma BMP-2 levels are associated with atherosclerosis burden and coronary calcification in type 2 diabetic patients[J]. Cardiovasc Diabetol,2015, 14 (1) : 1 –9. DOI:10.1186/s12933-015-0214-3 |
| [10] | Derwall M, Malhotra R, Lai C S, et al. Inhibition of bone morphogenetic protein signaling reduces vascular calcification and atherosclerosis[J]. Arteriosclerosis Thrombosis & Vascular Biology,2012, 32 (3) : 613 –622. DOI:10.1161/ATVBAHA.111.242594 |
| [11] | Ruffenach G, Chabot S, Tanguay V F, et al. Role for RUNX2 in Proliferative and Calcified Vascular Lesions in Pulmonary Arterial Hypertension[J]. Am J Respir Crit Care Med,2016 . DOI:10.1164/rccm.201512-2380OC |
| [12] | Bastos Gon alves F, Vo te M T, Hoeks S E, et al. Calcification of the abdominal aorta as an independent predictor of cardiovascular events: a meta-analysis[J]. Heart,2012, 98 (13) : 988 –994. DOI:10.1136/heartjnl-2011-301464 |
| [13] | Pal S N, Golledge J. Osteo-progenitors in vascular calcification: a circulating cell theory[J]. J Atheroscler Thromb,2011, 18 (7) : 551 –559. DOI:10.5551/jat.8656 |
| [14] | McCarty M F, DiNicolantonio J J. The molecular biology and pathophysiology of vascular calcification[J]. Postgrad Med,2014, 126 (2) : 54 –64. DOI:10.3810/pgm.2014.03.2740 |
| [15] | Sun Y, Byon C H, Yuan K, et al. Smooth muscle cell-specific runx2 deficiency inhibits vascular calcification[J]. Circ Res,2012, 111 (5) : 543 –552. DOI:10.1161/CIRCRESAHA.112.267237 |



