2. 200040 上海, 复旦大学附属华山医院:神经外科 ;
3. 200040 上海, 复旦大学附属华山医院:病理科 ;
4. 201203 上海, 通用医疗磁共振科研部
2. Department of Neurosurgery, Affiliated Huashan Hospital of Fudan University, Shanghai, 200040 ;
3. Department of Pathology, Affiliated Huashan Hospital of Fudan University, Shanghai, 200040 ;
4. MR Research Department of GE Healthcare, Shanghai, 201203, China
磁共振弥散加权成像是唯一可用于活体观察组织水分子微观弥散运动的成像方式。自1986年 Le Bihan 等 [1]成功地将该技术应用于人脑以来,基于水分子自由扩散的布朗运动原理(即高斯弥散)而发展起来的弥散加权成像技术已逐渐被应用于肿瘤的临床诊断、分级和治疗评价等各个领域 [2]。然而,完全自由的水分子布朗运动在复杂的人体组织中是不存在的,水分子的扩散受到复杂组织微观结构的阻挡,其扩散方式并不呈高斯分布,因而基于水分子非高斯扩散的后处理模型不断被开发应用,其中就包括拉伸指数模型和基于体素内不相干运动(intravoxel incoherent motion,IVIM)的双指数模型。同时,为了更大程度的探索组织微观结构的弥散特征,多b值序列(enhanced DWI,eDWI)被相应开发,使用的b值范围不断扩大,上限也不断被更新和突破。由最初的低b值(~200 s/mm2)成像 [3]发展到高b值(~2 000,s/mm2) [4-5]和超高b值(2 000~,s/mm2)成像 [6-7];b值个数也由最初的两个发展到十几个 [2, 8],再到几十个 [9]。 然而,相对于单指数弥散加权成像在人脑使用的最佳b值通常为0和1 000 s/mm2[2],双指数及拉伸指数弥散加权成像的最佳b值个数和范围尚不确定,其对应的临床应用可重复性尚未见详尽的分析报道。尽管Bisdas等 [4]在脑胶质瘤的IVIM成像中也对弥散和灌注相关参数进行了可重复性分析,但由于使用设备、参数及b值范围与其他研究 [6-7, 9-10]均不完全相同,不同研究间弥散参数的可重复性并不具可比性。因此,本研究探讨3.0 T磁共振非高斯弥散加权成像(22个b值:0~5 000 s/mm2)双指数和拉伸指数模型在评价正常大脑白质和胶质瘤水分子弥散微环境中应用的可重复性,为高宽b值非高斯弥散加权成像在脑胶质瘤中应用的可重复性提供依据。
1 材料与方法 1.1 病例资料 1.1.1 正常大脑白质非高斯弥散加权成像12名健康志愿者,其中男性8例,女性4例;年龄26~68岁,中位年龄47.5岁,所有志愿者平素体健,扫描前均未有神经系统疾病病史。
1.1.2 胶质瘤非高斯弥散加权成像112例术前可疑胶质瘤患者执行了常规磁共振成像和多b值eDWI扫描。扫描时间均在术前1~8 d,平均3.2 d。其中21例病理诊断非胶质瘤被排除,1例毛细胞星形细胞瘤因病例太少被排除,其他25例由于运动伪影( n=10)、扫描中断 (n=6)、肿瘤实性部分小于10 mm(n=4)和薄壁肿瘤(壁厚小于5 mm,n=5)被排除; 65例经病理确诊的胶质瘤患者,根据2007 WHO 中枢神经系统分级和分类标准,分为Ⅱ级35例,Ⅲ级8例和Ⅳ级22例。年龄18~64岁,平均42.3岁。其中男38例,女27例,检查前均未进行过任何针对胶质瘤的手术和化、放疗治疗。肿瘤的位置,额叶29例(左12,右17),额颞叶8例(左4,右4),颞叶11例(左7,右4),侧脑室4例(左4),额顶叶2例(左右各1),基底节5例(左4,右1),顶叶2例(左右各1),跨胼胝体4例,所有病例均进行了术中iMRI导航下的手术切除和/或立体穿刺活检,其中穿刺14例,完整切除37例,次全切除14例,联合穿刺和手术切除病例2例。
| 序列 | TR/TE(ms/ms) | FA | 矩阵 | FOV(mm2) | ST/IG(mm/mm) | 采集时间(min:s) |
| T1WI | 3 195/24 | 111 | 256×256 | 240 | 4/0 | 1:27 |
| T2WI | 9 185/108 | 142 | 256×256 | 240 | 4/0 | 1:41 |
| T2Flair | 9 491/140 | 111 | 256×256 | 240 | 4/0 | 2:33 |
| eDWI | 4 000/90.6 | 90 | 128×128 | 240 | 4/0 | 7:00 |
| eDWI | 4 000/90.6 | 90 | 128×128 | 240 | 4/0 | 7:00 |
| T1C+ | 8.2/3.2 | 12 | 256×256 | 240/256a | 4/0;1/0a | 1∶40;3:45-4:20a |
| TR:重复时间;TE:回波时间;FA:翻转角;FOV:扫描野;ST:层厚;IG:层间距;a:表示术中磁共振导航扫描序列 | ||||||
1.2 MRI成像 1.2.1 健康大脑白质eDWI成像
所有12名志愿者均在3.0T MRI (GE discovery MR750)设备进行扫描,采用8通道线圈,横断位成像,扫描线平行于前后联合,扫描范围覆盖整个大脑,层厚4 mm,层间距 0 mm,按照相同扫描FOV进行头颅横断位T2Flair、T1WI、T2WI和eDWI(22 b值:0,10,20,30,50,100,150,200,300,400,500,600,800,1 000,1 500,2 000,2 500,3 500,4 000,4 500和5 000 s/mm2;“NEX”值随着b值的增加,设定为从1到4成像,其中eDWI按照完全相同参数设置重复扫描1次,具体参数见表 1。
1.2.2 胶质瘤eDWI成像所有脑胶质瘤患者均在3.0T MRI设备(Discovery MR750,GE Medical Systems,Milwaukee,WI,USA) 进行扫描,采用8通道线圈,均进行了常规横断位MRI(包括T2Flair,T1WI,T2WI)、DWI(b值:0和1 000 s/mm2)和eDWI,T1C+序列扫描(参数设置见表 1)。
1.3 双指数和拉伸指数模型 1.3.1 双指数模型双指数函数计算方程如下:
| $S\left( b \right)/{S_0} = \left[ {\left( {1 -PF} \right) \times \exp \left( { -bDslow} \right)} \right] + \left[ {PF \times \exp \left( { -bDfast} \right)} \right]$ |
双指数函数基于体素内不相干运动理论,其基本思想是假设组织内自由扩散水分子分为快和慢两种成分。S(b)和S 0分别代表不同对应b值得信号强度,S 0代表b值为0 s/mm2时的信号强度;Dslow 和Dfast代表慢和快成分的弥散系数; PF代表快成分所占的分数;所有22 b值被用于拟合,采用分段法,b值 200 s/mm2 作为快慢成分界值,先用高b值部分计算Dslow,然后移去高b值部分,用剩下的低b值部分计算Dfast,然后再计算PF。
1.3.2 拉伸指数模型拉伸指数函数计算方程如下:
| $S\left( b \right) = {S_0}\exp \left\{ { -{{\left( {b \times DDC} \right)}^a}} \right\}$ |
拉伸指数函数是基于每个体素都是由连续分布的若干运动质子组成的质子池。S (b)代表DDC相应b值的信号强度,S 0代表b值为0时的信号强度,DDC(distributed diffusion coefficient)代表分布弥散系数;α代表体素内水分子弥散不均质指数,用于描述弥散信号相对于单指数信号衰减过程的偏离行为,0 ≤α≤1,α越接近1,代表越均质,α越接近于0,代表越不均质。
1.4 图像后处理和感兴趣区定义 1.4.1 图像配准12例健康志愿者和65例胶质瘤eDWI原始数据导入工作站进行MADC计算前,先行导入Matlab R2009a (The Mathworks,Inc.,Natick,MA)程序,使用SPM(statistical parametric mapping)8.0软件包(Wellcome Department of Imaging Neuroscience,London,United Kingdom),执行eDWI序列内图像对齐,所有21个b值图像与b 0对齐,对齐后的Dicom图像再导入Aw4.6工作站,应用Functool 9.4.05中的内置MADC程序分别计算eDWI伪彩图Dslow,Dfast,PF,DDC和α,将各参数伪彩图及常规横断面序列同时选中导入工作站内置IR(integrated registration)配准软件,进行层间配准。
1.4.2 感兴趣区放置 1.4.2.1 健康脑白质ROI放置选取基底节层面(basal ganglion level,BG)和半卵圆中心层面(semiovale centrum level,SO),由两名放射科医师共同决定ROI放置。在MADC程序内将T2Flair作为解剖参考图与各参数伪彩图进行融合,根据T2Flair图像,在基底节层面双侧侧脑室前角前方和后角后方白质内分别放置大小约50 mm2正方形ROI,共4个,ROI按顺时针方向,从左向右依次标记为BG_A_ROI_1至BG_A_ROI_4(A代表第1次eDWI扫描后处理成像),BG_B_ROI_1至BG_B_ROI_4(B代表第2次eDWI扫描后处理成像)(图 1);在半卵圆中心层面,选取健康白质中央区域,在左、右侧分别放置前、后2个大小约 50 mm2正方形ROI,按顺时针方向,从左向右依次标记SO_A_ROI_1至SO_A_ROI_4 和SO_B_ROI_1至SO_B_ROI_4 (图 2);所有ROI放置需结合常规MRI横断位成像,避开白质内T2Flair异常信号区域。

|
| A-H分别表示横断面成像b0图、Dslow、Dfast和PF伪彩图、T2Flair、T1WI、DDC和α伪彩图,粉色方框代表ROI 图 1 基底节层面健康白质 ROI放置示意图 |

|
| A-H分别表示横断面成像b 0图、Dslow、Dfas、PF伪彩图、T2Flair、T1WI、DDC和α伪彩图,粉色方框代表ROI 图 2 半卵圆中心层面健康白质ROI放置示意图 |
1.4.2.2 脑胶质瘤ROI放置
两名放射科医师(均不知道病理诊断结果)分别进行ROI放置 [2, 9]。ROI放置标准:不强化肿瘤以T2Flair作为参考,选择肿瘤最大面积层面对T2Flair高信号区域进行肿瘤ROI勾画 [2]。结合T1WI及T1C+序列,尽量避开囊变及大血管区域(图 3);强化肿瘤将T1C+作为参考,选择肿瘤强化最大面积层面对T1C+强化肿瘤区域进行肿瘤ROI勾画,结合T2Flair,避开囊变及大血管区域(图 4),所有肿瘤ROI分别勾画2次,计算平均值。

|
| A:横断面T2Flair 为解剖参考;B-H分别表示横断位T1C+、Dslow伪彩图、Dfast伪彩图和PF伪彩图、DDC和α伪彩图以及HE病理切片(弥漫型星形胶质瘤WHOⅡ级) 图 3 不强化肿瘤实质ROI勾画方法 |

|
| A:横断面T1C+ 为解剖参考;B-H分别表示横断位T2Flair、Dslow伪彩图、Dfast伪彩图、PF伪彩图、DDC和α伪彩图以及HE病理切片(弥漫型星形细胞瘤WHO Ⅲ级) 图 4 强化肿瘤实质ROI勾画方法 |
1.5 统计学分析
采用SPSS 17.0 (SPSS institute,Chicago,IL,USA) 和Medcalc (MedCalc Software,Mariakerke,Belgium) 统计学软件。各参数测量结果以x±s表示,对基底节层面和半卵圆中心层面的8个ROI内所有参数两次测量差异行配对t检验,计算CV(%)和绘制B-A散点图。65例肿瘤区域参数两次测量行观察者间一致性检验,相关系数ICC(intraclass correlative coefficient)用来评价观察者间测量的一致性(相关性评价ICC:~0.4差或无;>0.4~<0.7中等;>0.7~良好) [16],并计算CV值,P<0.05认为差异有统计学意义。
| ROI | Dslow | Dfast | PF | DDC | α | |
| BG_ROI_1 | 第1次 | 0.36±0.03 | 2.30±0.18 | 0.40±0.03 | 0.65±0.08 | 0.72±0.03 |
| 第2次 | 0.36±0.04 | 2.29±0.19 | 0.40±0.03 | 0.65±0.08 | 0.72±0.02 | |
| P值 | 0.713 | 0.91 | 0.8603 | 0.72 | 0.7 | |
| CV | 1.30 | 3.49 | 0.81 | 1.56 | 1.32 | |
| B-A | -7.4 | -19.6 | -4.7 | -8.9 | -7.7 | |
| BG_ROI_2 | 第1次 | 0.38±0.03 | 2.11±0.14 | 0.41±0.03 | 0.66±0.07 | 0.74±0.03 |
| 第2次 | 0.38±0.03 | 2.11±0.14 | 0.40±0.03 | 0.66±0.07 | 0.73±0.02 | |
| P值 | 0.817 | 0.91 | 0.892 | 0.361 | 0.661 | |
| CV | 1.76 | 3.41 | 2.06 | 1.1 | 1.41 | |
| B-A | -9.8 | -19.8 | -11.8 | -6 | -8.2 | |
| BG_ROI_3 | 第1次 | 0.36±0.03 | 2.21±0.10 | 0.40±0.04 | 0.64±0.08 | 0.72±0.02 |
| 第2次 | 0.36±0.03 | 2.23±0.10 | 0.40±0.04 | 0.64±0.08 | 0.72±0.02 | |
| P值 | 0.689 | 0.97 | 0.622 | 0.47 | 0.781 | |
| CV | 1.87 | 4.46 | 1.29 | 1.55 | 1.72 | |
| B-A | -11.4 | -25.1 | -7.7 | -9.2 | -10 | |
| BG_ROI_4 | 第1次 | 0.37±0.03 | 2.08±0.23 | 0.39±0.03 | 0.63±0.05 | 0.75±0.04 |
| 第2次 | 0.37±0.02 | 2.08±0.19 | 0.38±0.03 | 0.63±0.05 | 0.75±0.03 | |
| P值 | 0.447 | 0.845 | 0.209 | 0.938 | 0.496 | |
| CV | 3.09 | 4.68 | 2.46 | 1.96 | 1.99 | |
| B-A | -18.5 | -29 | -13.6 | -11.6 | -11 |
| ROI | Dslow | Dfast | PF | DDC | α | |
| SO_ROI_1 | 第1次 | 0.34±0.02 | 2.19±0.14 | 0.39±0.02 | 0.60±0.04 | 0.72±0.02 |
| 第2次 | 0.34±0.02 | 2.22±0.15 | 0.39±0.02 | 0.60±0.04 | 0.71±0.02 | |
| P值 | 0.55 | 0.424 | 0.866 | 0.803 | 0.855 | |
| CV | 1.8 | 3.45 | 1.46 | 1.54 | 1.23 | |
| BA-LA | -10.3 | -18.8 | -8.4 | -8.8 | -6.9 | |
| SO_ROI_2 | 第1次 | 0.35±0.02 | 2.22±0.07 | 0.38±0.02 | 0.61±0.05 | 0.72±0.01 |
| 第2次 | 0.34±0.02 | 2.19±0.12 | 0.38±0.02 | 0.58±0.06 | 0.73±0.02 | |
| P值 | 0.126 | 0.35 | 0.165 | 0.86 | 0.227 | |
| CV | 3.96 | 2.55 | 2.37 | 4.56 | 1.65 | |
| BA-LA | -18.2 | -14.4 | -12.7 | -26.3 | -7.6 | |
| SO_ROI_3 | 第1次 | 0.33±0.03 | 2.22±0.11 | 0.38±0.03 | 0.58±0.07 | 0.71±0.02 |
| 第2次 | 0.33±0.03 | 2.21±0.08 | 0.38±0.02 | 0.58±0.06 | 0.71±0.02 | |
| P值 | 0.18 | 0.78 | 0.32 | 0.88 | 0.47 | |
| CV | 0.94 | 2.49 | 1.8 | 1.33 | 0.96 | |
| BA-LA | -5.1 | -14.3 | -9.6 | -7.7 | -5.5 | |
| SO_ROI_4 | 第1次 | 0.34±0.03 | 2.24±0.09 | 0.38±0.02 | 0.60±0.07 | 0.71±0.02 |
| 第2次 | 0.35±0.04 | 2.23±0.15 | 0.38±0.03 | 0.60±0.07 | 0.72±0.03 | |
| P值 | 0.151 | 0.706 | 0.213 | 0.728 | 0.124 | |
| CV | 3.65 | 3.18 | 2.58 | 3.95 | 1.54 | |
| BA-LA | -19.5 | -18.3 | -13.9 | -23.5 | -7.9 |
2 结果 2.1 健康脑白质eDWI可重复性、B-A散点图及变异系数 2.1.1 基底节层面
参数2次测量结果见表 2,各参数Dslow、Dfast、PF、DDC及α配对t检验结果差异均无统计学意义(P>0.05)。所有参数变异系数均小于5%,其中Dfast变异系数最大,在3.41%~4.68%之间。B-A散点图各个ROI两次测量差值绝大部分(≥11/12)均位于两次测量差值的95%一致性范围内。
2.1.2 半卵圆中心层面参数2次测量结果见表 3,配对t检验各弥散参数在4个ROI差异均无统计学意义(P>0.05);所有参数各ROI的CV均小于5.0%,其中α变异最小,所有ROI均小于2.0%,Dfast的CV最大,在2%~5%之间波动;B-A图各个参数测值绝大部分(≥11/12)均位于95%一致性范围内。
2.2 胶质瘤eDWI观察者间测量一致性及变异系数各参数Dslow、Dfast、PF、DDC及α肿瘤区域观察者间ICC值均大于0.75(P<0.001);Dfast和PF较其他参数CV值高,并且在Ⅳ级胶质瘤最高,均大于10%;其次是DDC,CV值由Ⅱ级至Ⅳ级逐渐增大;Dslow和α较其他参数CV值小,α在所有参数中CV值最小,在Ⅱ~Ⅳ级胶质瘤中CV值均小于2%;其次为Dslow,变化范围在3%~5%之间,见图 5。
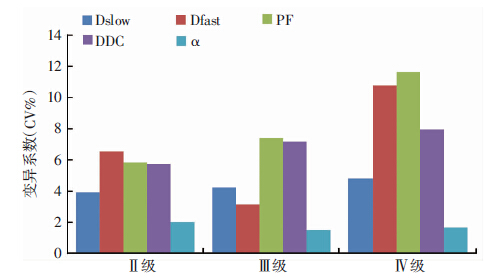
|
| 图 5 胶质瘤观察者之间变异系数测量 |
3 讨论
磁共振多b值加权成像近年来在胶质瘤的研究逐渐增多,以基于IVIM理论的双指数模型应用最多 [4, 6, 11-12],合理的b值选择是双指数函数应用成功的关键。通常,IVIM的拟合以200 s/mm2为界,将全部弥散信号分为快弥散(~200 s/mm2)和慢(真)弥散(200~ s/mm2)两部分。超高b值(2 000~ s/mm2)的使用和持续突破 [6-7],使得慢弥散能探测到的组织水分子的扩散距离不断缩短,弥散相关的微观组织结构观察范围也从细胞、细胞间隙延伸至亚细胞结构,如细胞膜和细胞内蛋白结构对水分子的吸附 [2]。同时,快弥散部分b值的合理选择也是毛细血管灌注信息成功评价的关键。尤其是0~50 s/mm2范围,较少的b值个数不足以探测组织毛细血管灌注信息 [4, 8, 10]。因此,本研究设计了更宽范围(22个b值,包含200 s/mm2以下8个b值:0,10,20,30,50,100,150,200;200~ 2 000 s/mm2之间8个b值:300,400,500,600,800,1 000,1 500和2 000以及2 000~5 000之间6个b值: 2 500,3 000,3 500,4 000,4 500和5 000)和更高上限值(b=5 000 s/mm2)的eDWI序列和相应优化的参数设计,双指数和拉伸指数模型在健康大脑白质和胶质瘤的可重复性被相应评价。
人类大脑健康白质IVIM双指数模型在不同的研究间使用完全相同的eDWI参数设计几乎没有。Bisdas等 [4]应用eDWI序列(b值范围:0,5,10,20,30,40,60,80,90,100,200,700,1 000,1 300 s/mm2)对8例脑胶质瘤病人两天内在同一台磁共振设备上进行了重复扫描,健康白质的变异系数Dslow,Dfast和PF都在8%以下。而本研究结果显示所有参数变异系数均在5%以下,明显小于前者。原因可能是两项研究eDWI序列重复扫描的时间间隔不同,本研究的两次扫描时间间隔只有几分钟,影响快速弥散的生理参数变化可能相对较小;另外,本研究两次扫描的空间位置参数实行了运动校正和严格配准,空间位置误差引起的参数变异相对较小。同时,结果显示在不同的ROI白质的变异系数并不完全相同,靠近侧脑室后角和半卵圆中心偏后方白质变异系数要大于侧脑室前角旁和半卵圆中心偏前方白质;不同的参数变异系数也不相同,其中Dfast变异系数较其他参数偏大。这与Iima等 [9]动物研究的结果相似,Dfast的标准差较大,准确性也较其他参数差。而关于拉伸指数模型在健康人脑中应用的研究较少,本研究DDC和α测值变异系数均小于5%,具有很好的可重复性。理论上DDC和α是所有b值参与拟合,相对于双指数函数的分段拟合,尤其是Dfast,不容易受到脑脊液快弥散成分的干扰,因此对于ROI内少量质子池受到相邻弥散成分的干扰不如Dfast或者其他参数那样敏感。
磁共振多b值弥散加权成像相对于人体其他部位,最早应用于人类大脑,头颅相对于其他部位如肝脏 [13]、肾脏 [14]及胰腺 [15]等不容易受到呼吸等相干运动的影响,因而可靠性相对较高。然而eDWI序列,由于扫描b值个数增多扫描时间也相应延长,对于不能耐受或者重症胶质瘤患者相对于健康成人扫描成功率会相应降低。然而,尽管eDWI序列延长了扫描时间,可能导致数据采集的失败,但Kim等 [16]对肝脏恶性肿瘤的研究提示多b值弥散技术比传统双b值可重复性更好。
尽管各级胶质瘤Dfast和PF变异系数均大于5.0,甚至在GBM中PF变异系数达到11.5,但相对于人体其他部位的肿瘤,如肝脏恶性肿瘤Dfast达到67.7 (6.1~173.1),即使正常肝脏仍然高达50.3 (0.9~157.2),而相应瘤区PF也高达50.2 (15.4~118.8),相应正常肝实质也达30.6 (1.9~104.2) [16],脑胶质瘤Dslow,Dfast和PF可重复性要远高于肝脏。在脑胶质瘤相似研究中,Bisdas等 [4]采用最高上限1 300 s/mm2,共14个b值(0,5,10,20,30,40,60,80,90,100,200,700,1 000,1 300)对胶质瘤实质区域进行了IVIM研究,变异系数PF(f) 为16.1,Dfast(D*)为13.8,Dslow(D)为7.0,较本研究结果稍大,这可能与较小的样本、不同的磁共振设备以及扫描参数设置等多个因素有关 [17-18]。不均质指数α在所有参数中变异最小,与先前大脑正常白质研究结果相似,同时在胶质瘤观察者间一致性检验中,观察者间一致性最好。DDC变异度介于快慢弥散成分之间,由于体素内所有质子池均参与DDC的拟合,所以不像变异度较大的Dfast,因为只拟合低b值部分,更容易受到血流及脑脊液等快弥散成分的干扰。随着胶质瘤级别增加,各参数尽管一致性表现良好,但是除不均质指数α以外,其他参数变异系数均逐渐增大,尤其是灌注相关参数Dfast和PF,这可能是由于高级别胶质瘤的新生肿瘤血管丰富、大量微囊变以及坏死成分导致肿瘤实性区域成分复杂,这些成分均是影响Dfast和PF的重要因素。因此,尽管各参数在健康脑白质的可重复性均表现良好,但在脑胶质瘤表现不尽相同,相对于其他参数,α测量可重复性不易受胶质瘤级别的影响,具有较好的临床应用前景。
| [1] | Le Bihan D, Breton E, Lallemand D, et al. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders[J]. Radiology,1986, 161 (2) : 401 –407. DOI:10.1148/radiology.161.2.3763909 |
| [2] | Le Bihan D. Apparent diffusion coefficient and beyond: what diffusion MR imaging can tell us about tissue structure[J]. Radiology,2013, 268 (2) : 318 –322. DOI:10.1148/radiol.13130420 |
| [3] | Le Bihan D, Breton E, Lallemand D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J]. Radiology,1988, 168 (2) : 497 –505. DOI:10.1148/radiology.168.2.3393671 |
| [4] | Bisdas S, Koh T S, Roder C, et al. Intravoxel incoherent motion diffusion-weighted MR imaging of gliomas: feasibility of the method and initial results[J]. Neuroradiology,2013, 55 (10) : 1189 –1196. DOI:10.1007/s00234-013-1229-7 |
| [5] | Bennett K M, Schmainda K M, Bennett R T, et al. Characterization of continuously distributed cortical water diffusion rates with a stretched-exponential model[J]. Magn Reson Med,2003, 50 (4) : 727 –734. DOI:10.1002/mrm.10581 |
| [6] | Hu Y C, Yan L F, Wu L, et al. Intravoxel incoherent motion diffusion-weighted MR imaging of gliomas: efficacy in preoperative grading[J]. Sci Rep,2014, 4 : 7208 . DOI:10.1038/srep07208 |
| [7] | Bai Y, Lin Y, Tian J, et al. Grading of Gliomas by Using Monoexponential, Biexponential, and Stretched Exponential Diffusion-weighted MR Imaging and Diffusion Kurtosis MR Imaging[J]. Radiology,2016, 278 (2) : 496 –504. DOI:10.1148/radiol.2015142173. |
| [8] | Bisdas S, Braun C, Skardelly M, et al. Correlative assessment of tumor microcirculation using contrast-enhanced perfusion MRI and intravoxel incoherent motion diffusion-weighted MRI: is there a link between them?[J]. NMR Biomed,2014, 27 (10) : 1184 –1191. DOI:10.1002/nbm.3172 |
| [9] | Iima M, Reynaud O, Tsurugizawa T, et al. Characterization of glioma microcirculation and tissue features using intravoxel incoherent motion magnetic resonance imaging in a rat brain model[J]. Invest Radiol,2014, 49 (7) : 485 –490. DOI:10.1097/RLI.0000000000000040 |
| [10] | Federau C, Meuli R, O'Brien K, et al. Perfusion measurement in brain gliomas with intravoxel incoherent motion MRI[J]. AJNR Am J Neuroradiol,2014, 35 (2) : 256 –262. DOI:10.3174/ajnr.A3686 |
| [11] | Woo S, Lee J M, Yoon J H, et al. Intravoxel incoherent motion diffusion-weighted MR imaging of hepatocellular carcinoma: correlation with enhancement degree and histologic grade[J]. Radiology,2014, 270 (3) : 758 –767. DOI:10.1148/radiol.13130444 |
| [12] | Togao O, Hiwatashi A, Yamashita K, et al. Differentiation of high-grade and low-grade diffuse gliomas by intravoxel incoherent motion MR imaging[J]. Neuro Oncol,2016, 18 (1) : 132 –41. DOI:10.1093/neuonc/nov147 |
| [13] | Kakite S, Dyvorne H, Besa C, et al. Hepatocellular carcinoma: short-term reproducibility of apparent diffusion coefficient and intravoxel incoherent motion parameters at 3.0T[J]. J Magn Reson Imaging,2015, 41 (1) : 149 –156. DOI:10.1002/jmri.24538 |
| [14] | Rheinheimer S, Stieltjes B, Schneider F, et al. Investigation of renal lesions by diffusion-weighted magnetic resonance imaging applying intravoxel incoherent motion-derived parameters—initial experience[J]. Eur J Radiol,2012, 81 (3) : e310 –e316. DOI:10.1016/j.ejrad.2011.10.016 |
| [15] | Klauss M, Lemke A, Grunberg K, et al. Intravoxel incoherent motion MRI for the differentiation between mass forming chronic pancreatitis and pancreatic carcinoma[J]. Invest Radiol,2011, 46 (1) : 57 –63. DOI:10.1097/RLI.0b013e3181fb3bf2 |
| [16] | Kim S Y, Lee S S, Park B, et al. Reproducibility of measurement of apparent diffusion coefficients of malignant hepatic tumors: effect of DWI techniques and calculation methods[J]. J Magn Reson Imaging,2012, 36 (5) : 1131 –1138. DOI:10.1002/jmri.23744 |
| [17] | Cui Y, Ma L, Chen X, et al. Lower apparent diffusion coefficients indicate distinct prognosis in low-grade and high-grade glioma[J]. J Neurooncol,2014, 119 (2) : 377 –385. DOI:10.1007/s11060-014-1490-6 |
| [18] | Rydhog A S, van Osch M J, Lindgren E, et al. Intravoxel incoherent motion (IVIM) imaging at different magnetic field strengths: what is feasible?[J]. Magn Reson Imaging,2014, 32 (10) : 1247 –1258. DOI:10.1016/j.mri.2014.07.013 |



