三磷酸腺苷结合盒转运蛋白G亚家族成员2(ATP binding cassette subfamily G member 2,ABCG2)又称乳腺癌耐药蛋白(breast cancer resistance protein,BCRP),能够通过外排泵作用将细胞内的药物主动转运至细胞外,介导多药耐药的形成[1-2]。研究发现ABCG2的高表达与肿瘤患者临床化疗耐药和复发转移有关,且在一定程度上影响患者的预后[3-4]。高表达ABCG2的非小细胞肺癌(non small-cell lung cancer,NSCLC)患者对含铂类的一线化疗方案反应率低,总体生存期(overall survival,OS)和无进展生存期(progression-free-survival,PFS)均明显缩短[5]。此外,ABCG2在肿瘤干细胞SP表型的形成和维持中也发挥着重要作用,可作为肿瘤干细胞的生物标志物之一,是临床极具潜力的治疗靶点[6]。
分子靶向治疗是当前肺癌治疗的研究热点,也是最具前景的抗肿瘤治疗方法。以单克隆抗体为主的基因工程抗体作为肿瘤靶向治疗的手段已应用于临床并取得了较好的疗效[7]。其中单链抗体(scFv)由于其具有相对分子质量小、渗透快、靶部位结合力强、清除迅速、具有较好的药代动力学特征和全人源性的特点,已成为最有应用前景的重组抗体形式[8-9]。
本研究以ABCG2为靶点,前期已利用噬菌体展示肽库技术成功筛选得到ABCG2特异性全人源肺腺癌scFv[10]。现拟进一步检测scFv的抗肿瘤作用并通过放射性核素标记scFv后行裸鼠体内生物分布和放免显像研究,探索其代谢动力学特征,为后续临床肺腺癌的分子影像诊断、肺腺癌肿瘤干细胞的体内可视化研究及靶向抗体制剂开发提供依据。
1 材料与方法 1.1 材料人肺腺癌A549细胞株为重庆市分子肿瘤及表观遗传学重点实验室惠赠;抗ABCG2人源肺腺癌噬菌体scFv为本实验室自行制备;鼠抗ABCG2单克隆抗体 购自Abcam公司;兔抗β-actin、Ki-67和Cleaved Caspase 3单克隆抗体、HRP-羊抗兔及羊抗鼠二抗均购自Cell Signaling Technology公司;超敏免疫组化检测试剂盒为北京中杉金桥公司产品;胰蛋白酶、胎牛血清、RPMI 1640购自Gibco公司;放射性核素131I购自中国原子能科学研究院;SN-697型伽马放射免疫计数器为上海核所日環光电仪器公司产品;24只4~6周龄BALB/c裸鼠(体质量18~20 g)购自重庆医科大学实验动物中心;其他相关试剂均为国产分析纯。
1.2 方法 1.2.1 Western blot检测细胞ABCG2蛋白表达A549细胞经不同浓度scFv处理24 h后,按照凯基蛋白样本提取试剂盒操作说明提取各组细胞总蛋白,BCA法测定所提蛋白浓度。制备蛋白样品,行SDS-PAGE电泳后将蛋白转移到PVDF膜,5%脱脂牛奶室温封闭2 h,TBST洗膜3次后分别加入一抗ABCG2(1 :1 000)和β-actin(1 :2 000),4 ℃孵育过夜。次日,TBST洗膜3次后加入相应HRP标记二抗,室温孵育2 h,TBST洗膜3次,化学发光试剂盒显影,凝胶成像仪曝光成像,结果经Image J软件进行图像分析和灰度值计算。以β-actin对目的蛋白进行标准化。
1.2.2 CCK-8检测细胞增殖变化取对数期A549细胞以5×103/孔接种于96孔板,37 ℃孵箱内培养过夜。细胞贴壁后,加入纯化后的scFv(10 μg/孔)37 ℃ 孵箱内继续培养24 h。同时设立阴性对照和空白对照。根据CCK-8试剂盒操作说明,于不同时间点向每孔加入10 μL CCK-8试剂,37 ℃避光孵育2 h,酶标仪检测波长450 nm处光密度值[D(450)]。计算生长抑制率并绘制细胞生长曲线。
1.2.3 流式细胞术检测细胞周期及凋亡A549细胞分别与不同浓度抗ABCG2 scFv(0、10、20 μg)共同孵育48 h后,胰酶消化并收集细胞,冰预冷PBS洗涤细胞2次后加入70%冰预冷的乙醇于4 ℃冰箱固定细胞过夜。次日,PBS洗涤细胞2遍,PI/RNase试剂重悬细胞后于37 ℃染色细胞30 min。流式细胞仪在488 nm处检测细胞各个时期DNA含量,计算细胞周期分布情况。
A549细胞与不同浓度抗ABCG2 scFv(0、10、20 μg)共同孵育24 h后,胰酶消化并收集细胞,冰预冷PBS洗涤细胞2次后与Annexin V-FITC/PI室温避光反应15 min,流式细胞仪检测细胞凋亡情况。
1.2.4 scFv的放射性核素标记及免疫学活性检测采用氯胺T法对可溶性scFv进行131I放射性核素标记,scFv 50 μL(1 mg/mL)加入35 μL的131I(37 kBq/μL),混合反应3 min。加入氯胺T(1 mg/mL)100 μL,反应40 s。再与100 μL偏重亚硫酸钠(2 mg/mL)继续混合反应1 min,最后用100 μL的1%碘化钾终止反应。核素标记后的scFv经Sephadex G50凝胶柱进行过滤和标记后的纯化。剂量依赖的细胞结合实验进一步检测标记后抗体的免疫学活性,以scFv和游离131I的混合物作为对照。
1.2.5 scFv裸鼠体内生物分布研究及SPECT/CT显像新鲜分离的A549细胞以2×106/100 μL PBS密度皮下接种至裸鼠背部右肩胛区。当移植瘤体积达200 mm3左右时,将200 μL 131I标记的scFv经尾静脉注射至裸鼠体内(约340 kBq/g),分别在注射后6、12、24、48 h处死裸鼠。收集裸鼠的肿瘤、心、肝、脾、肺、肾、脑、骨、胃肠、肌肉等主要组织器官及眼球血,称量,γ放射免疫计数器检测各组织标本的每克组织注射剂量百分率(%ID/g),分析scFv在裸鼠体内的代谢动力学特征及对肿瘤靶部位的特异性结合能力。
SPECT显像时,荷瘤鼠提前3 d给予含1%KI的饮用水封闭甲状腺,后经尾静脉注射200 μL 131I标记的scFv,于既定时间点行SPECT扫描(SPECT-CT Symbia T2,西门子,德国),与CT图像融合后动态观察scFv对移植瘤的特异性结合情况。
1.2.6 裸鼠移植瘤实验新鲜分离的A549细胞以2×106/100 μL PBS的密度皮下接种至裸鼠背部。当肿瘤体积达200 mm3左右时,将裸鼠分为对照组(生理盐水组)和scFv处理组。scFv剂量为10 mg/kg,腹腔注射,每周2次。观察各组移植瘤生长变化情况。
收集肿瘤组织标本,福尔马林溶液固定过夜,石蜡包埋组织样本后行病理切片。按照免疫组化试剂盒操作说明以Ki-67(1 :300)和Cleaved Caspase 3(1 :200)为一抗分别检测各组样本的增殖和凋亡情况。
1.3 统计学分析实验至少重复3次,数据以x±s表示,采用统计软件SPSS 19.0分析,计量资料用t检验,计数资料用χ2检验。P<0.05为差异有统计学意义。
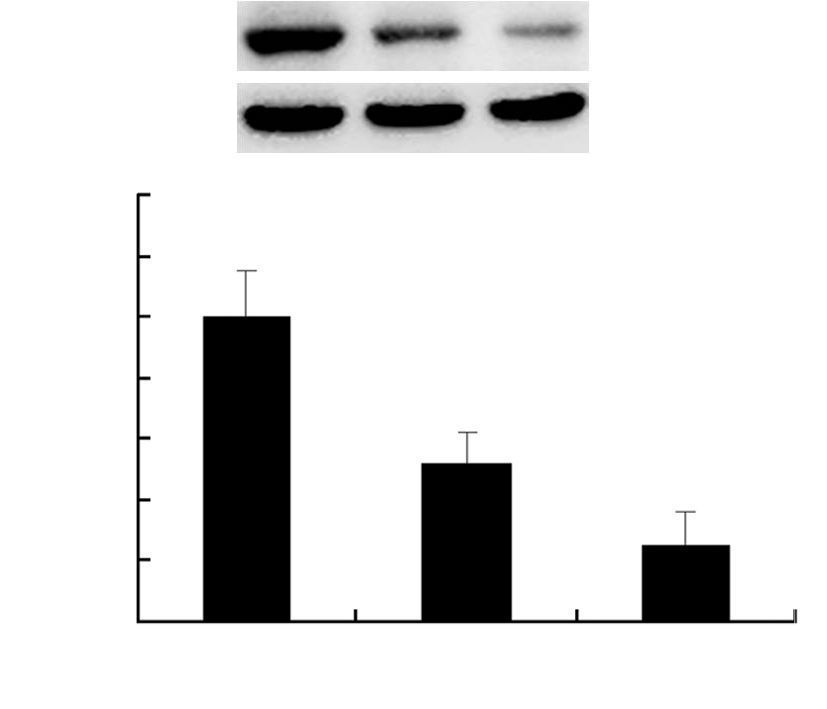
2 结果 2.1 scFv对肺腺癌细胞ABCG2蛋白表达的影响Western blot检测结果显示,A549细胞经scFv处理后其ABCG2蛋白表达水平呈剂量依赖性降低,差异有统计学意义(P<0.05,图 1),表明该scFv能有效阻断肺腺癌细胞ABCG2蛋白的表达。
|
| A:Western blot检测结果;B:半定量分析结果 1:对照组;2:scFv 10 μg处理组;3:scFv 20 μg处理组 a:P<0.05,b:P<0.01,与对照组比较 图 1 scFv对肺腺癌细胞ABCG2蛋白表达的影响 |
2.2 scFv对肺腺癌细胞的体外增殖抑制
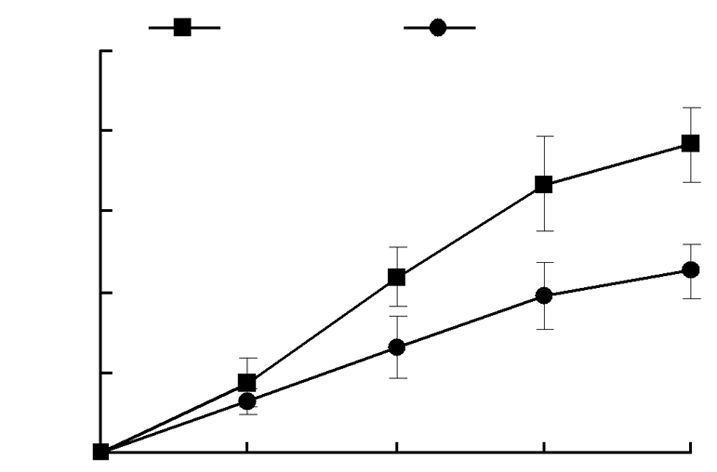
CCK-8检测结果显示,scFv(IC50剂量)对肺腺癌A549细胞的生长增殖呈现出时间依赖性抑制作用,与对照组相比scFv处理组细胞增殖速率减慢,生长迟滞,生长曲线相对平缓(图 2)。
|
| 图 2 scFv对肿瘤细胞生长的抑制作用 |
2.3 scFv对肺腺癌细胞的周期和凋亡的影响
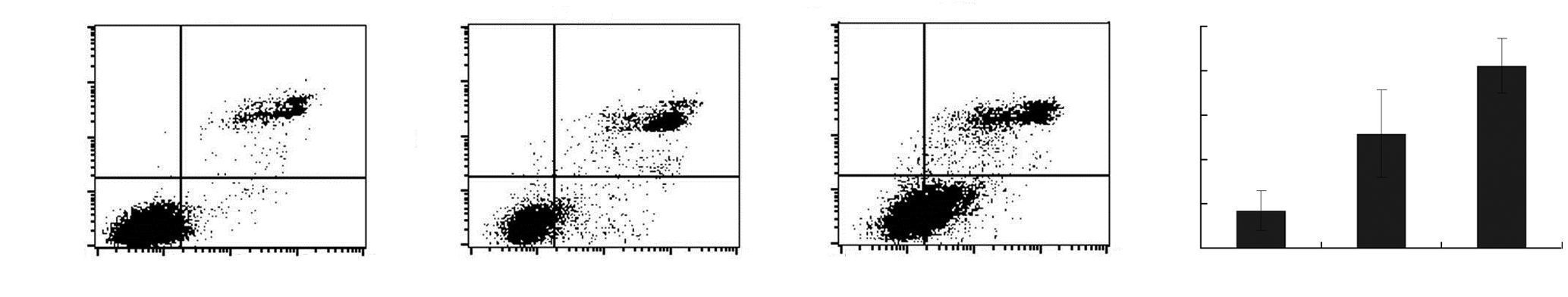
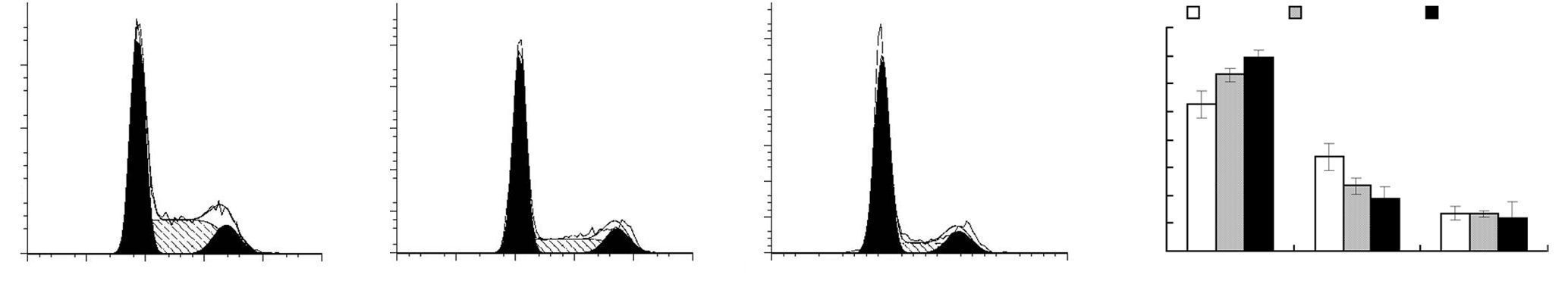
流式细胞术检测肺腺癌细胞经scFv作用后的凋 亡和周期变化情况,结果显示,经scFv处理后细胞凋亡率显著升高[(41.17±6.10)% vs (8.49±4.54)%],且细胞周期明显阻滞于G1期[(69.44±2.48)% vs (52.47± 4.86)%,P<0.05,图 3、4]。
|
| A~C:分别为对照组、scFv 10 μg处理组和scFv 20 μg处理组细胞凋亡检测结果;D:半定量分析结果 a:P<0.05,b:P<0.01,与对照组比较 图 3 流式细胞术检测scFv对细胞凋亡的影响 |
|
| A~C:分别为对照组、scFv 10 μg处理组和scFv 20 μg处理组细胞周期检测结果;B:半定量分析结果 a:P<0.05,b:P<0.01,与对照组比较 图 4 流式细胞术检测scFv对细胞周期的影响 |
2.4 scFv在裸鼠体内生物分布及SPECT/CT显像
131I标记的scFv在体外显示出对肺腺癌细胞剂量依赖性的特异性结合(图 5)。裸鼠体内生物分布研究结果显示,注射131I标记的scFv 6 h后,该抗体就显示出对肿瘤组织的特异性结合,且随时间延迟,相对摄取量逐渐增加;瘤/血、瘤/肌肉放射比值逐渐升高,均在第24小时达到峰值,随后降低;放射活性在脑组织的浓聚是最低的,瘤/脑放射性比值从6~24 h明显增加,是相同时间点瘤/肌肉放射比值的5倍(表 1)。SPECT/CT显像结果进一步证实了131I标记的scFv的肿瘤靶部位特异性内摄。但由于肝、肾及胃肠部位的信号残存,在24 h才观察到了最清晰的特异性显像,并且与瘤/血、瘤/肌肉和瘤/脑放射比值达到峰值的时间点一致(图 6)。

|
| 图 5 131I标记的scFv对肺腺癌细胞特异性结合能力检测 |
| 组织 | 6 h | 12 h | 24 h | 48 h |
| 肿瘤 | 24.61±2.21 | 13.70±2.68 | 4.91±0.95 | 1.23±0.45 |
| 血 | 19.41±3.14 | 6.02±2.18 | 1.67±0.33 | 0.74±0.07 |
| 心 | 14.34±3.18 | 7.03±2.33 | 1.68±0.90 | 0.79±0.37 |
| 肝 | 18.81±4.69 | 10.20±5.00 | 3.58±0.56 | 0.85±0.20 |
| 脾 | 17.41±4.50 | 9.01±2.41 | 3.35±0.96 | 0.89±0.07 |
| 肺 | 18.38±2.71 | 10.02±3.01 | 3.10±1.02 | 0.91±0.34 |
| 肾 | 21.16±2.69 | 12.49±2.73 | 3.14±0.95 | 0.80±0.26 |
| 脑 | 2.89±1.12 | 0.79±0.16 | 0.24±0.07 | 0.09±0.02 |
| 胃肠 | 19.22±1.69 | 12.36±2.07 | 3.81±0.64 | 0.86±0.41 |
| 骨 | 11.72±2.32 | 5.07±1.80 | 1.82±0.23 | 0.46±0.14 |
| 肌肉 | 8.98±1.25 | 4.41±0.80 | 1.19±0.13 | 0.41±0.09 |
| 比值比 | ||||
| 瘤/血 | 1.28±0.17 | 2.38±0.49 | 3.03±0.91 | 1.64±0.42 |
| 瘤/脑 | 9.21±2.73 | 17.41±2.08 | 21.26±4.36 | 13.42±2.47 |
| 瘤/肌肉 | 2.80±0.61 | 3.13±0.47 | 4.17±1.02 | 3.30±1.94 |

|
| ↑:移植瘤 A:荷瘤鼠CT显像;B:荷瘤鼠SPECT/CT融合显像 图 6 131I标记的scFv在裸鼠体内24 h的CT及SPECT/CT显像 |
2.5 scFv体内抗肿瘤活性
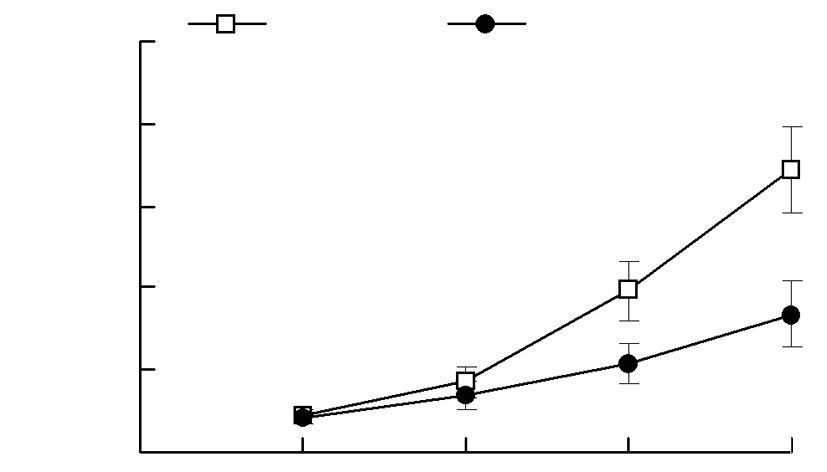
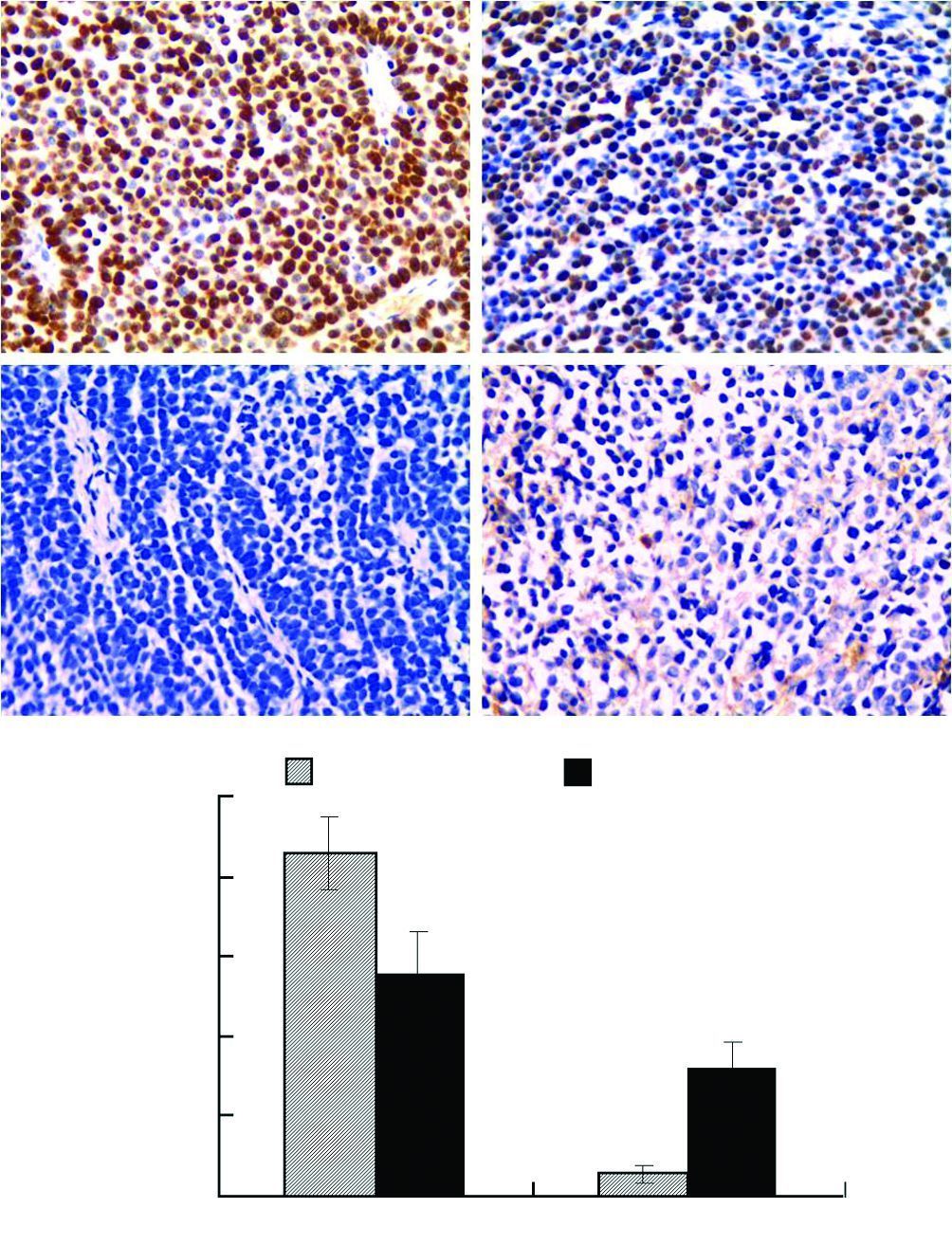
scFv处理组肿瘤体积明显小于对照组(图 7)。免疫组化结果进一步表明:与对照组相比,scFv处理组的瘤体组织凋亡指标Cleaved Caspase 3表达明显增高,而反映增殖活性的Ki-67相对表达明显降低(P<0.05,P<0.01),也从组织学上证实了scFv对肿瘤细胞的增殖抑制及促凋亡作用(图 8)。
|
| 图 7 scFv对肿瘤体积变化的影响 |
|
| A:免疫组化染色(S-P ×400);B:半定量分析结果 a:P<0.05,b:P<0.01,与对照组比较 图 8 免疫组织化学法检测移植瘤的增殖和凋亡活性 |
3 讨论
噬菌体展示肽库技术能够在体外模拟体内抗体的制备过程,实现了抗体基因型和表现型的统一,且具有强大的筛选功能,可以从初级抗体库中筛选出高亲和力的特异性抗体,在临床肿瘤靶向抗体制剂的开发方面显示出强大的生命力[11-13]。相比于多克隆抗体、人鼠嵌合抗体及其他小分子靶向制剂,scFv除了具备良好的肿瘤细胞靶向作用外,还具有制备简便、高效稳定并兼具全人源化的特性,避免了传统抗体应用中存在人抗鼠抗体反应的风险。本研究团队前期已成功利用噬菌体展示技术制备并筛选出了多药耐药蛋白ABCG2特异性人源肺腺癌scFv,经检测该scFv能够 相对特异性识别并结合肺腺癌细胞和ABCG2靶抗原,具有较好的特异性和亲和力,为后续scFv裸鼠体内生物分布和放免显像研究及抑瘤作用的发挥奠定了基础[10]。
scFv的筛选富集是在体外分别以肺腺癌细胞及ABCG2纯化抗原为靶点先后进行3轮“吸附-洗脱-扩增”的生物淘选而获得的。在细胞ELISA和免疫细胞化学实验中均显示出了较好的特异性和亲和力,但由于机体内环境的错综复杂以及肿瘤微环境在肿瘤免疫治疗中发挥着越来越重要的作用,因此有必要在裸鼠体内进一步验证scFv对表达ABCG2的肿瘤靶组织的特异性结合能力,并深入探索其体内代谢动力学特征。
本研究在裸鼠体内生物分布及SPECT/CT显像中 观察到该scFv在肿瘤靶部位有相对特异性浓聚,且呈现出快速的组织摄取,6 h的放射活性即达到(24.61± 2.21)%,随后抗体的滞留随代谢而逐渐减少,但仍高于其他主要组织器官。肝肾中scFv的放射活性从6 h时的20%迅速降低到48 h时的不足1%,表明该抗体在体内快速的动力学代谢特征。131I标记的scFv的快速清除导致了瘤/血、瘤/肌肉和瘤/脑的放射性比值增高,使得在注射抗体后24 h内便获得了清晰的放免显像结果。相对满意的放免显像效果提示了该scFv在肺腺癌分子显像、免疫治疗及靶向药物投递方面的潜在应用价值。但是由于131I与抗体的解离及其自身的降解,必然引起血液中放射活性的增加而导致瘤/血比值的降低。因此,后续研究中有必要进一步探索其他有应用价值的放射活性替代物质。
本研究同时发现,裸鼠的肾脏、胃肠及肝脏也呈现出较高的放射活性,是主要的非特异性摄取器官,有产生抗体依赖的细胞毒性的风险。scFv与肝细胞、肾小管上皮细胞及肠上皮细胞的相互作用为一过性的器官毒性带来了隐患。为尽可能降低副反应的发生,可尝试优化生物淘选过程的相关参数以缩短抗体在非靶部位的滞留,提高scFv的清除速率。此外,通过诱导位点特异性突变获得更高亲和力的scFv突变体也可被作为抗体效价进一步优化的探索方向。有研究显示,受体调节的内吞作用和抗体依赖的细胞介导的细胞毒作用是抗体发挥抗肿瘤活性的主要作用机制[14-15]。抗体的抗肿瘤作用检测成为接下来的主要考察内容。在体外细胞增殖实验中,scFv与肺腺癌细胞结合内摄介导了时间和剂量相关的肿瘤细胞增殖抑制效应,表现为细胞生长曲线平缓迟滞、细胞凋亡率增加,G1期细胞周期阻滞以及ABCG2蛋白表达水平的相应下降。相比于体外细胞实验,动物模型更有利于综合评估scFv的作用。因此我们进一步构建了裸鼠移植瘤模型,研究结果也证实了scFv的抗增殖及促凋亡作用。但由于scFv的快速清除特性也势必会导致其作用时间的缩短,在一定程度上影响了抗体抗肿瘤作用的效果。因此,有必要进一步探索优化scFv的给药方式和剂量或联合其他不同作用机制的药物以实现协同抑瘤作用。
基于以上结果,我们推测scFv主要通过特异性结合并封闭肺腺癌细胞表面ABCG2蛋白的表达位点以及抗原、抗体结合所产生的抗体依赖细胞介导的细胞毒作用降低靶蛋白的表达,进而抑制细胞增殖,促进细胞凋亡,发挥抗肿瘤作用。但本研究未进一步探索具体涉及的相关信号通路和其他内在机制,也为今后继续深入的研究指明了方向。
综上所述,本研究表明,通过噬菌体展示肽库技术构建并筛选得到的人源肺腺癌ABCG2特异性scFv具有良好的生物体内代谢动力学特征以及满意的放免显像和抗肿瘤特性,为本课题组后续肺腺癌肿瘤干细胞的体内可视化研究和肺腺癌的分子显像诊断及靶向治疗提供依据。
| [1] | Nakanishi T, Ross D D. Breast cancer resistance protein (BCRP/ABCG2): its role in multidrug resistance and regulation of its gene expression[J]. Chin J Cancer,2012, 31 (2) : 73 –99. DOI:10.5732/cjc.011.10320 |
| [2] | Robey R W, To K K, Polgar O, et al. ABCG2: a perspective[J]. Adv Drug Deliv Rev,2009, 61 (1) : 3 –13. DOI:10.1016/j.addr.2008.11.003 |
| [3] | Kim Y H, Ishii G, Goto K, et al. Expression of breast cancer resistance protein is associated with a poor clinical outcome in patients with small-cell lung cancer[J]. Lung Cancer,2009, 65 (1) : 105 –111. DOI:10.1016/j.lungcan.2008.10.008 |
| [4] | Tsunoda S, Okumura T, Ito T, et al. ABCG2 expression is an independent unfavorable prognostic factor in esophageal squamous cell carcinoma[J]. Oncology,2006, 71 (3-4) : 251 –258. DOI:10.1159/000106787 |
| [5] | Yoh K, Ishii G, Yokose T, et al. Breast cancer resistance protein impacts clinical outcome in platinum-based chemotherapy for advanced non-small cell lung cancer[J]. Clin Cancer Res,2004, 10 (5) : 1691 –1697. DOI:10.1158/1078-0432.ccr-0937-3 |
| [6] | Zhou S, Schuetz J D, Bunting K D, et al. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype[J]. Nat Med,2001, 7 (9) : 1028 –1034. DOI:10.1038/nm0901-1028 |
| [7] | Nelson A L, Dhimolea E, Reichert J M. Development trends for human monoclonal antibody therapeutics[J]. Nat Rev Drug Discov,2010, 9 (10) : 767 –774. DOI:10.1038/nrd3229 |
| [8] | Farajnia S, Ahmadzadeh V, Tanomand A, et al. Development trends for generation of single-chain antibody fragments[J]. Immunopharmacol Immunotoxicol,2014, 36 (5) : 297 –308. DOI:10.3109/08923973.2014.945126 |
| [9] | Kazuma S M, Cavalcante M F, Telles A E, et al. Cloning and expression of an anti-LDL(-) single-chain variable fragment, and its inhibitory effect on experimental atherosclerosis[J]. MAbs,2013, 5 (5) : 763 –775. DOI:10.4161/mabs.25859 |
| [10] | 赵文思, 罗弋, 黎博一, 等. 三磷酸腺苷结合转运蛋白G超家族成员2特异性人源肺癌噬菌体scFv的筛选和鉴定[J]. 第三军医大学学报,2015, 37 (23) : 2343 –2347. DOI:10.16016/j.1000-5404.201508008 |
| [11] | Deutscher SL. Phage display in molecular imaging and diagnosis of cancer[J]. Chem Rev,2010, 110 (5) : 3196 –3211. DOI:10.1021/cr900317f |
| [12] | Pande J, Szewczyk M M, Grover A K. Phage display: concept, innovations, applications and future[J]. Biotechnol Adv,2010, 28 (6) : 849 –858. DOI:10.1016/j.biotechadv.2010.07.004 |
| [13] | 潘博, 童贻刚. 噬菌体抗体库技术及其应用研究进展[J]. 生物技术通讯,2010, 21 (4) : 581 –585. DOI:10.3969/j.issn.1009-0002.2010.04.031 |
| [14] | Ritchie M, Tchistiakova L, Scott N. Implications of receptor-mediated endocytosis and intracellular trafficking dynamics in the development of antibody drug conjugates[J]. MAbs,2013, 5 (1) : 13 –21. DOI:10.4161/mabs.22854 |
| [15] | Tortorella S, Karagiannis T C. Transferrin receptor-mediated endocytosis: a useful target for cancer therapy[J]. J Membr Biol,2014, 247 (4) : 291 –307. DOI:10.1007/s00232-014-9637-0 |



