2. 530021 南宁,广西医科大学第一附属医院结直肠肛门外科
2. Department of Colorectal and Anal Surgery, the First Affiliated Hospital of Guangxi Medical University, Nanning, Guangxi Zhuang Autonomous Region, 530021, China
小肠缺血再灌注损伤(ischemia-reperfusion,I/R)指在各种原因致使小肠缺血的基础上恢复血流后肠道损伤反而加重,甚至发生不可逆损伤的现象。肠I/R后由于氧化应激反应、细菌和毒素的移位,释放大量炎症因子,进而诱发全身炎症反应综合征[1-2]。临床中严重的感染、休克、烧伤、小肠移植、肠梗阻、肠系膜血管疾病等的病理生理过程中都存在不同程度的肠I/R[3-4]。番茄红素是植物中所含的一种天然色素,主要存在于番茄的成熟果实中,具有强抗氧化作用,是目前自然界中被发现的最强抗氧化剂之一,其抗氧化能力远胜于其他类胡萝卜素和维生素E,是维生素E的100倍。番茄红素能有效清除氧化自由基,提高抗氧化酶活性,从而阻断自由基的损伤[5]。研究发现番茄红素能提高脑缺血再灌注后脑组织中超氧化物歧化酶(superoxide dismutase,SOD)活性,降低丙二醛(malondialdehyde,MDA)含量,抑制氧化应激反应[6]。本研究采用肠系膜上动脉夹闭-松夹方式复制大鼠I/R模型,探讨番茄红素对大鼠肠缺血再灌注损伤的保护作用机制。
1 材料与方法 1.1 材料肿瘤坏死因子α(tumor necrosis factor-alpha, TNF-α)、白细胞介素6(interleukin-6, IL-6) ELISA试剂盒(RapidBio Lab,美国),二胺氧化酶(diamine oxidase,DAO)、髓过氧化物酶(myeloperoxidase, MPO)、丙二醛(malondialdehyde, MDA)、SOD试剂盒(南京建成生物工程公司),680酶标仪、洗板机(Bio-Rad公司, 美国),TGL-16G台式离心机(上海安亭科学仪器厂),番茄红素(南京泽朗生物科技有限公司),戊巴比妥钠(成都市制药厂),二甲苯(北京化学试剂公司),苏木精、伊红染液(武汉博士德生物工程公司)。
1.2 方法 1.2.1 实验分组健康清洁级SD大鼠48只,月龄(1.9±0.2),雌雄不拘,体质量(230±20) g,由广西医科大学实验动物中心提供,按随机数字表法分为3组:番茄红素组、缺血再灌注组、假手术组,每组16只。番茄红素组大鼠制备模型前5 d连续每天灌胃10 mg/kg番茄红素,肠缺血组和假手术组灌胃等量生理盐水。
1.2.2 动物模型制备所有大鼠造模前禁食12 h,自由饮水,最后一次灌胃2 h后称取体质量,以1.5%戊巴比妥钠(30 mg/kg)腹腔注射麻醉,腹部备皮后常规消毒、铺巾,做腹正中切口3 cm打开腹腔,逐步分离、暴露肠系膜上动脉。暴露肠系膜上动脉后,以无损伤动脉夹夹闭肠系膜上动脉1 h后打开,再灌注4 h,制备肠缺血再灌注动物模型。假手术组进行相同操作,但不夹闭肠系膜上动脉。
1.2.3 肠组织病理学观察再灌注4 h后,取距回盲部5 cm以上肠段2 cm,以生理盐水冲洗干净后,装入10%甲醛溶液中固定,脱水,石蜡包埋切片,常规进行HE染色,树胶封片。每张切片在光学显微镜下选取2个非重叠视野根据Chiu’s 6分法[7]进行病理学评分。0分:正常小肠绒毛上皮;1分:肠黏膜上皮下的Gruenhagen’s间隙,毛细血管有充血现象;2分:肠黏膜上皮下间隙出现扩张;3分:肠黏膜上皮大片状抬高,绒毛倒伏,顶端脱落,炎症细胞局部聚集,固有层弥漫出血;4分:固有层毛细血管暴露,炎症细胞多见,绒毛破损,内皮下可见出血;5分:内皮下出血,溃疡形成。取其平均值。
1.2.4 血清MDA、SOD及DAO检测再灌注4 h后,分离腹主动脉采血3 mL,室温下静置20 min,离心机3 000 r/min离心15 min,取上层血清,按照试剂盒操作检测血清SOD、DAO活性和MDA含量。
1.2.5 小肠组织匀浆检测再灌注4 h,取一段小肠称量后,制备10%小肠组织匀浆,分别以IL-6、TNF-α ELISA试剂盒检测小肠组织IL-6和TNF-α含量,以MPO试剂盒检测小肠组织MPO活性。
1.3 统计学分析采用SPSS 19.0统计软件,计量资料数据用x±s表示,组间比较采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 番茄红素对肠缺血再灌注氧化应激的影响与假手术组比较,缺血再灌注后番茄红素组和肠缺血组SOD活性明显降低(P < 0.01,表 1),MDA含量明显增加(P < 0.01);而番茄红素组SOD活性明显高于缺血再灌注组(P < 0.01),MDA含量明显低于缺血再灌注组(P < 0.01),表明番茄红素能有效抑制肠缺血再灌注后氧化应激反应。
| 组别 | SOD活性(U/mL) | MDA含量(nmol/mL) |
| 番茄红素组 | 84.92±10.03ab | 5.01±1.28ab |
| 缺血再灌注组 | 72.75±9.39b | 8.49±1.22b |
| 假手术组 | 133.75±2.93 | 3.09±0.19 |
| a: P < 0.01,与缺血再灌注组比较;b:P < 0.01,与假手术组比较 | ||
2.2 番茄红素对小肠组织TNF-α和IL-6的影响
缺血再灌注4 h后,番茄红素组和缺血再灌注组小肠组织中TNF-α和IL-6明显升高,明显高于假手术组(P < 0.01,表 2);而番茄红素组小肠组织中TNF-α和IL-6明显低于缺血再灌注组(P < 0.01),提示番茄红素能减少肠缺血再灌注后小肠组织IL-6和TNF-α的表达。
| 组别 | IL-6 | TNF-α |
| 番茄红素组 | 36.17±5.54ab | 46.73±4.65ab |
| 缺血再灌注组 | 58.55±6.22b | 67.10±8.91b |
| 假手术组 | 13.48±1.23 | 13.55±1.61 |
| a: P < 0.01,与缺血再灌注组比较;b:P < 0.01,与假手术组比较 | ||
2.3 番茄红素对小肠组织MPO活性的影响
与假手术组比较,缺血再灌注4 h后,缺血再灌注组大鼠小肠组织中MPO活性明显增高,差异有统计学意义(P < 0.01, 表 3);番茄红素组大鼠小肠组织中MPO活性有所降低,与缺血再灌注组比较,小肠组织MPO活性低于缺血再灌注组(P < 0.01),但仍明显高于假手术组(P < 0.01),说明番茄红素可以降低肠缺血再灌注后小肠组织中MPO活性。
| 组别 | DAO (U/mg) | MPO (U/L) | Chiu’s评分 |
| 番茄红素组 | 47.53±3.50ab | 12.62±1.49ab | 2.17±1.19ab |
| 缺血再灌注组 | 31.08±3.29b | 17.59±1.76b | 3.92±1.00b |
| 假手术组 | 83.44±2.70 | 8.47±0.55 | 0 |
| a: P < 0.01,与缺血再灌注组比较;b:P < 0.01,与假手术组比较 | |||
2.4 番茄红素对血清DAO活性的影响
缺血再灌注4 h后,缺血再灌注组血清中DAO活性明显升高,与假手术组相比差异有统计学意义(P < 0.01, 表 3),番茄红素预处理后,番茄红素组血清中DAO活性有所下降,且明显低于缺血再灌注组(P < 0.01),但仍明显高于假手术组(P < 0.01),表明番茄红素可以降低肠缺血再灌注后血清中DAO活性。
2.5 番茄红素对小肠组织病理学变化的影响假手术组呈现正常小肠绒毛改变,绒毛整齐,腺体正常,间隙正常,固有层无出血、水肿。番茄红素组小肠绒毛结构基本整齐,绒毛轻度水肿,上皮下间隙轻微扩张,可见少量炎性细胞,腺体基本正常。缺血再灌注组小肠绒毛结构明显破坏,黏膜充血明显,较多炎性细胞浸润,腺体明显水肿,部分出现溃疡(图 1)。与假手术组比较,缺血再灌注4 h后,番茄红素组和缺血再灌注组Chiu’s评分明显升高(P < 0.01,表 3),但番茄红素组Chiu’s评分低于缺血再灌注组(P < 0.01)。
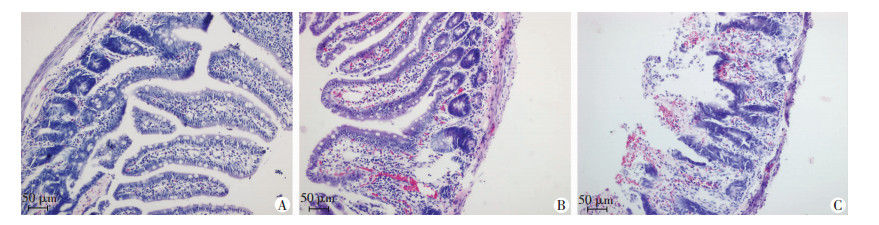
|
| A:假手术组;B:番茄红素组;C:缺血再灌注组 图 1 HE染色观察肠缺血再灌注4 h后各组小肠组织病理学改变 |
3 讨论
肠缺血再灌注损伤后大量氧自由基的释放是导致肠黏膜屏障损伤的重要因素,氧自由基能够攻击生物膜中的多不饱和脂肪酸,从而引发脂质过氧化作用,形成MDA、羟自由基(OH-)及过氧化氢(H2O2)等过氧化物[8-10]。由此可见,MDA是脂质过氧化反应的产物,可以反映自由基对组织损伤的程度。SOD是一种含有金属元素的活性蛋白酶,是生物体内天然的氧自由基清除剂,对组织起到很好的保护作用,可见SOD活性能够间接反映清除自由基的能力。本研究结果显示番茄红素组SOD活性明显高于缺血再灌注组,MDA含量明显低于缺血再灌注组,表明番茄红素能有效抑制肠缺血再灌注后氧化应激反应。
肠上皮细胞DAO是人类和哺乳动物小肠黏膜上层绒毛中具有高度活性的细胞内酶,在组胺和多种多胺代谢中起作用,其活性与黏膜细胞的核酸和蛋白合成密切相关,能够反映肠道机械屏障的完整性和受损伤程度[11]。本研究结果显示肠缺血再灌注后缺血再灌注组血清中DAO活性明显升高,而番茄红素组血清中DAO活性明显低于缺血再灌注组。光镜下可见肠缺血再灌组小肠绒毛结构明显破坏,黏膜充血明显,较多炎性细胞浸润,腺体明显水肿,部分出现溃疡。而番茄红素组小肠绒毛结构基本整齐,绒毛轻度水肿,上皮下间隙轻微扩张,可见少量炎性细胞,腺体基本正常。番茄红素组Chiu’s评分明显低于缺血再灌组(P < 0.01)。由此可见,番茄红素预处理可以有效降低肠缺血再灌注后血清中DAO活性,减轻小肠绒毛结构破坏,降低Chiu’s评分,能够有效缓解肠缺血再灌注造成的肠道损伤。
TNF-α是一种重要的炎性因子,在缺血再灌注损伤炎症反应中具有重要作用,出现在炎症反应最初阶段[12]。肠缺血再灌注损伤后,TNF-α通过激活中性粒细胞和单核巨细胞释放,刺激IL-1、IL-6等炎症因子产生,并且诱导白三烯类、血栓素A2、前列腺素等炎症介质的生成,致使细胞凋亡、血管通透性增加,引发过度炎症反应,加重组织器官的损伤[13]。IL-6是一种多细胞源性的细胞因子,肠缺血再灌注后缺氧酸中毒等因素能够使IL-6合成增加,刺激细胞间黏附分子-1产生,使炎性细胞大量侵入病变组织,引起大量中性粒细胞黏附活化,释放大量的自由基,与TNF-α等炎症细胞因子协同发挥细胞毒作用[14]。缺血再灌注损伤后活化的中性粒细胞可合成释放MPO,并且储存在嗜天青颗粒中,因此组织中MPO水平可反映中性粒细胞浸润和激活的程度[15]。本研究结果显示:缺血再灌注4 h后,小肠组织中TNF-α、IL-6及MPO明显升高,番茄红素预处理后,小肠组织中TNF-α、IL-6及MPO明显降低,说明番茄红素可以有效抑制肠缺血再灌注损伤后小肠组织中TNF-α及IL-6的表达,降低MPO活性,从而减轻炎症反应。
综上所述,番茄红素能有效抑制肠缺血再灌注损伤后氧化应激反应,降低小肠组织中TNF-α和IL-6的表达,减少中性粒细胞浸润,减轻炎症反应,对肠缺血再灌注损伤具有很好的保护作用。
| [1] | Guan Y, Worrell R T, Pritts T A, et al. Intestinal ischemia reperfusion injury: reversible and irreversible damage imaged in vivo[J]. Am J Physiol Gastrointest Liver Physiol,2009, 297 (1) : G187 –G196. DOI:10.1152/ajpgi.90595.2008 |
| [2] | Grootjans J, Lenaerts K, Derikx J P, et al. Human intestinal ischemia-reperfusion-induced inflammation characterized: experiences from a new translational model[J]. Am J Pathol,2010, 176 (5) : 2283 –2291. DOI:10.2353/ajpath.2010.091069 |
| [3] | Patai A V, Molnár B, Tulassay Z, et al. Serrated pathway: alternative route to colorectal cancer[J]. World J Gastroenterol,2013, 19 (5) : 607 –615. DOI:10.3748/wjg.v19.i5.607 |
| [4] | Kassahun W T, Schulz T, Richter O, et al. Unchanged high mortality rates from acute occlusive intestinal ischemia: six year review[J]. Langenbecks Arch Surg,2008, 393 (2) : 163 –171. DOI:10.1007/s00423-007-0263-5 |
| [5] | Stahl W, Sies H. Bioactivity and Protective effects of natural carotenoids[J]. Bioehim Biophys Acta,2005, 1740 (2) : 101 –107. DOI:10.1016/j.bbadis.2004.12.006 |
| [6] | 魏延, 沈新南, 沈慧, 等. 番茄红素对大鼠脑缺血再灌注损伤的影响[J]. 卫生研究,2010, 39 (2) : 201 –204. |
| [7] | Chiu C, McArdle A H, Brown R, et al. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal[J]. Arch Surg,1970, 101 (4) : 478 –483. DOI:10.1001/archsurg.1970.01340280030009 |
| [8] | Niissler N C, Miiler A R, Weidenbach H, et al. IL-10 increases tissue injury after selective intestine ischemia/reperfusion[J]. Ann Surg,2003, 238 (1) : 49 –58. DOI:10.1097/01.sla.0000074962.26074.d3 |
| [9] | Salehi P, Madsen K, Zhu J, et al. Alleviating ischemia-reperfusion injury in small bowel[J]. Am J Transplant,2004, 4 (5) : 728 –737. DOI:10.1111/j.1600-6143.2004.00430.x |
| [10] | Antal-Szalmas P, Poppelier M J, Sumegi A, et al. Spare CD14 molecules on human monocytes enhance the sensitivity for low LPS concentrations[J]. Imunol Lett,2004, 93 (1) : 11 –15. DOI:10.1016/j.imlet.2004.01.007 |
| [11] | Moriyama K, Kouchi Y, Morinaga H, et al. D Diamine oxidase, a plasma biomarker in rats to GI tract toxicity of oral fluorouracil anti-cancer drugs[J]. Toxicology,2006, 217 (2/3) : 233 –239. DOI:10.1016/j.tox.2005.09.017 |
| [12] | de Arruda M J, Poggetti R S, Fontes B, et al. Intestinal ischemia/reperfusion induces bronchial hyperreactivity and increases serum TNF-α in rats[J]. Clinics (Sao Paulo),2006, 61 (1) : 21 –28. DOI:10.1590/S1807-59322006000100005 |
| [13] | 盛恒炜, 沈晶晶, 屠伟峰, 等. 黄芪预处理对大鼠小肠缺血再灌注损伤的保护作用[J]. 第三军医大学学报,2013, 35 (24) : 2639 –2642. |
| [14] | 杨洁, 张海霞, 赵东伟, 等. 参附注射液对肠缺血再灌注大鼠肝肾功能及TNF-α、IL-6水平的影响[J]. 山东医药,2012, 52 (19) : 27 –28. |
| [15] | Liu K X, Li Y S, Huang W Q, et al. Immediatc postconditioning during reperfusion attenuates intestinal injury[J]. Intensive Care Med,2009, 35 (5) : 933 –942. DOI:10.1007/s00134-009-1428-1 |



