乙型肝炎病毒(HBV)是最常见的肝炎病毒,其所引起的乙型肝炎呈世界性分布,据估计全世界有3.5亿人为慢性HBV感染者[1],每年约有100万人死于因HBV感染所导致的相关疾病。我国是HBV的高流行地区,慢性肝炎及其相关疾病也是我国面临的重大卫生问题。因此,阐明HBV复制调控机制,控制HBV感染显得尤为重要。据文献报道,HBV在体内的复制受到宿主因素的严格调控[2],研究发现Sirt1[3]、Cyclin D2[4]、Ku80[5]、SAMHD1[6]等宿主因素均可以调控HBV的复制。但是宿主因素对HBV复制的影响尚未完全明了。因此,对HBV相关的宿主因素的研究具有重要的意义。
热休克蛋白(heat shock proteins,HSPs)是一类广泛存在于生物体内的应激蛋白质。当机体处于应激状态时,此种蛋白合成增多以保护机体,并且,许多热休克蛋白具有分子伴侣活性。按照蛋白相对分子质量的大小,热休克蛋白共分为5类,分别为HSP110、HSP90、HSP70、HSP60以及小分子热休克蛋白[7]。热休克蛋白B1(heat shock protein B1, HSPB1)属于小分子热休克蛋白,也称为HSP25(小鼠)和HSP27 (人类),是分布最广和研究最多的小分子热休克蛋白。其主要定位于细胞质,在内质网、细胞核等亚细胞器中也有分布。
作为小分子热休克蛋白,HSPB1与多种物理和化学应激相关,可以识别并辅助降解错误折叠的蛋白[8];HSPB1还能与多种参与细胞程序性死亡的组分相互作用[9]。研究发现HSPB1与多种肿瘤相关,其表达量与肿瘤的治疗反应[10]﹑预后[11]以及肿瘤进展[12]相关。许多文献也报道了HSPB1与病毒的关系。目前研究发现:HSPB1与Ⅰ型单纯疱疹病毒(herpes simplex virus,HSV-1)[13]、人腺病毒E37(HDTV-D37)[14]、丙型肝炎病毒(HCV)[15]和Ⅱ型猪圆环病毒(porcine circovirus type2,PCV2)[16]等感染过程相关。已知大多数肝癌与HBV相关[17],Harimoto等[18]研究发现,高表达HSPB1的HBV相关性肝癌患者预后较差。并且,蛋白质组学分析发现HSPB1可能是潜在的肝癌标志物且与病理分期和患者预后密切相关[19]。临床研究也发现HSPB1在肝癌患者的血清以及组织标本中表达上调[20-21]。以上发现阐明了在临床样品中HSPB1与HBV相关性肝癌存在明确关系,但并未解释其具体原因;另外,HBV在肝细胞内的持续复制是HBV持续感染以及向肝硬化﹑肝癌进展的重要原因[22],而以上研究大多是基于HBV背景下HSPB1表达水平的研究,并未深入讨论HSPB1与HBV的关系以及HSPB1是否参与HBV复制调控。本文拟在细胞水平对HSPB1是否参与HBV复制调控进行研究,从而有利于深入了解HSPB1对HBV的作用及影响,并为HBV的防治提供新的思路和靶点。
1 材料与方法 1.1 材料HepAD38细胞基因组整合了HBV基因组,HBV表达受Tet-off系统调控,一方面整合的HBV基因组通过表达pgRNA逆转录合成cccDNA (单个细胞中约有10个cccDNA分子),进而转录生成3.5、2.4、2.1 kb mRNA和0.7 kb mRNA,另一方面整合的HBV基因组可直接转录形成HBV RNA,继而完成HBV生活周期,该细胞由华西医学院感染性疾病中心唐红教授转赠;HepG2.2.15细胞同样整合有HBV基因组,能够稳定表达HBV,完成完整的HBV生活周期,该细胞中形成低水平cccDNA, 目前的技术方法不能检测,该细胞由本实验室保存;人肝癌细胞系Huh-7购自日本健康科学研究资源库(Health Science Research Resources Bank, HSRRB);HepRG细胞由厦门大学公共卫生学院夏宁邵教授转赠。pCMV6-HSPB1(RC201800)质粒购自美国Origene公司;pCH9/3091质粒包含由CMV启动子启动的1.1倍HBV基因组,通过转染,在细胞内能够表达HBV RNA,完成HBV生活周期,该质粒由第三军医大学西南医院全军感染病研究所兰林副研究员惠赠。HSPB1抗体购自美国Santa Cruz Biotechnology公司;辣根过氧化物酶标记羊抗鼠IgG和GAPDH抗体均购自中杉金桥公司(中国);辣根过氧化物酶标记羊抗兔IgG购自美国GE Healthcare公司。质粒转染试剂购自德国Roche公司。iScriptTM cDNA合成试剂盒购于美国Bio-Rad公司。
1.2 细胞培养HepG2.2.15和HepAD38细胞均培养于含有10%胎牛血清(美国Gibco公司)、400 μg/mL G418(美国Merck公司)和1%丙酮酸钠(美国HyClone公司)的MEM培养基(美国Corning公司)中;Huh-7和HepRG细胞培养于含有10%胎牛血清(美国Gibco公司)、1%青/链霉素(美国HyClone公司)的DMEM培养基(美国Gibco公司)中,在含5%CO2、37 ℃孵育箱中培养。质粒转染严格按照说明书操作。
1.3 Western blot检测收集细胞,根据细胞多少加入适当体积的细胞裂解液RIPA (含蛋白酶抑制剂),4 ℃摇床裂解15 min;离心弃细胞碎片;BCA法进行蛋白质定量。取等量总蛋白(30 μg)加蛋白变性液后95 ℃变性10 min,利用SDS-PAGE电泳进行蛋白质分离,采用电湿转法将分离后蛋白质转移至NC膜(RPN303D, 美国GE公司)上。将含有目的蛋白质的NC膜放在5%脱脂奶粉中,室温摇床封闭1 h,一抗4 ℃摇床过夜孵育(HSPB1抗体1 :6 000稀释)。次日TBS-T洗膜3次,每次5 min。二抗在摇床上室温孵育2 h (抗体1 :3 000稀释),洗膜同上。ECL显影。以GAPDH为内参。
1.4 qRT-PCR相对定量法采用TRIzol (美国Invitrogen公司)法裂解细胞提取总RNA,取1 μg RNA利用iScriptTM cDNA Synthesis Kit (美国Bio-Rad公司)试剂盒将其逆转录为cDNA,然后进行qRT-PCR (Fast Start Universal SYBR Green Master, 德国Roche公司)检测目的基因的mRNA水平,HBV 3.5 kb mRNA水平(上游引物:5′-GCCTTAGAGTCTCCTGAGCA-3′,下游引物:5′-GAGGGAGTTCTTCTTCTAGG-3′,产物大小:345 bp)。以β-actin为内参(上游引物:5′-CTCTTCCAGCCTTCCTTCCT-3′,下游引物:5′-AGCACTGTGTTGGCGTACAG-3′,产物大小:182 bp)。每个样本均设3个复孔,每组实验重复3次。
1.5 HBV复制中间体的提取用胰蛋白酶消化并收集转染质粒5 d的细胞,采用牛鲍氏计数板计数后,取相同数目的细胞,PBS洗涤,加入500 μL细胞裂解液(10 mmol/L Tris-HCl、pH=8.0,1 mmol /L EDTA,1% NP-40和2% Sucrose),37 ℃孵育15 min,15 000×g离心5 min,取上清。在上清中加入4 μL DNaseⅠ(5 U/mL)和5 μL MgCl2(1 mol/L),37 ℃孵育4 h。加入200 μL含1.5 mol/L NaCl的35% PEG 8000,冰浴1 h,11 000×g、4 ℃离心5 min,去上清,加入12.5 μL蛋白酶K (20 mg/mL, 日本TaKaRa公司)和500 μL蛋白酶K消化液(0.5% SDS,150 mmol/L NaCl,25 mmol/L Tris-HCl、pH=8.0和10 mmol/L EDTA)。酚氯仿抽提,异丙醇沉淀,70%乙醇洗涤,ddH2O溶解。
1.6 Southern blot检测利用0.9%琼脂糖凝胶电泳分离HBV复制中间体;将凝胶放入碱变性液中,室温水平摇床30 min,重复1次;毛细管虹吸法转膜4 h,紫外交联固定。42 ℃预杂交1 h后加入地高辛标记DNA探针42 ℃杂交过夜。次日,依次在30 mL 2×SSC/0.1%SDS、1×SSC/0.1%SDS、0.1×SSC/0.1%SDS洗膜各15 min。将膜在阻断液中37 ℃阻断30 min,采用抗地高辛二抗37 ℃孵育30 min后化学发光、采集信号。
1.7 实时荧光定量PCR检测HBV复制中间体。严格按照SYBR Green (11797100德国Roche公司)说明书配制反应体系和设置反应条件(上游引物:5′-CCTAGTAGTCAGTTATGTCAAC-3′,下游引物:5′-TCTATAAGCTGGAGGAGTGCGA-3′,产物大小:150 bp)。每个样本均设3个复孔,每组实验重复3次。
1.8 酶联免疫吸附实验(ELISA)ELISA试剂盒购自中国KHB公司。严格按照试剂盒说明书进行操作,分别检测HBsAg和HBeAg的分泌水平。
1.9 统计学分析实验数据均采用x±s形式表示,采用SPSS 20.0统计软件,两组间比较采用t检验。以P < 0.05表示差异具有统计学意义。
2 结果 2.1 HSPB1在HBV复制细胞系的表达Western blot检测HSPB1在正常肝细胞系(HepRG)和HBV稳定复制细胞系(HepAD38和HepG2.2.15)中的蛋白水平,结果显示HSPB1在HepAD38和HepG2.2.15这两种细胞中表达明显低于HepRG (图 1)。
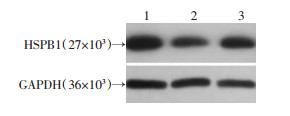
|
| 1:HepRG细胞;2:HepAD3细胞;3:HepG2.2.15细胞 图 1 Western blot检测HSPB1在HBV复制细胞系的表达 |
2.2 HSPB1过表达验证
在HBV稳定复制细胞系HepAD38细胞和HepG2.2.15细胞中转染了HSPB1表达质粒及对照质粒,Western blot检测结果显示HSPB1在这两种细胞中均成功过表达(图 2)。

|
| 1、2:分别为转染对照质粒和pCMV6-HSPB1质粒的HepAD38细胞;3、4:分别为转染对照质粒和pCMV6-HSPB1质粒的HepG2.2.15细胞 图 2 Western blot验证HSPB1过表达 |
2.3 HSPB1过表达对HBV复制中间体水平的影响
实时荧光定量PCR检测发现:过表达HSPB1时,HepAD38细胞和HepG2.2.15细胞中HBV复制中间体的表达明显降低,差异具有统计学意义(P < 0.05,图 3)。Southern blot检测进一步证实HSPB1过表达抑制了HBV复制中间体的表达(图 4)。这些结果表明HSPB1过表达可显著抑制HBV复制中间体的表达。
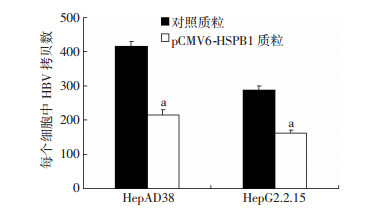
|
| a:P < 0.05,与转染对照质粒细胞比较 图 3 实时荧光定量PCR检测HSPB1过表达对HBV复制中间体水平的影响 |
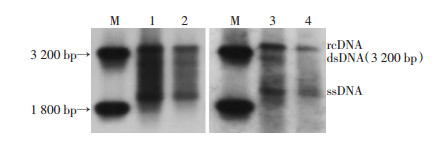
|
| M:标准;1、2:分别为转染对照质粒和pCMV6-HSPB1质粒的HepAD38细胞;3、4:分别为转染对照质粒和pCMV6-HSPB1质粒的HepG2.2.15细胞 图 4 Southern blot检测HSPB1过表达对HBV复制中间体水平的影响 |
2.4 HSPB1过表达对HBV 3.5 kb mRNA水平的影响
由于HBV 3.5 kb mRNA含有HBV基因组全部的遗传信息,并且是HBV复制的模板,因此,本研究检测HSPB1对其表达的影响。qRT-PCR分析结果显示:HSPB1过表达时,HepAD38细胞和HepG2.2.15细胞中HBV 3.5 kb mRNA表达显著降低,差异具有统计学意义(P < 0.05,图 5)。说明HSPB1也可明显抑制HBV 3.5 kb mRNA的表达。

|
| a:P < 0.05,与转染对照质粒细胞比较 图 5 qRT-PCR检测HSPB1过表达对HBV 3.5 kb mRNA水平的影响 |
2.5 HSPB1过表达对HBsAg和HBeAg的分泌水平的影响
ELISA检测发现:HSPB1过表达时,细胞培养上清中HBsAg和HBeAg的分泌明显减少,差异具有统计学意义(P < 0.05,图 6)。表明HSPB1过表达抑制了HBV抗原的分泌。
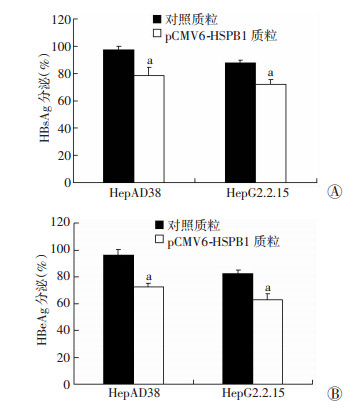
|
| a:P < 0.05,与转染对照质粒细胞比较A:过表达HSPB1对HBsAg分泌的影响; B:过表达HSPB1对HBeAg分泌的影响 图 6 ELISA检测HSPB1过表达对HBsAg和HBeAg分泌水平的影响 |
2.6 HSPB1过表达对瞬时HBV感染复制的影响
为验证HSPB1对HBV复制的影响,在肝癌细胞系Huh-7中共转染了HBV表达质粒pCH9/3091和HSPB1, Western blot检测显示:HSPB1在Huh-7细胞中过表达成功(图 7),实时荧光定量PCR分析结果显示HSPB1过表达时,瞬时表达HBV的Huh-7细胞中HBV复制中间体的表达明显降低,差异具有统计学意义(111.67±10.21 vs 75.33±6.02, P < 0.05)。Southern blot检测结果也显示:过表达HSPB1后,HBV复制中间体的表达水平明显降低(图 8)。进一步表明HSPB1过表达抑制了HBV复制。
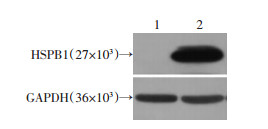
|
| 1:共转染对照质粒与pCH9/3091质粒的Huh-7细胞;2:共转染pCMV6-HSPB1与pCH9/3091质粒的Huh-7细胞 图 7 Western blot验证HSPB1过表达 |

|
| M:标准;1:共转染对照质粒与pCH9/3091质粒的Huh-7细胞;2:共转染pCMV6-HSPB1与pCH9/3091质粒的Huh-7细胞 图 8 Southern blot检测HSPB1过表达对HBV瞬时感染复制中间体水平的影响 |
3 讨论
在各种生理与病理应激状态下,HSPB1作为应激蛋白,均有不同程度的激活,而病毒作为常见的病原体,能够引起机体的一系列应激改变。研究发现用p38 MAPK抑制剂(SB203580)处理登革热病毒(dengue virus,DENV)感染的小鼠时,其下游信号分子HSPB1的磷酸化水平明显下降,从而减轻了登革热病毒诱导的肝损伤[23]。同时,卡波氏肉瘤相关疱疹病毒(Kaposi’s sarcoma-associated herpesvirus,KSHV)可以促进MK2-HSPB1信号通路介导的转录后修饰[24]。人类巨细胞病毒(human cytomegalovirus,HCMV)通过上调HSPB1来抑制活性Caspase 3的形成以及细胞凋亡的起始[25]。这些发现显示了病毒通过HSPB1调节了细胞的生物学进程,然而,目前关于HSPB1调控病毒生活周期少见报道。本研究在HBV复制细胞系上过表达HSPB1,发现HSPB1通过下调HBV 3.5 kb mRNA和复制中间体水平来改变HBV的复制水平,表明HSPB1可以通过改变HBV复制水平而影响HBV的生活周期,进而可能改变肝炎向肝硬化、肝癌的进展。而这一发现与Harimoto等[18]研究报道HSPB1与HBV相关性肝癌患者预后呈负相关这一结论矛盾,其主要原因可能是由于Harimoto等研究纳入的患者中同时有HBV和HCV感染,不能排除HCV对预后的影响;而本研究同时在HBV稳定复制细胞系和外源性表达HBV的细胞中进行研究,得到的实验结果更加充分说明了HSPB1与HBV复制的关系;并且Harimoto等纳入样本数仅为60例,需要扩大样本量进一步深入研究。
HBV虽然是DNA病毒,但其可以通过共价闭合环状DNA (cccDNA)转录生成的前基因组RNA (pgRNA)逆转录生成松弛环状DNA (rcDNA)[26]。本研究在过表达HSPB1后发现HBV 3.5 kb mRNA水平降低,提示HSPB1可能通过下调pgRNA的生成,进一步减少HBV复制中间体的产生,从而抑制HBV的复制。
作为重要的应激蛋白,HSPB1参与调节细胞氧化应激状态[27]。Poussard等[28]发现天然抗氧化剂Oligopin®可以通过调节HSPB1而减少骨骼肌细胞的氧化损伤,并且有研究发现利用干扰RNA靶向沉默HSPB1后会引起体内ROS堆积[29]。病毒侵入机体,在体内定植﹑复制,打破体内氧化与抗氧化平衡。也有研究发现在体内外,抗氧化剂谷胱甘肽具有抗流感病毒的活性[30];并且另一种抗氧化剂MnTBAP可以通过修饰病毒蛋白而抑制HIV-1的复制[31]。以上研究结果显示:HSPB1参与氧化应激,且氧化应激状态可以影响病毒在体内的复制与感染。而对于HBV,Ren等[32]研究发现,氧化剂H2O2明显促进HBV的复制,而抗氧化剂N-乙酰基-L-半胱氨酸(N-acetyl-L-cysteine, NAC)会抑制HBV的复制。Kim等[33]证实ROS可以促进HBV衣壳的组装,进而促进HBV的复制。说明氧化应激可以促进HBV的复制。以上研究结果提示HSPB1可能通过氧化应激途径参与HBV复制。为我们下一步研究HSPB1调控HBV复制分子机制提供了理论依据。
综上所述,本研究发现HSPB1能够抑制HBV复制。本课题组下一步将通过研究HSPB1、氧化应激状态、HBV复制3者之间的相互作用关系,进一步阐明HSPB1下调HBV复制的分子机制,从而为控制HBV感染提供新的靶点。
| [1] | Mohammadi Z, Keshtkar A, Eghtesad S, et al. Epidemiolo-gical Profile of Hepatitis B Virus Infection in Iran in the Past 25 years; A Systematic Review and Meta-analysis of General Population Studies[J]. Middle East J Dig Dis,2016, 8 (1) : 5 –18. DOI:10.15171/mejdd.2016.01 |
| [2] | Morikawa K, Suda G, Sakamoto N. Viral life cycle of hepatitis B virus: host factors and druggable targets[J]. Hepatol Res,2016, 46 (9) : 871 –877. DOI:10.1111/hepr.12650 |
| [3] | Ren J H, Tao Y, Zhang Z Z, et al. Sirtuin 1 regulates hepatitis B virus transcription and replication by targeting transcription factor AP-1[J]. J Virol,2014, 88 (5) : 2442 –2451. DOI:10.1128/JVI.02861-13 |
| [4] | 任吉华, 冉龙宽, 李宛蔚, 等. 细胞周期蛋白D2对HBV复制的影响[J]. 第三军医大学学报,2015, 37 (15) : 1550 –1554. DOI:10.16016/j1000-5404.201411228 |
| [5] | Guo H, Xu C, Zhou T, et al. Characterization of the host factors required for hepadnavirus covalently closed circular (ccc) DNA formation[J]. Plos one,2012, 7 (8) : e43270 . DOI:10.1371/journal.pone.0043270 |
| [6] | Jeong G U, Park I H, Ahn K, et al. Inhibition of hepatitis B virus replication by a dNTPase-dependent function of the host restriction factor SAMHD1[J]. Virology,2016, 495 : 71 –78. DOI:10.1016/j.virol.2016.05.001 |
| [7] | Mizrahi T, Heller J, Goldenberg S, et al. Heat shock proteins and resistance to desiccation in congeneric land snails[J]. Cell Stress Chaperones,2010, 15 (4) : 351 –363. DOI:10.1007/s12192-009-0150-9 |
| [8] | Garrido C, Brunet M, Didelot C, et al. Heat shock proteins 27 and 70: anti-apoptotic proteins with tumorigenic properties[J]. Cell Cycle,2006, 5 (22) : 2592 –2601. DOI:10.4161/cc.5.22.3448 |
| [9] | Melle C, Ernst G, Escher N, et al. Protein profiling of microdissected pancreas carcinoma and identification of HSP27 as a potential serum marker[J]. ClinChem,2007, 53 (4) : 629 –635. DOI:10.1373/clinchem.2006.079194 |
| [10] | Ciocca D R, Calderwood S K. Heat shock proteins in cancer: Diagnostic, prognostic, predictive, and treatment implications[J]. Cell Stress Chaperones,2005, 10 (2) : 86 –103. DOI:10.1379/CSC-99r.1 |
| [11] | Zoubeidi A, Gleave M. Small heat shock proteins in cancer therapy and prognosis[J]. Int J Biochem Cell Biol,2012, 44 (10) : 1646 –1656. DOI:10.1016/j.biocel.2012.04.010 |
| [12] | Sherman M, Multhoff G. Heat shock proteins in cancer[J]. Ann N Y Acad Sci,2007, 1113 : 192 –201. DOI:10.1196/annals.1391.030 |
| [13] | Choi Y W, Tan Y J, Lim S G, et al. Proteomic approach identifies HSP27 as an interacting partner of the hepatitis C virus NS5A protein[J]. Biochem Biophys Res Commun,2004, 318 (2) : 514 –519. DOI:10.1016/j.bbrc.2004.04.052 |
| [14] | Mathew S S, Della Selva M P, Burch A D. Modification and reorganization of the cytoprotective cellular chaperone Hsp27 during herpes simplex virus type 1 infection[J]. J Virol,2009, 83 (18) : 9304 –9312. DOI:10.1128/JVI.01826-08 |
| [15] | Rajaiya J, Yousuf M A, Singh G, et al. Heat shock protein 27 mediated signaling in viral infection[J]. Biochemistry,2012, 51 (28) : 5695 –5702. DOI:10.1021/bi3007127 |
| [16] | Liu J, Zhang L, Zhu X, et al. Heat shock protein 27 is involved in PCV2 infection in PK-15 cells[J]. Virus Res,2014, 189 : 235 –242. DOI:10.1016/j.virusres.2014.05.024 |
| [17] | Tornesello M L, Buonaguro L, Izzo F, et al. Molecular alterations in hepatocellular carcinoma associated with hepatitis B and hepatitis C infections[J]. Oncotarget,2016, 7 (18) : 25087 –25102. DOI:10.18632/Oncotarget.7837 |
| [18] | Harimoto N, Shimada M, Aishima S, et al. The role of heat shock protein 27 expression in hepatocellular carcinoma in Japan: Special reference to the difference between hepatitis B and C[J]. Liver Int,2004, 24 (4) : 316 –321. DOI:10.1111/j.1478-3231.2004.0927.x |
| [19] | King K L, Li A F, Chau G Y, et al. Prognostic significance of heat shock protein-27 expression in hepatocellular carcinoma and its relation to histologic grading and survival[J]. Cancer,2000, 88 (11) : 2464 –2470. DOI:10.1002/(ISSN)1097-0142 |
| [20] | Feng J T, Liu Y K, Song H Y, et al. Heat-shock protein 27: A potential biomarker for hepatocellular carcinoma identified by serum proteome analysis[J]. Proteomics,2005, 5 (17) : 4581 –4588. DOI:10.1002/pmic.200401309 |
| [21] | Yang Z, Zhuang L, Szatmary P, et al. Upregulation of heat shock proteins (HSPA12A, HSP90B1, HSPA4, HSPA5 and HSPA6) in tumour tissues is associated with poor outcomes from HBV-related early-stage hepatocellular carcinoma[J]. Int J Med Sci,2015, 12 (3) : 256 –263. DOI:10.7150/ijms.10735 |
| [22] | Levrero M, Zucman-Rossi J. Mechanisms of HBV-induced hepatocellular carcinoma[J]. J Hepatol,2016, 64 (1 Suppl) : S84 –S101. DOI:10.1016/j.jhep.2016.02.021 |
| [23] | Sreekanth G P, Chuncharunee A, Sirimontaporn A, et al. SB203580 Modulates p38 MAPK signaling and dengue virus-induced liver injury by reducing MAPKAPK2, HSP27, and ATF2 phosphorylation[J]. PLoS One,2016, 11 (2) : e0149486 . DOI:10.1371/journal.pone.0149486 |
| [24] | Corcoran J A, Johnston B P, McCormick C. Viral activation of MK2-hsp27-p115 RhoGEF-RhoA signaling axis causes cytoskeletal rearrangements, P-body disruption and ARE-mRNA stabilization[J]. PLoS Pathogens,2015, 11 (1) : e1004597 . DOI:10.1371/journal.ppat.1004597 |
| [25] | Peppenelli M A, Arend K C, Cojohari O, et al. Human cytomegalovirus stimulates the synthesis of select Akt-dependent antiapoptotic proteins during viral entry to promote survival of infected monocytes[J]. J Virol,2016, 90 (6) : 3138 –3147. DOI:10.1128/JVI.02879-15 |
| [26] | Blondot M L, Bruss V, Kann M. Intracellular transport and egress of hepatitis B virus[J]. J Hepatol,2016, 64 (1 Suppl) : S49 –S59. DOI:10.1016/j.jhep.2016.02.008 |
| [27] | Tadros S F, D'Souza M, Zhu X, et al. Gene expression changes for antioxidants pathways in the mouse cochlea: relations to age-related hearing deficits[J]. PLoS One,2014, 9 (2) : e90279 . DOI:10.1371/journal.pone.0090279.eCollection2014 |
| [28] | Poussard S, Pires-Alves A, Diallo R, et al. A natural antioxidant pine bark extract, Oligopin®, regulates the stress chaperone HSPB1 in human skeletal muscle cells: a proteomics approach[J]. Phytother Res,2013, 27 (10) : 1529 –1535. DOI:10.1002/ptr.4895 |
| [29] | Song T F, Zhang Z F, Liu L, et al. Small interfering RNA-mediated silencing of heat shock protein 27 (HSP27) Increases chemosensitivity to paclitaxel by increasing production of reactive oxygen species in human ovarian cancer cells (HO8910)[J]. J Int Med Res,2009, 37 (5) : 1375 –1388. DOI:10.1177/147323000903700512 |
| [30] | Cai J, Chen Y, Seth S, et al. Inhibition of influenza infection by glutathione[J]. Free Radic Biol Med,2003, 34 (7) : 928 –936. DOI:10.1016/S0891-5849(03)00023-6 |
| [31] | Aquaro S, Muscoli C, Ranazzi A, et al. The contribution of peroxynitrite generation in HIV replication in human primary macrophages[J]. Retrovirology,2007, 4 : 76 . DOI:10.1186/1742-4690-4-76 |
| [32] | Ren J H, Chen X, Zhou L, et al. Protective role of sirtuin3 (SIRT3) in oxidative stress mediated by hepatitis B virus X protein expression[J]. PLoS ONE,2016, 11 (3) : e0150961 . DOI:10.1371/journal.pone.0150961 |
| [33] | Kim Y S, Seo H W, Jung G. Reactive oxygen species promote heat shock protein 90-mediated HBV capsid assembly[J]. Biochem Biophys Res Commun,2015, 457 (3) : 328 –333. DOI:10.1016/j.bbrc.2014.12.110 |



