目前临床上各类创伤、烧伤及糖尿病顽固性皮肤溃疡等造成的广泛皮肤组织缺损仍没有良好的治疗方法。近年来国内外及我们前期的研究均发现,人表皮干细胞(epidermal stem cell,ESC)拥有强大的自我更新、增殖与分化的潜能等特点[1-2],且在促进创面愈合过程中扮演重要角色,因此研究ESC特性已成为国内外的焦点。通过前期研究结果提示线粒体缺失在ESC生物学特征及相关疾病研究中具有重要作用[3],我们认为TFAM基因可能通过对细胞线粒体的调控在ESC的特征中扮演着重要角色,因此,我们此次研究期望观察TFAM通过影响线粒体功能,进一步起到调节ESC细胞特性的作用。实验将前期构建的TFAM基因沉默慢病毒[4]转染至ESC中,通过与慢病毒对照组ESC的比较,观察TFAM与ESC生物学特征之间的关联,为进一步研究ESC增殖及凋亡等机制提供理论依据。
1 材料与方法 1.1 资料及试剂标本取材于2014年6-9月第三军医大学西南医院泌尿外科包皮环切术患者,患者年龄均小于18岁,经患者及家属知情同意,并经伦理委员会批准后取做实验研究用。主要试剂包括:DK-SFM培养基及Dispase Ⅱ溶液(Gibco公司),人胎盘Ⅳ型胶原(Sigma公司),鼠抗人β1-integrin单克隆抗体、鼠抗人角蛋白K19单克隆抗体及鼠抗人TERT抗体(Abcam公司),山羊抗鼠荧光二抗、山羊抗鼠HRP标记二抗、DAPI及Western blot试剂盒(碧云天),TRIzol (Invitrogen公司),RT-PCR kit(TaKaRa公司),兔抗Caspase-3多克隆抗体、CCK-8 kit(广州锐博生物),鼠抗GAPDH 抗体(上海康成)。
1.2 方法 1.2.1 ESC的分离培养及鉴定所有标本的获取均获得患者知情同意并签署了知情同意书,采用Ⅳ型胶原快速黏附法对ESC进行分离培养。在无菌条件下将新鲜取材的人包皮组织修剪为约0.5 cm×1 cm大小的皮片,0.25% Dispase Ⅱ溶液4 ℃消化过夜,分离表皮与皮下组织,收集表皮,PBS清洗,0.05%胰蛋白酶-0.02%EDTA溶液37 ℃消化15 min,200目滤网过滤后,细胞接种于Ⅳ型胶原包被的培养瓶,加入DK-SFM(含10%胎牛血清)于37 ℃ 5% CO2孵箱传代培养。采用免疫荧光两步法标记ESC表面标志物β1-integrin及K19,对ESC进行鉴定[5]。
1.2.2 慢病毒转染ESC并检测TFAM干扰效率采用磷酸钙共沉淀法转染293FT细胞制备得到实验用慢病毒,进行超速离心法纯化浓缩。将ESC接种于24孔板中,每孔中加入5×104细胞和500 μL DK-SFM培养基,次日,感染前更换新鲜培养基,然后将所需慢病毒直接加入培养基中,24 h后更换新鲜培养基,继续培养48 h后,即可在细胞中观察到绿色荧光蛋白(GFP)表达。病毒感染后第10天取样,采用TRIzol法提取细胞RNA,测量浓度后取0. 8 μg RNA按照TaKaRa逆转录试剂盒说明书进行逆转录和qPCR检测。TFAM的引物:上游5′- CAAAGGATGATTCGGCTCAG-3′,下游5′-AAGCTGAATATATGCCTGCTTTTC-3′;GAPDH的引物:上游5′-TGTGTCCGTCGTGGATCTGA-3′,下游5′-TTGCTGTTGAAGTCGCAGGAG-3′。
1.2.3 病毒感染后ESC表面标志物β1-integrin和K19的表达收集第2代ESC细胞,PBS冲洗2次,计数并离心,使其为1×105细胞/管,1%Triton孵育25 min,PBS冲洗2次,用含1% BSA的PBS稀释抗体,室温孵育30 min,PBS冲洗2次,用含1%BSA的PBS稀释二抗,冰上避光孵育20 min,4% PFA室温固定细胞20 min,PBS冲洗2次后FACS检测表达荧光细胞数目。
1.2.4 观察体外ESC的增殖能力采用第2代ESC将细胞接种于96孔板,100 μL/孔,即2×103个/孔,边缘孔用无菌PBS填充,5%CO2、37 ℃孵育2~10 d,倒置显微镜下观察细胞状态。按CCK-8 kit说明书操作并于全波长酶标仪上测量450 nm处各孔的光密度值,记录结果。
1.2.5 ESC体外克隆形成率的变化取干扰组及对照组中的第2代ESC,病毒处理10 d后,用Ⅳ型胶原快速黏附法将ESC以200~500/皿接种于直径100 mm 的培养皿中,置于37 ℃、5%CO2孵箱培养2周。4%多聚甲醛固定,Giemsa染色后显微镜下观察,以克隆内细胞数≥32(25)个为一个克隆,连续观察并记录克隆形成数。克隆形成率=克隆数/接种细胞数×100%。
1.2.6 端粒酶反转录酶表达水平检测使用EnVision两步法对第2代经病毒处理10 d的ESC细胞按照产品说明书进行端粒酶反转录酶(TERT)免疫细胞化学染色,分别取两组染色玻片,使用HPIAS-1000彩色高清晰度病理分析报告系统进行相应图像分析,除去背景色后随机取5个视野,对其阳性细胞与光密度进行测定,并求得平均阳性面积(S)和平均光密度(A)。
1.2.7 ESC的凋亡检测RIPA裂解液提取细胞蛋白,冰上裂解10 min,4 ℃ 14 000×g条件下离心5 min,取上清即得总蛋白,BCA法测定蛋白浓度后取30 μg蛋白加入上样缓冲液,于100 ℃沸水浴中变性5 min,冷却后上样电泳,转膜,5%脱脂奶粉于室温封闭1 h,Caspase-3一抗4 ℃过夜,二抗室温1.5 h,化学发光试剂盒显色后凝胶成像仪检测。
将ESC以1×105个/孔接种于 6 孔板中,干扰组与对照组各组重复3孔。收集各组细胞加入结合液195 μL混匀 ,加入 FITC-Annexin V 5 μL 避光反应10 min,加入适量 PBS 离心清洗取沉淀后,加入结合液 190 μL 混匀 ,加入 PI 10 μL ,30 min内流式细胞仪(FACSCalibur ,美国 BD 公司) 检测。
1.3 统计学分析使用SPSS 19.0软件进行统计学分析,计量资料用x±s表示,采用t检验。计数资料用百分比(%)表示,采用卡方检验,组间比较采用单因素方差分析。
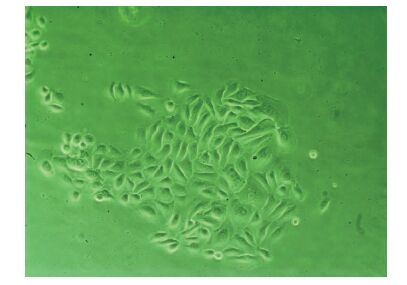
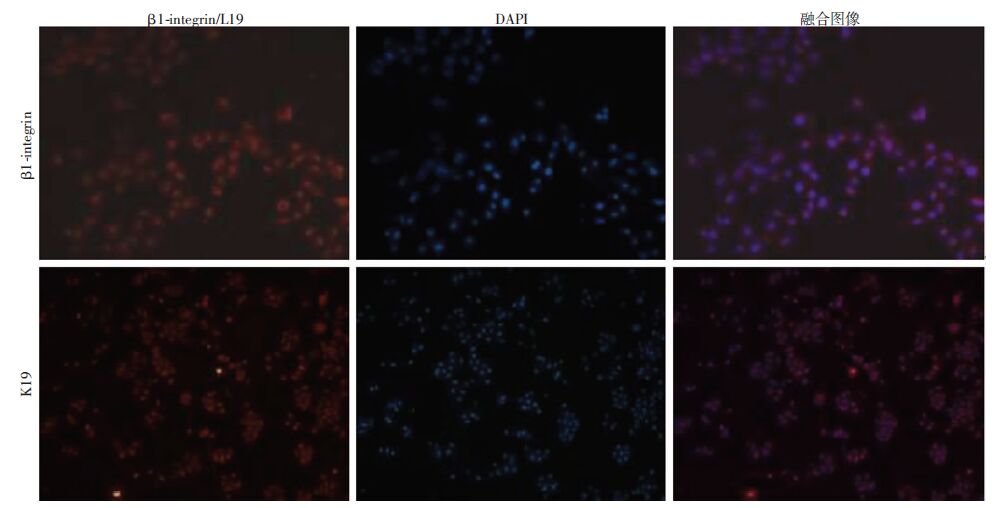
2 结果 2.1 ESC体外培养及鉴定采用Ⅳ型胶原快速黏附法可有效将ESC从角质形成细胞中分离出来,ESC可在体外进行培养扩增并保持干细胞基本特性,可在以后ESC的研究中表达稳定的干细胞特性。倒置相差显微镜观察示,快速黏附于Ⅳ型胶原的细胞群细胞呈圆形,分散较均匀,细胞体积较小,细胞核大,核质比大,折光率较强;孵育3 d后,细胞贴壁牢固并形成明显克隆,符合ESC特征(图 1)。通过免疫荧光染色观察,能够检测出β1-integrin和K19两种表面标志物(图 2),且表达明显荧光,说明本实验培养方法有效,可利用细胞体外培养得到ESC,为进一步研究细胞的特性奠定了基础。
|
| 图 1 倒置相差显微镜观察ESC形态学变化 (×100) |
|
| 图 2 β1-integrin和K19免疫荧光染色鉴定ESC (荧光显微镜×100) |
2.2 ESC的慢病毒转染及干扰效率的鉴定
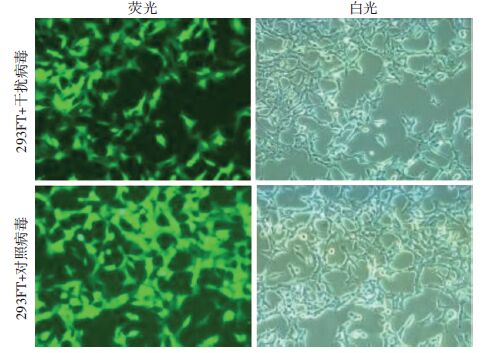
如图 3所示转染48 h后在293FT细胞中观察到明显的绿色荧光,干扰组与对照组293FT细胞形态无明显变化。将在293FT细胞内包装的慢病毒进行浓缩纯化后可高效感染ESC,并可在ESC中稳定高效的表达,为我们下一步研究TFAM下调对ESC功能的调控打下了基础。并通过实时荧光定量PCR检测干扰组ESC和对照组ESC的TFAM基因表达水平,其干扰效率超过83%。
|
| 图 3 荧光显微镜观察转染48 h后293FT细胞的变化(×100) |
2.3 慢病毒感染ESC后β1-integrin和K19表达的变化
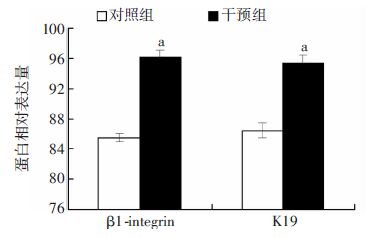
经慢病毒感染的ESC在体外培养10 d,通过流式细胞仪分别计数观察干扰组ESC和对照组ESC中表达β1-integrin和K19的荧光标记细胞比例,如图 4所示两组ESC均能够检测出两种表面标志物,但干扰组β1-integrin和K19阳性细胞均分别高于对照组(P<0.05),提示TFAM基因下调会利于ESC保持未分化状态和维持干性,可能减少分化的发生。
|
| a:P<0.05,与对照组比较 图 4 FACS检测ESC表面β1-integrin和K19的表达 |
2.4 TFAM对ESC增殖能力的影响
将慢病毒感染的ESC在体外进行较短时间(10 d)的培养,采用CCK-8法隔日检测,以观察干扰组ESC和对照组ESC的生长增殖变化,如表 1所示随着培养时间的延长细胞数量逐渐增多,在第4~8天时增殖较快,第8~10天受培养条件限制增殖变缓。培养2 d后慢病毒开始表达并发挥干扰作用,第4天时干扰组ESC增殖率开始下降,且培养至第6、8天和第10天均出现统计学差异(P<0.05);结果提示,慢病毒干扰TFAM基因后ESC生长增殖能力明显降低。
| 组别 | 2 d | 4 d | 6 d | 8 d | 10 d |
| 对照组 | 0.073±0.002 | 0.140±0.006 | 0.289±0.035a | 0.568±0.066a | 0.686±0.042a |
| 干扰组 | 0.074±0.002 | 0.084±0.002 | 0.091±0.03 | 0.104±0.007 | 0.137±0.008 |
| a: P<0.05,与干扰组比较 | |||||
2.5 观察ESC克隆形成率的变化
经过筛选后,显微镜下连续观察10 d两组ESC,并每天记录ESC的克隆数量,按照公式统计比较克隆形成率。经统计学比较发现干扰组ESC克隆形成率比对照组高,差异有统计学意义(P<0.05)。进一步说明下调TFAM基因表达后,更加有利于ESC保持干细胞特性,减少分化事件的发生。
2.6 ESC端粒酶反转录酶表达水平比较两组人ESC端粒酶反转录酶表达均为阳性,干扰组人ESC端粒酶反转录酶表达呈弱阳性,对照组人ESC端粒酶反转录酶表达呈强阳性。对其表达进行定量分析,结果显示:干扰组平均光密度低于对照组,阳性面积值也低于对照组,差异均有统计学意义(P<0.05,图 5,表 2)。结果证明,下调TFAM后,ESC中端粒酶反转录酶表达受到抑制,且其表达水平与TERT正性相关。
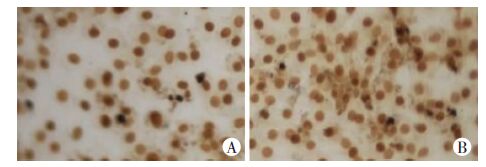
|
| A:干扰组;B:对照组 图 5 免疫细胞化学染色检测两组端粒酶反转录酶表达 (EnVision两步法 ×100) |
| 组别 | 平均光密度(A) | 阳性面积值(S) |
| 干扰组 | 0.078±0.025a | 1 387.84±456.80a |
| 对照组 | 0.112±0.035 | 1 854.05±425.15 |
| a: P=0.000,与对照组比较 | ||
2.7 ESC凋亡检测结果
Western blot检测凋亡相关蛋白表达的变化,结果显示:干扰组ESC中Caspase-3的表达高于对照组ESC(图 6)。用Quantity one软件计算条带灰度值,并用Caspase-3与GAPDH的比值作为相对表达值,统计3次重复的结果显示干扰组ESC中Caspase-3的表达(1.22±0.08)与对照组ESC(0.40±0.02)相比差异具有统计学意义(P<0.05),说明下调TFAM蛋白表达,对ESC凋亡具有促进作用。
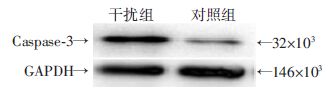
|
| 图 6 Western blot检测两组ESC中Caspase-3蛋白的表达 |
AnnexinV-PI染色流式细胞仪检测细胞凋亡如图 7,重复3次流式细胞仪检测结果后统计分析:对照组ESC的凋亡率为(1.30±0.12)%,干扰组ESC的凋亡率为(4.00±0.15)%,其差异具有统计学意义(P<0.01),同Western blot检测结果一致,说明TFAM基因干扰后促进了ESC的凋亡。

|
| A: 对照组;B:干扰组 图 7 流式细胞仪检测两组ESC凋亡的变化 |
3 讨论
ESC作为皮肤基底层的一群细胞,是一种具有周期性慢、克隆形成率高、增殖能力强和多能分化等显著特性的皮肤组织特异性干细胞。在体外环境中寿命较短,容易发生干细胞特征丢失而进入终末分化阶段,细胞的增殖、克隆形成率及凋亡等是反映ESC生长情况的重要生物学特征[6]。
通过前期研究结果提示线粒体缺失在ESC生物学特征及相关疾病研究中具有非常重要的作用[7]。随着ESC逐渐成为国内外的研究热点,关于线粒体对其生物学特征影响的研究显得尤为迫切[8]。而线粒体转录因子A(mitochondrial transcription factor A,TFAM)是调节线粒体基因复制和转录的主要调控因子[9],参与了线粒体的转录激活,保护线粒体不受氧化应激影响,在改善线粒体功能方面发挥了一定的作用。因此,我们推测TFAM基因可能通过对细胞线粒体的调控在ESC的特征中扮演着重要角色,但其对于ESC生物学特征的影响尚不十分清楚。
本研究通过慢病毒转染对TFAM基因沉默的人ESC的干细胞生物学特性进行观察。结果表明,干扰组ESC下调TFAM基因表达水平后,其干细胞增殖比例低于对照组,这与Flores等[10]研究结果相符;其克隆形成率和干细胞标志物阳性比例均高于对照组,说明下调TFAM基因有利于保持ESC的特性,并可能避免分化事件的发生。提示TFAM基因的正常表达有助于维持其生物学特征、调控其增殖水平、延长其寿命,而TFAM基因的沉默可导致人的ESC体外增殖活性降低,凋亡率增加。
染色体末端端粒(由重复DNA序列TTAGGG组成)的序列丢失,已被公认为与细胞的老化、凋亡有关[11]。细胞每次分裂,该段端粒均会发生50~200 bp的丢失,而当其缩短至一定程度,染色体就无法受其保护而免受重组与降解,使细胞分裂控制点得到信号并停止分裂,最终进入老化、死亡的过程。染色体末端端粒主要由RNA、端粒酶相关蛋白以及端粒酶反转录酶组成,而后者则是端粒酶活性中的关键酶。人体端粒酶主要存在于生殖细胞、恶性肿瘤细胞、干细胞及其他有再生能力的细胞中。有研究发现,端粒酶活性与肿瘤细胞的恶性增殖能力呈正相关。而在干细胞中,端粒酶活性会随着干细胞的不断分化而逐渐降低,直至终末分化细胞。因此,维持ESC中端粒酶活性能够提升ESC的体外复制与扩增能力[12]。研究表明,TFAM能够维持ESC端粒酶中的反转录酶的正常表达,可能与TFAM能够帮助细胞抗脂质过氧化,进而避免DNA损伤有关[13-15]。在本研究中,我们观察了TFAM基因沉默的ESC中的端粒酶活性,结果发现,干扰组的活性显著低于对照组,提示TFAM基因的沉默可通过降低端粒酶活性促进ESC的凋亡。同时,本实验通过对凋亡相关蛋白Caspase-3的半定量对比分析[16],发现下调TFAM基因后可以增加ESC的凋亡率,进一步说明TFAM对于维持ESC中端粒酶反转录酶的正常表达具有重要作用。
综上所述,TFAM基因的沉默可导致ESC体外增殖活性降低,减少ESC的分化可能,并通过降低端粒酶活性促进其凋亡过程,其正常表达对维持人ESC体外增殖活性、保持干细胞的干性具有重要意义。这些研究结果将对揭示干细胞的组织再生与修复规律,进一步完善创面愈合的基础理论以及指导临床应用,提高创伤早期治愈率具有一定的指导意义。
| [1] | Lathion D G, Rochat A, Knott G, et al. A single epidermal stem cell strategy for safe ex vivo, gene therapy[J]. Embo Molecular Medicine,2015, 7 (4) : 380 –393. DOI:10.15252/emmm.201404353 |
| [2] | Duarte B, Miselli F, Murillas R, et al. Long-Term Skin Regeneration From a Gene-Targeted Human Epidermal Stem Cell Clone[J]. Mol Ther,2014, 22 (11) : 1878 –1880. DOI:10.1038/mt.2014.187 |
| [3] | Liang X, Mei Y, Huang X, et al. Junctophilin 2, knockdown interfere with mitochondrium status in ESC-CMs and cardiogenesis of ES cells[J]. J Cell Biochem,2012, 113 (9) : 2884 –2894. DOI:10.1002/jcb.24164 |
| [4] | Lee E J, Kang Y C, Park W H, et al. Negative transcriptional regulation of mitochondrial transcription factor A (TFAM) by nuclear TFAM[J]. Biochem Biophys Res Commun,2014, 450 (1) : 166 –171. DOI:10.1016/j.bbrc.2014.05.082 |
| [5] | 郭锐, 曹川, 王珍祥, 等. SDF-1通过活化PKC-ζ趋化人表皮干细胞定向迁移的实验研究[J]. 第三军医大学学报,2011, 33 (4) : 335 –338. DOI:10.16016/j.1000-5404.2011.04.005 |
| [6] | Lenihan C, Rogers C, Metcalfe A D, et al. The effect of isolation and culture methods on epithelial stem cell populations and their progeny—toward an improved cell expansion protocol for clinical application[J]. Cytotherapy,2014, 16 (12) : 1750 –1759. DOI:10.1016/j.jcyt.2014.06.005 |
| [7] | Toyokuni S, Li J, Wang S, et al. Aging rather than sun exposure is a major determining factor for the density of miR-125b -positive epidermal stem cells in human skin[J]. Pathol Int,2015, 65 (8) : 415 –419. DOI:10.1111/pin.12320 |
| [8] | Baris O R, Klose A, Kloepper J E, et al. The Mitochondrial Electron Transport Chain Is Dispensable for Proliferation and Differentiation of Epidermal Progenitor Cells[J]. Stem Cells,2011, 29 (9) : 1459 –1468. DOI:10.1002/stem.695 |
| [9] | Chandrasekaran K, Anjaneyulu M, Inoue T, et al. Mitochondrial Transcription Factor A Regulation of Mitochondrial Degeneration in Experimental Diabetic Neuropathy[J]. Am J Physiol Endocrinol Metab,2015, 309 (2) : E132 –E141. DOI:10.1152/ajpendo.00620.2014 |
| [10] | Flores I, Cayuela M L, Blasco M A. Effects of telomerase and telomere length on epidermal stem cell behavior[J]. Science,2005, 309 (5738) : 1253 –1256. DOI:10.1126/science.1115025 |
| [11] | 吴珊, 刘宗石, 吴秉铨. 端粒和端粒酶与癌症[J]. 中华病理学杂志,1998, 27 (5) : 386 –387. |
| [12] | Iyer S, Xiao E, Alsayegh K, et al. Mitochondrial gene replacement in human pluripotent stem cell-derived neural progenitors[J]. Gene Therapy,2011, 19 (5) : 469 –475. DOI:10.1038/gt.2011.134 |
| [13] | Collu-Marchese M, Shuen M, Pauly M, et al. The regulation of mitochondrial transcription factor A (Tfam) expression during skeletal muscle cell differentiation[J]. Bioscience Reports,2015, 35 (3) : e00221 . DOI:10.1042/BSR20150073 |
| [14] | Kasashima K, Endo H. Interaction of human mitochondrial transcription factor A in mitochondria: its involvement in the dynamics of mitochondrial DNA nucleoids[J]. Genes to Cells,2015, 20 (12) : 1017 –1027. DOI:10.1111/gtc.12306 |
| [15] | Lenihan C, Rogers C, Metcalfe A D, et al. The effect of isolation and culture methods on epithelial stem cell populations and their progeny-toward an improved cell expansion protocol for clinical application[J]. Cytotherapy,2014, 16 (12) : 1750 –1759. DOI:10.1016/j.jcyt.2014.06.005 |
| [16] | Chen L, Li H, Li C, et al. Active ingredients of Plastrum Testudinis inhibit epidermal stem cell apoptosis in serum-deprived culture[J]. Zhong Xi Yi Jie He Xue Bao,2011, 9 (8) : 888 –893. DOI:10.3736/jcim20110811 |



