2. 400042 重庆,第三军医大学大坪医院野战外科研究所药剂科
2. Department of Pharmacy, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042, China
黑色素瘤(melanoma)是临床上常见的皮肤恶性肿瘤,该病恶性程度高、发展迅速、转移早而广泛。近年来,黑色素瘤的发病率逐年上升,已严重危及人类健康。目前,黑色素瘤的常用化学治疗药物有氮烯咪胺、达卡巴嗪、紫杉醇、卡铂等,但由于它们的选择性差、治疗效率低等缺点限制了其临床应用。因此,开发具有高效性和靶向性的抗黑色素瘤药物成为新的选择。最近研究表明:在黑色素瘤中,酪氨酸蛋白激酶(tyrosine protein kinase,PTK)异常表达,提示我们这是一种新的治疗靶点。PTK是控制细胞生长、增殖和分化的重要蛋白质,其介导的信号转导在肿瘤的发生、发展过程中起着非常重要的作用,是多种恶性肿瘤的治疗靶点之一[1]。达沙替尼(Dasatinib)商品名为Sprycel,是由美国Bristol-Myers Squibb公司研发的一种SRC激酶和BCR-ABL激酶双靶点酪氨酸激酶抑制剂。2006年6月28日通过美国FDA的审批,用于治疗慢性髓性白血病和费城染色体阳性的急性淋巴细胞性白血病[2]。现有研究表明:达沙替尼作为细胞生长抑制剂作用于多种实体瘤细胞系,抑制细胞增殖、侵袭和转移的过程[3]。但达沙替尼针对PTK靶标抑制黑色素瘤的作用还有待于研究。本研究以黑色素瘤B16F10细胞为体外模型,考察达沙替尼对B16F10细胞增殖、迁移和凋亡的影响,探寻黑色素瘤新的治疗药物。
1 材料与方法 1.1 主要试剂黑色素瘤细胞(B16F10细胞,美国ATCC公司),RPMI1640培养基(美国Gibco公司),胎牛血清(美国HyClone公司),青链霉素双抗(中国碧云天公司),达沙替尼(中国昊轩生物科技有限公司),MTT (美国Sigma公司),DMSO (美国Sigma公司),Annexin V-FITC细胞凋亡检测试剂盒(中国碧云天公司),线粒体膜电位检测试剂盒(JC-1)(中国碧云天公司),Transwell小室(美国Millipore公司),酶标仪(美国Molecular Devices公司),垂直层流洁净工作台(上海上净净化设备有限公司),流式细胞仪(美国Beckman公司),荧光分光光度计(日本HITACHI公司)。
1.2 细胞培养小鼠黑色素瘤细胞B16F10接种于含10%胎牛血清和1%青、链霉素的RPMI1640培养液中,置于37 ℃,5% CO2培养箱中培养,以0.25%胰酶消化传代,所有实验均选用对数生长期细胞。
1.3 MTT法检测细胞的增殖能力取对数生长期的B16F10细胞,按104个/孔接种于96孔板中,细胞贴壁过夜。将达沙替尼储备液用培养液稀释成不同浓度(3.125、6.250、12.500、25.000、50.000 μg/mL)后加药,同时设置空白对照孔和调零孔。培养24 h后,每孔分别加入10 μL MTT溶液(5 mg/mL),继续培养4 h。弃去上清,每孔加入150 μL DMSO充分溶解甲臜结晶,酶标仪测定490 nm处的光密度值。按照下列公式计算:存活率=(给药组光密度值-空白对照组光密度值)/(实验对照组光密度值-空白对照组光密度值)×100%。
1.4 细胞划痕实验将B16F10细胞按3×105/孔接种于6孔板中,细胞贴壁过夜。用10 μL无菌枪头在细胞层上垂直划痕,PBS冲洗划痕时脱落的细胞2~3次。用含低、中、高浓度(6.250、12.500、25.000 μg/mL)的达沙替尼培养液作用细胞24 h,空白对照组加入等量不含药的培养液,阳性对照组加入等量含12.5 μg/mL商品化特素的培养液(紫杉醇组)。分别于药物作用的0 h和24 h拍照观察细胞形态,比较不同浓度组达沙替尼对细胞迁移能力的影响。
1.5 Transwell体外迁移实验采用Millipore公司8 μm规格的24孔Transwell小室,消化收集对数生长期细胞,在实验组上室中加入200 μL含5%胎牛血清和浓度为12.500 μg/mL达沙替尼的B16F10细胞悬液(约含105个细胞),空白对照组不含药。同时实验组和对照组下室均加入600 μL含20%胎牛血清的培养液。培养24 h后,移去小室,吸除上室中培养液,PBS洗涤后用棉签擦除上室未迁移细胞。冷甲醇固定20 min,用0.1%结晶紫染色10 min,PBS洗涤。倒置显微镜下观察,随机选取3个视野,拍照计数。
1.6 形态学观察取对数生长期B16F10细胞按2×105/孔接种于6孔板中,细胞贴壁过夜。实验组和对照组浓度设置同1.4项。待药物作用于B16F10细胞24 h后,吸弃孔内培养液,4%多聚甲醛固定10 min,PBS洗涤,倒置显微镜观察细胞的生长状况。将上述细胞用DAPI染色后,采用荧光显微镜观察细胞核的形态变化。
1.7 细胞凋亡的检测将B16F10细胞按3×105/孔接种于6孔板中,细胞贴壁过夜。实验组和对照组浓度设置同1.4项,待药物作用24 h后,PBS洗涤,0.25%胰酶消化,1 000 r/min离心5 min,收集细胞。分别加入500 μL Annexin V-FITC结合液重悬细胞后,再加入5 μL Annexin V-FITC和5 μL PI染色液,混匀。室温避光孵育10 min,采用流式细胞仪进行凋亡检测。
1.8 细胞周期的检测取对数生长期B16F10细胞,按3×105/孔接种于6孔板中,贴壁过夜。用浓度为12.500 μg/mL的达沙替尼作用24 h,空白对照组加入等量不含药的培养液。消化收集,PBS洗涤,加入一定体积的PBS/乙醇混合液,4 ℃固定24 h以上。离心去乙醇,PBS洗涤后制成细胞悬液,加入5 μL RNase (10 mg/mL),37 ℃放置1 h,PI (100 μg/mL)避光染色30 min,采用流式细胞仪检测细胞周期。
1.9 线粒体膜电位的检测取对数生长期B16F10细胞,按2×105/孔接种于6孔板中,贴壁过夜。用浓度为12.500 μg/mL的达沙替尼作用24 h,空白对照组和阳性对照组加入等量不含药的培养液。给药结束后,阳性对照组加入10 μmol/L氰氯苯腙质子载体(carbonyl cyanide m-chlorophenyl-hydrazone,CCCP)处理20 min。吸弃培养液,PBS洗涤,加入1 mL细胞培养液和1 mL JC-1染色工作液,充分混匀。37 ℃孵育20 min。孵育结束后弃上清,用JC-1染色缓冲液(1×)洗涤2次。加入2 mL无血清细胞培养液,荧光显微镜下观察。
1.10 Caspase 3和Caspase 9活性的检测取对数生长期B16F10细胞,按3×105/孔接种于6孔板中,贴壁过夜。用浓度为12.500 μg/mL的达沙替尼作用24 h,空白对照组加入等量不含药的培养液。给药结束后,PBS洗涤,消化收集细胞。加入100 μL冰冷Lysis Buffer,吹打均匀,冰浴裂解40 min。4 ℃ 10 000 r/min离心1 min,将上清转移到预冷的离心管中。取30 μL细胞裂解上清,加入50 μL的2×Reaction Buffer和10 μL ddH2O。再加入10 μL Caspase 3 Substrate/Caspase 9 Substrate反应液,于37 ℃避光孵育1.5 h,用荧光分光光度计测定荧光强度(激发波长=485 nm,发射波长=535 nm)。通过计算RFU达沙替尼/RFU阴性对照的倍数来确定达沙替尼Caspase 3和Caspase 9的活化程度。
1.11 统计学分析实验数据以x±s表示,采用SPSS 18.0统计软件进行独立样本t检验。以P < 0.05表示差异具有统计学意义。
2 结果 2.1 达沙替尼对B16F10细胞增殖的抑制作用MTT法检测不同浓度(3.125、6.250、12.500、25.000、50.000 μg/mL)达沙替尼作用于B16F10细胞24、48 h后的细胞活力,结果如图 1所示:达沙替尼对B16F10细胞生长有明显的抑制作用,其作用24 h和48 h的细胞存活率均显著小于空白对照组(P < 0.05),且随着药物浓度增大,对细胞抑制作用增强,呈现浓度依赖性;达沙替尼组作用48 h较同浓度作用24 h细胞存活率均减小,且差异有统计学意义(P < 0.05),达沙替尼对B16F10细胞的增殖抑制作用呈现时间依赖性。
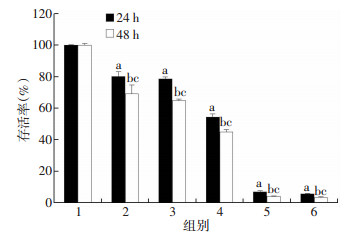
|
| 1:空白对照组;2~6:分别为3.125、6.250、12.500、25.000、50.000 μg/mL达沙替尼组;a:P < 0.05,与空白对照组(24 h)比较;b:P < 0.05,与空白对照组(48 h)比较;c:P < 0.05,与同浓度达沙替尼组作用24 h比较 图 1 MTT检测达沙替尼对B16F10细胞增殖的影响 |
2.2 达沙替尼对B16F10细胞迁移能力的影响
细胞划痕实验结果如图 2所示:空白对照组中B16F10细胞向划痕处迁移,紫杉醇组和达沙替尼组明显地抑制了B16F10细胞的迁移,中、高浓度(12.500、25.000 μg/mL)达沙替尼处理组基本无细胞迁移行为。选取中浓度(12.500μg/mL)的达沙替尼进一步进行Transwell体外迁移实验,结果如图 3所示:空白对照组中B16F10细胞向下室迁移[(100.0±10.2)%],达沙替尼明显地抑制了B16F10细胞的迁移行为[(43.8±6.4)%],与空白对照组相比差异具有统计学意义(P < 0.05)。

|
| A:空白对照组;B:12.500 μg/mL紫杉醇组;C:低浓度(6.250 μg/mL)达沙替尼组;D:中浓度(12.500 μg/mL)达沙替尼组;E:高浓度(25.000 μg/mL)达沙替尼组 图 2 细胞划痕实验观察达沙替尼对B16F10细胞迁移能力的影响(×40) |
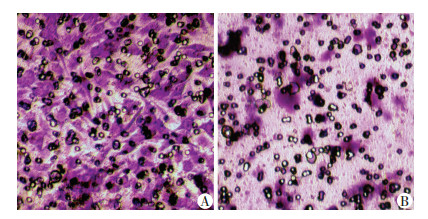
|
| A:空白对照组;B:中浓度(12.500 μg/mL)达沙替尼组 图 3 Transwell体外迁移实验观察达沙替尼对B16F10细胞迁移能力的影响(×100) |
2.3 达沙替尼对B16F10细胞形态学的影响
达沙替尼作用B16F10细胞24 h后,观察细胞形态学变化,如图 4所示:空白对照组B16F10细胞贴壁生长,呈不规则多角形,胞质饱满且中间有圆形细胞核,生长快速;紫杉醇组B16F10贴壁细胞部分变圆,体积变小;达沙替尼组随着浓度的增加B16F10贴壁细胞由不规则多角形变为圆形,细胞皱缩,连接松散并有部分细胞脱落。DAPI染色后,观察达沙替尼作用后细胞核的变化情况,如图 5所示:空白对照组细胞核形态完整,染色质均匀,细胞核呈现明亮的蓝色荧光;紫杉醇组有部分细胞染色质浓缩、核裂解;达沙替尼组随着浓度的增加染色质浓缩越明显、核裂解程度越剧裂,甚至出现凋亡小体。

|
| 图 4 达沙替尼作用B16F10细胞后细胞形态学变化(倒置显微镜×200) |
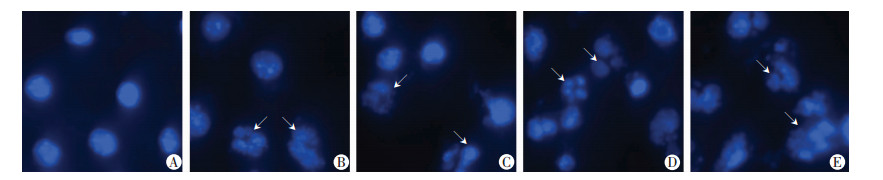
|
| A:空白对照组;B:12.500 μg/mL紫杉醇组;C:低浓度(6.250 μg/mL)达沙替尼组;D:中浓度(12.500 μg/mL)达沙替尼组;E:高浓度(25.000 μg/mL)达沙替尼组箭头示裂解的细胞核 图 5 达沙替尼作用B16F10细胞后细胞核形态学变化(荧光显微镜×400) |
2.4 达沙替尼对B16F10细胞凋亡率的影响
流式细胞仪检测达沙替尼对B16F10细胞凋亡率的影响,结果如图 6所示:随着达沙替尼浓度的增加,B16F10活细胞的数量逐渐减少,凋亡细胞数量逐渐增多。空白对照组的细胞凋亡率为(1.75±0.19)%,紫杉醇组的细胞凋亡率为(28.03±4.69)%,低、中、高浓度(6.25、12.5、25 μg/mL)达沙替尼组的细胞凋亡率分别为(34.06±0.83)%、(50.24±1.66)%和(88.91±0.96)%,呈现浓度依赖性。中浓度(12.5 μg/mL)达沙替尼组的细胞凋亡率显著高于等浓度的紫杉醇组(P < 0.05),说明达沙替尼能够有效地诱导B16F10细胞的凋亡,效果强于等浓度的阳性对照紫杉醇。
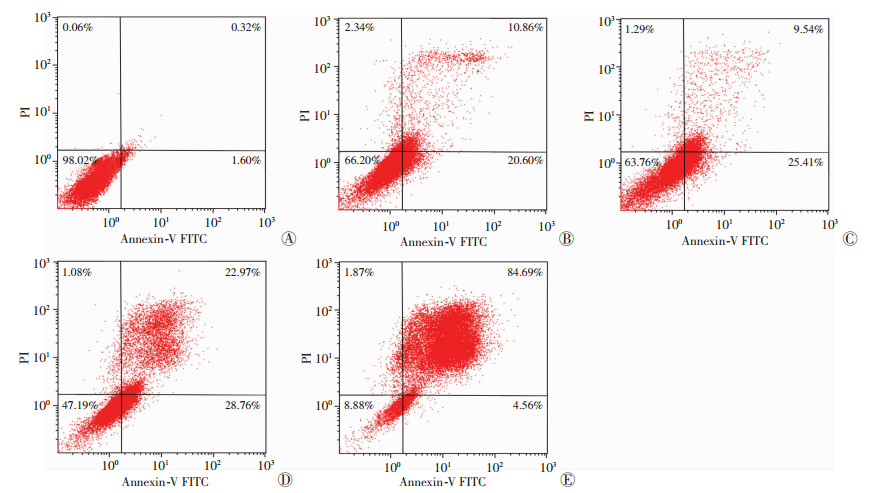
|
| A:空白对照组;B:12.500 μg/mL紫杉醇组;C:低浓度(6.250 μg/mL)达沙替尼组;D:中浓度(12.500 μg/mL)达沙替尼组;E:高浓度(25.000 μg/mL)达沙替尼组 图 6 流式细胞仪检测达沙替尼对B16F10细胞凋亡率的影响 |
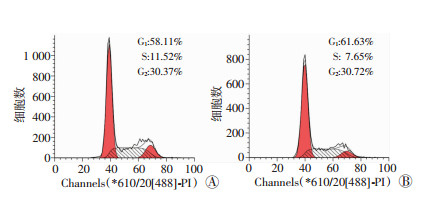
2.5 达沙替尼对B16F10细胞周期的影响
采用中浓度(12.500 μg/mL)的达沙替尼作用于B16F10细胞24 h后,流式细胞仪检测药物对细胞周期的影响,结果如图 7所示:达沙替尼组与空白对照组相比,G1期和S期细胞比例略微增加,G2期细胞比例略微减少;达沙替尼对G1期的阻滞作用较小,对B16F10细胞周期的影响也较小。现有研究报道紫杉醇是细胞周期特异性药物,主要靶点是微管蛋白/微管系统,它能促进微管聚合,抑制微管降解,使细胞分裂阻滞在G2/M期[4]。由于其与达沙替尼作用方式不同,故以下探讨机制部分不设置阳性对照组。
|
| A:空白对照组;B:中浓度(12.500 μg/mL)达沙替尼组 图 7 流式细胞仪检测达沙替尼对B16F10细胞周期的影响 |
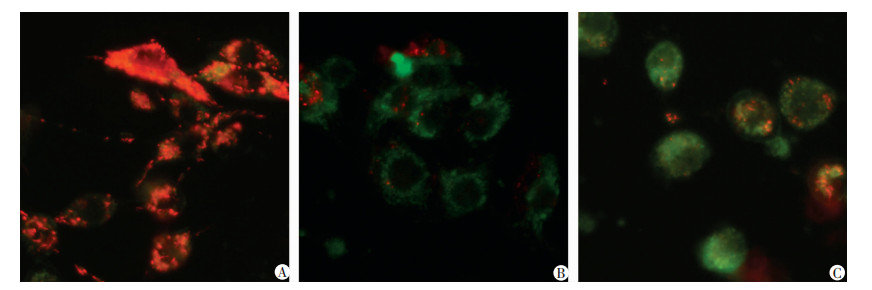
2.6 达沙替尼对B16F10细胞线粒体膜电位的影响
以红色荧光强度(JC-1聚合物)与绿色荧光强度(JC-1单体)的比值表示线粒体膜电位(ΔΨm)。荧光显微镜下观察结果如图 8所示:正常B16F10细胞中,JC-1在线粒体内膜侧积聚形成JC-1聚合物,空白对照组JC-1染色后表现为红色荧光;CCCP处理正常细胞诱导线粒体膜电位下降,阳性对照组JC-1染色后表现为绿色荧光;中浓度(12.500 μg/mL)的达沙替尼作用于B16F10细胞24 h后,红色荧光减弱,绿色荧光增强,ΔΨm下降,这说明达沙替尼可能通过线粒体途径介导B16F10细胞的凋亡。
|
| A:空白对照组;B:阳性对照组;C:中浓度(12.5 μg/mL)达沙替尼组 图 8 达沙替尼对B16F10细胞线粒体膜电位的影响(荧光显微镜×400) |
2.7 Caspase 3和Caspase 9活性的检测
荧光分光光度计测定结果显示Caspase 3的活化程度为1.80,Caspase 9的活化程度为2.25。Caspase 3和Caspase 9的活性均增加,这表明达沙替尼除了已知的SRC激酶等介导的信号通路外,还可以通过线粒体途径介导的Caspase通路引起细胞的凋亡。
3 讨论黑色素瘤是临床上较为常见的恶性肿瘤之一,也是发展转移最快、预后最为不良的恶性肿瘤之一。临床上常使用氮烯咪胺、达卡巴嗪或以紫杉醇为主的联合化疗作为主要治疗方案,但由于其选择性低、毒性大,易使恶性黑色素瘤对化疗药物产生高度耐受导致治疗失败。因此,开发新的高选择性、高效低毒的黑色素瘤靶向治疗药物显得尤为迫切。PTK在调控细胞功能方面发挥着关键作用,它们的主要功能是催化ATPγ位的磷酸基团转移到蛋白质底物的酪氨酸残基上,通过靶蛋白的磷酸化反应来完成激酶构象的转化,实现细胞生物信号的传导。现有研究表明:超过50%的原癌基因和癌基因产物都具有异常的酪氨酸蛋白激酶活性[5]。黑色素瘤涉及多种PTKs介导的信号转导通路,如SRC激酶[6]、促分裂原活化蛋白激酶(MAPK)[7]、JAK/STAT[8]等。达沙替尼是一种SRC激酶和BCR-ABL激酶双靶点酪氨酸激酶抑制剂,其对SRC激酶活性的抑制作用强于BCR-ABL激酶。达沙替尼能够有效地抑制伊马替尼耐受的野生型(不包括T315I突变)和BCR-ABL突变的细胞株活性,临床上主要用于治疗对甲磺酸伊马替尼耐药,或不耐受的费城染色体阳性(Ph+)慢性髓细胞白血病慢性期、加速期和急变期(急粒变和急淋变)成年患者。现有研究报道达沙替尼可用于多种实体瘤的治疗,如肺癌[9]、乳腺癌[10]、肉瘤[11]和间质瘤[12]等。
本研究进行了酪氨酸激酶抑制剂达沙替尼对黑色素瘤B16F10细胞抑制的体外研究。MTT实验结果显示达沙替尼能够浓度和时间依赖性地抑制黑色素瘤B16F10细胞的增殖。本研究选取了低、中、高3个浓度(6.250、12.500、25.000 μg/mL)组的达沙替尼进行后续实验。细胞划痕实验结果显示达沙替尼能够浓度依赖性地抑制黑色素瘤B16F10细胞的迁移,在此基础上进一步选取中浓度(12.500 μg/mL)的达沙替尼进行Transwell体外迁移实验,检测结果与Buettner等[13]的研究报道一致。
细胞周期分为间期(G1、S、G2)与分裂期(M)两个阶段,其中G1/S和G2/M是最为重要的细胞周期调控检验点。这两个调控检验点处于活跃的分子水平变化时期,易受环境条件的影响。如果能够人为地进行调控,可以控制肿瘤的生长,提高肿瘤的治疗疗效。许多抗肿瘤药物都会引起细胞周期的改变,如本研究中使用的细胞周期特异性药物紫杉醇,它作用于微管蛋白/微管系统,使细胞周期阻滞在G2/M期。本研究采用流式细胞仪检测达沙替尼对B16F10细胞周期和细胞凋亡率的影响,结果表明达沙替尼能够浓度依赖性地诱导黑色素瘤B16F10细胞的凋亡,但并不能明显地引起细胞周期改变。这提示达沙替尼可能不是通过细胞周期途径调控细胞的凋亡。因此,为了进一步探讨可能的作用机制,我们分析了细胞线粒体膜电位的情况。线粒体是细胞有氧呼吸的主要场所,参与机体内许多代谢过程,在机体生长发育、代谢、衰老、死亡等方面发挥着重要的作用。线粒体膜电位是维持线粒体正常功能所必要的。荧光显微镜测定结果表明达沙替尼能够诱导细胞凋亡,线粒体膜电位去极化,JC-1从线粒体内释放,浓度降低,逆转为发射绿色荧光的单体形式;进一步检测Caspase 3和Caspase 9的活化程度,结果表明两者的活性均增加。这提示达沙替尼除了通过抑制经典的SRC激酶活性抗肿瘤外,还存在其他潜在的抗肿瘤机制,如通过线粒体依赖性途径介导细胞凋亡。细胞的线粒体膜通透性改变孔开放,引起ΔΨm下降和促凋亡物质释放,由此进一步活化Caspase 9及下游效应分子Caspase 3,引起细胞凋亡。但是在抑制黑色素瘤过程中,SRC激酶与线粒体途径诱导细胞凋亡之间的联系及其具体机制还需进一步的研究。
综上所述,酪氨酸激酶抑制剂达沙替尼在体外研究中显示出了良好的抗黑色素瘤作用,能够有效地抑制黑色素瘤B16F10细胞的增殖与迁移,并诱导细胞的凋亡。PTK为黑色素瘤的治疗提供了新的靶点,达沙替尼作为酪氨酸激酶抑制剂有望成为一种新的治疗黑色素瘤的小分子靶向药物。
| [1] | Mazurenko N N, Tsyganova I V, Lushnikova A A, et al. The spectrum of oncogene mutations differs among melanoma subtypes[J]. Molecular Biology,2015, 49 (6) : 917 –923. DOI:10.1134/S0026893315060163 |
| [2] | Mccormack P L, Keam S J. Dasatinib: a review of its use in the treatment of chronic myeloid leukaemia and Philadelphia chromosome-positive acute lymphoblastic leukaemia[J]. Drugs,2011, 71 (13) : 1771 –1795. DOI:10.2165/11207580-000000000-00000 |
| [3] | Araujo J, Logothetis C. Dasatinib: a potent SRC inhibitor in clinical development for the treatment of solid tumors[J]. Cancer Treat Rev,2010, 36 (6) : 492 –500. DOI:10.1016/j.ctrv.2010.02.015 |
| [4] | Das G C, Holiday D, Gallardo R, et al. Taxol-induced cell cycle arrest and apoptosis: dose-response relationship in lung cancer cells of different wild-type p53 status and under isogenic condition[J]. Cancer Lett,2001, 165 (2) : 147 –153. DOI:10.1016/S0304-3835(01)00404-9 |
| [5] | Arora A, Scholar E M. Role of Tyrosine Kinase Inhibitors in Cancer Therapy[J]. J Pharmacol Exp Ther,2005, 315 (3) : 971 –979. DOI:10.1124/jpet.105.084145 |
| [6] | Tokuhisa Y, Lidsky M E, Toshimitsu H, et al. SRC family kinase inhibition as a novel strategy to augment melphalan-based regional chemotherapy of advanced extremity melanoma[J]. Ann Surg Oncol,2014, 21 (3) : 1024 –1030. DOI:10.1245/s10434-013-3387-6 |
| [7] | Sullivan R J, Flaherty K. MAP kinase signaling and inhibition in melanoma[J]. Oncogene,2013, 32 (19) : 2373 –2379. DOI:10.1038/onc.2012.345 |
| [8] | Dalgic C T, Kaymaz B T, Özkan M C, et al. Investigating the Role of JAK/STAT Pathway on Dasatinib-Induced Apoptosis for CML Cell Model K562[J]. Clin Lymphoma Myeloma Leuk,2015, 15 (Suppl) : S161 –S166. DOI:10.1016/j.clml.2015.02.012 |
| [9] | Wang Z, Li L, Shao Z, et al. The combination of dasatinib and gefitinib enhances the killing effect of gefitinib on HCC827 lung cancer cells[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2016, 32 (5) : 595 –599. |
| [10] | Kim E M H, Mueller K, Gartner E, et al. Dasatinib is synergistic with cetuximab and cisplatin in triple-negative breast cancer cells[J]. J Surg Res,2013, 185 (1) : 231 –239. DOI:10.1016/j.jss.2013.06.041 |
| [11] | Niles L P, Armstrong K J, Rincón Castro L M, et al. Neural stem cells express melatonin receptors and neurotrophic factors: colocalization of the MT1 receptor with neuronal and glial markers[J]. BMC Neurosci,2004, 5 : 41 . DOI:10.1186/1471-2202-5-41 |
| [12] | Dong Y, Liang C, Zhang B, et al. Bortezomib enhances the therapeutic efficacy of dasatinib by promoting c-KIT internalization-induced apoptosis in gastrointestinal stromal tumor cells[J]. Cancer Lett,2015, 361 (1) : 137 –146. DOI:10.1016/j.canlet.2015.02.044 |
| [13] | Buettner R, Mesa T, Vultur A, et al. Inhibition of Src family kinases with dasatinib blocks migration and invasion of human melanoma cells[J]. Mol Cancer Res,2008, 6 (11) : 1766 –1774. DOI:10.1158/1541-7786.MCR-08-0169 |



