肿瘤转移是肿瘤引起死亡的主要原因。虽然现阶段以放疗、化疗及联合标靶药物为主的肿瘤标准治疗方法得以迅猛发展,但其对于转移性肿瘤的疗效却微乎其微,肿瘤患者死亡率居高不下。Weichselbaum和Hellman于1995年首次提出临床寡灶型转移肿瘤的假说,他们认为在某些转移性肿瘤的临床演进过程中,以有限数量的转移灶或受累器官为标志的“寡灶转移”(oligometastasis)(全身累积转移灶数目<5)的存在,为治疗转移期肿瘤提供了一个契机[1-2]。手术切除和立体定向全身放疗(stereotactic body radiation therapy, SBRT)在针对寡灶型转移肿瘤的治疗方面获得了显著成效,大部分患者通过治疗,能有效地控制病情,甚至有部分转移性肿瘤患者得到根治[3-8]。但是,肿瘤从寡灶型转移演变为多灶型转移(全身累积转移灶数目≥5)是寡灶型转移针对性治疗失败的根本原因[9]。这提示寡灶型向多灶型转移的演变过程很有可能是一个治疗转移期肿瘤的新靶点。我们前期的研究结果显示:在从寡灶型演进到多灶型转移患者转移组织中,miR200c的表达比稳定寡灶型转移患者转移组织中要高20倍[10]。因此,本研究通过建立稳定上调miR200c寡灶型转移细胞株,研究并描述其体外生物学特性(增殖能力、克隆能力、迁移能力、侵袭能力),为该课题进一步探究肿瘤寡灶型转移向多灶型转移演变机制提供实验依据。
1 材料与方法 1.1 材料胎牛血清(美国ExCell bio公司),DMEM培养基(美国Gibco公司),TRIzol试剂(美国Invitrogen公司),cDNA第一链合成试剂盒、SYBR染料法荧光定量PCR试剂盒(中国Sangon公司),PBS (美国HyClone公司),双抗和两性霉素B (美国HyClone公司),CCK-8试剂盒(日本同仁公司),琼脂粉(美国Sigma公司),基质胶(matrigel,美国BD公司),miR200c慢病毒载体和LV3NC阴性对照载体(中国Sangon公司),Transwell小室(美国Milipore公司),FSX-100智能图像导航仪(日本Olympus公司),流式细胞仪、荧光定量PCR仪(美国BD公司),37 ℃细胞培养箱(日本Olympus公司),4 ℃离心机(美国Thermo公司)。
1.2 细胞培养经活体验证的来源于人乳腺癌稳定寡灶型转移细胞株MDA-435-OL和稳定多灶型转移细胞株MDA-435-POL的建立:从裸鼠尾静脉注射,于裸鼠肺上形成相应的转移灶,再进行组织细胞原代提取和培养,由实验室保存[10]。细胞用含10%胎牛血清、1%双抗、1%两性霉素B的DMEM培养基,于37 ℃细胞培养箱培养,CO2体积分数为5%。寡灶型细胞贴壁梭形分化明显,呈聚集克隆状生长。多灶型细胞贴壁分化程度低,多为圆形和短梭形,呈弥散性生长。
1.3 细胞感染和纯化取对数生长期的MDA-435-OL细胞进行慢病毒感染,按上海Sangon公司提供的病毒使用说明方法和前期预实验结果,用miR200c过表达病毒载体和阴性对照LV3NC病毒载体分别感染目的细胞,病毒MOI值为30,polybrene工作浓度为5 μg/mL。感染72 h后于FSX-100智能导航仪下拍摄荧光图片,确定感染效率。后经流式细胞仪根据GFP的表达情况分选、纯化GFP阳性细胞。
1.4 RT-PCR检测细胞miR200c的表达收集稳定寡灶型转移细胞MDA-435-OL和纯化后的MDA-435-OL-miR200c、MDA-435-OL-LV3NC细胞,用TRIzol试剂提取总RNA,按照cDNA第一链合成试剂盒说明书逆转录成cDNA,逆转录过程采用加尾法逆转录体系,反应条件为:37 ℃,60 min;85 ℃,5 min;4 ℃保存。再按照SYBR染料法荧光定量PCR试剂盒说明书对miR200c进行扩增,内参用U6。miR200c正向引物序列为:5′-GCTAATACTGCCGGGTAATGATG-3′;U6的正向引物序列为:5′-GCTTCGGCAGCACATA-TACTAAAAT -3′;miR200c和U6的反向引物是试剂盒自带的通用反向引物,序列不公开。PCR反应条件为:第一步95 ℃,30 s;第二步95 ℃,5 s,65 ℃,30 s,共40个循环。PCR数据用2-△△Ct法进行分析。
1.5 CCK-8检测细胞增殖曲线实验分为3组:MDA-435-OL-miR200c为实验组,MDA-435-OL-LV3NC为阴性对照组,MDA-435-POL为阳性对照组,均有空白对照。实验在96孔板中进行,每个组每天设置5个孔,实验时间为7 d。每孔细胞初始量为2 000个,细胞悬液100 μL。测值前,每孔加入CCK-8试剂10 μL,在37 ℃培养箱内反应2 h后于酶标仪波长450 nm处检测光密度值[D(450)],按照D(450)真实=D(450)测 -D(450)空白计算出相应的真实D(450)值(5个复孔取平均值),以所测真实D(450)值为纵坐标,实验时间为横坐标绘制细胞增殖曲线。在增殖曲线对数生长期内任意取两点,根据细胞倍增时间(doubling time, DT)=t×[lg2/(lgNt-lgNo)]计算出DT,其中t为增殖曲线两点间的时间间隔,No为首次记录点的D(450)值,Nt为t时间后记录的D(450)值。
1.6 琼脂平板克隆实验取3组对数生长期的细胞制成单细胞悬液,将细胞悬液作梯度倍数稀释,每组分别以每孔50个细胞的梯度密度接种于含2 mL培养液的35 mm培养皿中,并轻轻摇晃,使细胞分散均匀。待5 h后镜下可观察到细胞已经悉数贴壁,此时将皿中培养基换成含0.2% agar的培养基,置于37 ℃培养箱内培养7~12 d。期间可观察,当皿中出现肉眼可见克隆斑时即终止培养,弃去agar上清,沿壁缓慢加入PBS润洗2次。之后加入2 mL冰甲醇固定20 min,结晶紫染色5 min,PBS轻轻润洗后室温干燥。干燥完成后对着色的克隆斑进行计数,根据公式计算出细胞体外克隆形成率:克隆形成率=(克隆数/接种细胞数)×100%。
1.7 Transwell小室迁移实验取3组对数生长期细胞用不含血清的DMEM制成单细胞悬液备用,按每个上室200 μL总体积、细胞数为4×104个滴加细胞悬液至上室,下室中添加800 μL含10%FBS的DMEM,小心将小室移至下室液中,切勿产生气泡,将24孔板放入细胞培养箱孵育。16~24 h后取出孔板,移出小室后观察下室液。若在下室可见细胞碎片或完整细胞,则终止迁移实验,若没有则继续培养,时间不超过24 h。完成迁移后小室底膜经冰甲醇固定10 min,PBS清洗2遍,结晶紫染色5 min,润洗3遍后切下,底面朝上用树脂封片,于FSX-100智能导航仪下拍摄细胞图片,随机选取10个40倍视野下的图像计数,取平均值表征迁移细胞数,实验重复3次。
1.8 Transwell小室侵袭实验实验设置、步骤及计数方法如1.7所述,侵袭实验在添加细胞之前要在小室底膜上室面铺上一层基质胶。按照matrigel :无血清DMEM=1 :11的比例配制,每孔上室加60 μL,待胶铺平并晾干后再进行后续实验。若胶干燥时间过长,使用前可在上室加100 μL无血清DMEM水化2 h再进行后续实验。
1.9 统计学分析采用SPSS 22.0统计软件,计量资料以x±s表示,不同组别数据比较采用单因素方差分析进行均值多重比较。以P < 0.05表示差异具有统计学意义。
2 结果 2.1 验证miR200c感染后在MDA-435-OL寡灶细胞中的稳定过表达经慢病毒感染的MDA-435-OL-miR200c细胞,miR200c的表达可以用与之共表达的GFP的阳性率判断,用流式细胞仪进行miRNA200c表达细胞的纯化和分选。分选之后GFP阳性率>90%(图 1),符合后续实验要求。RT-PCR检测结果显示MDA-435-OL-miR200c细胞中miR200c的表达量是MDA-435-OL的(9.80±1.13)倍,差异有统计学意义(P < 0.05)。阴性对照细胞中miR200c的表达量是MDA-435-OL的(1.14±0.10)倍,差异无统计学意义(P>0.05)。MDA-435-OL-miR200c细胞中miR200c的表达量是阴性对照细胞的(8.68±1.66)倍,差异有统计学意义(P < 0.05)。表明获得了miR200c稳定过表达的细胞株MDA-435-OL-miR200c。
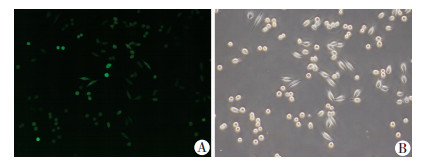
|
| A:荧光图;B:白光图 图 1 FSX-100智能图像导航仪观察MDA-435-OL-miR200c感染后细胞GFP的阳性表达(×20) |
2.2 miR200c的上调对细胞体外增殖的影响
miR200c的上调对细胞体外增殖的影响由比较CCK-8实验量化的细胞DT所决定。实验组细胞DT为16.33 h,阴性对照组细胞为16.82 h,阳性对照组细胞为16.61 h,组间差异无统计学意义(P>0.05,图 2)。表明miR200c的稳定上调不改变寡灶型转移细胞的增殖特性。
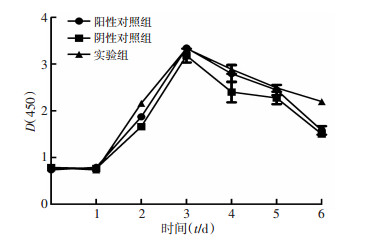
|
| 图 2 CCK-8检测3组细胞体外增殖能力 |
2.3 miR200c的上调显著提高寡灶型转移细胞的克隆生成能力
miR200c的上调对细胞体外克隆形成的影响由比较克隆斑形成率决定。克隆斑染色(图 3)后对其进行计数,根据公式算出各组细胞克隆形成率:阳性对照组为(0.70±0.02),实验组为(0.69±0.02),阴性对照组为(0.53±0.02)。数据单因素方差分析进行多重比较后证实实验组克隆形成率与阳性对照组相当,均显著高于阴性对照组(P < 0.05)。表明miR200c的稳定上调显著提高寡灶型转移细胞的克隆形成特性,且与多灶转移型细胞的克隆形成能力相当。

|
| A:克隆斑在显微镜下的形态(×4);B:各组琼脂平板克隆斑实验结果1:阳性对照组;2:实验组;3:阴性对照组 图 3 在寡灶型转移的细胞株中稳定上调miR200c对细胞克隆形成能力的影响 |
2.4 miR200c的上调显著增强寡灶型转移细胞的迁移能力
结果见图 4。阳性对照组迁移细胞数为(22.20±2.39),实验组为(21.20±2.35),阴性对照组为(12.10±2.28)。数据单因素方差分析进行多重比较后证实:实验组迁移细胞数与阳性对照组相当,均显著高于阴性对照组(P < 0.05)。表明miR200c的稳定高调显著增强了寡灶型转移细胞的体外迁移能力,与多灶转移型细胞的迁移能力相当。

|
| A:阳性对照组;B:实验组;C:阴性对照组 图 4 Transwell小室检测各组细胞的迁移能力(×40) |
2.5 miR200c的上调显著增强寡灶型转移细胞的侵袭能力
结果见图 5。各组侵袭细胞数:阳性对照组为(57.60±5.56),实验组为(56.80±5.22),阴性对照组为(40.10±2.51)。数据单向分析、多重比较检验后证实:实验组侵袭细胞数与阳性对照组相当,均显著高于阴性对照组(P < 0.05)。表明miR200c的稳定上调显著增强了寡灶型转移细胞的体外迁移能力,且与多灶转移型细胞的侵袭能力相当。
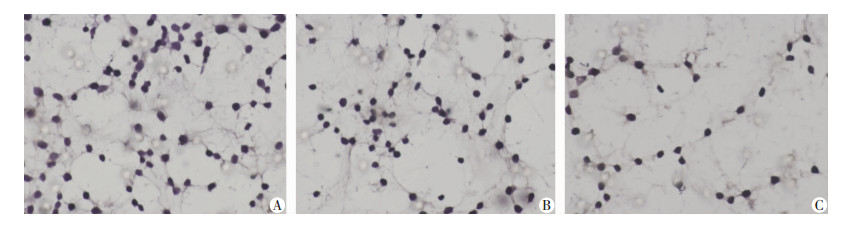
|
| 图 5 Transwell小室检测各组细胞的侵袭能力(×10) Fig.5 A:阳性对照组; B:实验组; C:阴性对照组 |
3 讨论
肿瘤转移是患者致死的重要原因,当部分发生转移的肿瘤引发的病灶数有限时,可通过手术切除或放疗方式治疗,且效果很可观,甚至有25%的患者可以痊愈或保持这种缓慢的转移病灶进程[11-16]。这为转移性肿瘤的治疗提供了一个新思路。临床上将这种发生转移,单器官病灶数 < 5或全身受累器官数 < 5的转移定义为寡灶型转移,反之,单器官病灶数多于5或全身受累器官数>5的转移定义为多灶型转移。大约75%的患者治疗初期呈现出肿瘤寡灶型转移的特点,但在治疗过程中,寡灶型转移向多灶型转移演变,导致寡灶型转移肿瘤治疗失败。我们前期临床研究发现稳定寡灶型转移和能从寡灶型转移演变成多灶型转移的组织中microRNA表达图谱有显著差异[10, 17-19],从分子层面提供了依据,说明两者之间确有不同。
miRNA是多细胞生物正常发展及病理演变过程的关键调节因子,并参与调节几乎所有已知的癌变过程,包括细胞生长、分化、增殖、血管生成以及侵袭和转移[20]。在与肿瘤发生、发展相关的众多microRNA中,miR-200家族备受关注,其中研究较多的是miR200c。早期研究表明:在肿瘤发生初期,miR200c通过抑制靶基因Zeb1、Zeb2上调E-cadherin并下调Vimenten,维持原发瘤上皮细胞表型,抑制上皮-间质转化(epithelial mesenchymal transitions, EMT),从而抑制了肿瘤的转移和浸润[21-23]。然而最近的一组研究表明miR200c可以促进肿瘤的转移和浸润。因此,miR200c对EMT的调控是动态的,具有双向调节EMT可塑性的功能[24-26]。与miR200c抑制原位肿瘤转移的作用机制相比,miR200c促进转移的机制研究还比较肤浅。我们前期的研究结果显示:在临床样本中,miR200c的表达在从寡灶型演进到多灶型转移的患者转移组织中与稳定寡灶型转移患者转移组织中相比要高20倍,暗示miR200c促进寡灶向多灶型转移的演进。因此,研究miR200c促多灶型转移的机制有着重要的临床意义[10]。
制约肿瘤转移的两个瓶颈因素是离开原位发生器官到达远位受累器管所需的迁移和侵袭能力,以及到达受累器官形成转移灶的克隆增殖能力。这两个因素共同决定肿瘤转移的成功率。在体外实验中,能够有效地测量和量化这两个转移的关键因素的实验分别是通过克隆斑实验估算克隆率以及通过迁移和侵袭实验共同决定肿瘤细胞的侵袭能力。因此,本研究通过比较miR200c上调之后对克隆率和迁移及侵袭能力的改变来判断miR200c是否具有促进体外转移特性的作用。
本研究结果表明:稳定上调寡灶型转移细胞株中miR200c的表达,能有效地增强体外克隆率和迁移及侵袭能力,且表现出与多灶型转移细胞株相当的体外转移特性能力。有趣的是:之前大多miR200c的研究结果表明该microRNA有抑制肿瘤侵袭和转移的功能,而这些研究大多在比较原位没有转移的肿瘤和转移灶之间miR200c的表达。miR200c抑制转移的机制是通过抑制EMT而实现。当miR200c在介导寡灶型向多灶型转移演进时,发现它在临床多灶型转移中比稳定寡灶型转移增高20倍[10],寡灶转移细胞和多灶转移细胞均为转移性肿瘤细胞,癌细胞都已经过EMT过程走向转移,只是转移程度不同。因此,本研究探讨miR200c在EMT之后促进寡灶型向多灶型转移演变的机制,提出miR200c在寡灶细胞株中表现出来的促进肿瘤细胞侵袭和迁移的能力并不与之前人们对该基因的研究相矛盾。最近的研究也表明在已具有转移能力的肿瘤细胞中,miR200c有促进转移的功能,其机制是通过抑制它的靶基因Sec23a调控分泌蛋白组功能而实现的[25]。
本研究验证了miR200c的过表达对寡灶型转移细胞体外克隆、迁移、侵袭能力的加强,这些生物学特性与多灶型转移细胞特性相近。如要更深入地研究miR200c促进肿瘤转移的机制,还需要进行小鼠活体实验。本研究为下一步采用活体验证miR200c促进肿瘤寡灶型转移向多灶型转移演变提供了体外实验依据。
| [1] | Weichselbaum R R, Hellman S. Oligometastasesrevisited[J]. Nat Rev Clin Oncol,2011, 8 (6) : 378 –382. DOI:10.1038/nrclinonc.2011.44 |
| [2] | Hellman S, Weichselbaum R R. Oligometastases[J]. J ClinOncol,1995, 13 (1) : 8 –10. |
| [3] | Staren E D, Salerno C, Rongione A, et al. Pulmonary resection for metastatic breast cancer[J]. Arch Surg,1992, 127 (11) : 1282 –1284. DOI:10.1001/archsurg.1992.01420110024006 |
| [4] | Tomlinson J S, Jarnagin W R, DeMatteo R P, et al. Actual 10-year survival after resection of colorectal liver metastases defines cure[J]. J Clin Oncol,2007, 25 (29) : 4575 –4580. DOI:10.1200/JCO.2007.11.0833 |
| [5] | Fong Y, Cohen A M, Fortner J G, et al. Liver resection for colorectal metastases[J]. J Clin Oncol,1997, 15 (3) : 938 –946. |
| [6] | Salama J K, Chmura S J, Mehta N, et al. An initial report of a radiation dose-escalation trial in patients with one to five sites of metastatic disease[J]. Clin Cancer Res,2008, 14 (16) : 5255 –5259. DOI:10.1158/1078-0432.CCR-08-0358 |
| [7] | Wong A C, Watson S P, Pitroda S P, et al. Clinical and molecular markers of long-term survival after oligometastasis-directed stereotactic body radiotherapy (SBRT)[J]. Cancer,2016, 122 (14) : 2242 –2250. DOI:10.1002/cncr.30058 |
| [8] | Suzuki H, Yoshino I. Approach for oligometastasis in non-small cell lung cancer[J]. Gen Thorac Cardiovasc Surg,2016, 64 (4) : 192 –196. DOI:10.1007/s11748-016-0630-7 |
| [9] | Hishida T, Yoshida J, Aokage K, et al. Postoperative oligo-recurrence of non-small-cell lung cancer: Clinical features and survival[J]. Eur J Cardiothorac Surg,2016, 49 (3) : 847 –853. DOI:10.1093/ejcts/ezv249 |
| [10] | Lussier Y A, Xing H R, Salama J K, et al. microRNA expression characterizes oligometastasis[J]. PLoS One,2011, 6 (12) : e28650 . DOI:10.1371/journal.pone.0028650 |
| [11] | Selzner M, Morse M A, Vredenburgh J J, et al. Liver metastases from breast cancer: long-term survival after curative resection[J]. Surgery,2000, 127 (4) : 383 –389. DOI:10.1067/msy.2000.103883 |
| [12] | Tanvetyanon T, Robinson L A, Schell M J, et al. Outcomes of adrenalectomy for isolated synchronous versus metachronous adrenal metastases in non-small-cell lung cancer: a systematic review and pooled analysis[J]. J Clin Oncol,2008, 26 (7) : 1142 –1147. DOI:10.1200/JCO.2007.14.2091 |
| [13] | Milano M T, Katz A W, Muhs A G, et al. A prospective pilot study of curative-intent stereotactic body radiation therapy in patients with 5 or fewer oligometastatic lesions[J]. Cancer,2008, 112 (3) : 650 –658. DOI:10.1002/cncr.23209 |
| [14] | Rusthoven K E, Kavanagh B D, Burri S H, et al. Multi-institutional phase Ⅰ/Ⅱ trial of stereotactic body radiation therapy for lung metastases[J]. J Clin Oncol,2009, 27 (10) : 1579 –1584. DOI:10.1200/JCO.2008.19.6386 |
| [15] | Norihisa Y, Nagata Y, Takayama K, et al. Stereotactic body radiotherapy for oligometastatic lung tumors[J]. Int J Radiat Oncol Biol Phys,2008, 72 (2) : 398 –403. DOI:10.1016/j.ijrobp.2008.01.002 |
| [16] | Hoyer M, Roed H, Traberg Hansen A, et al. Phase Ⅱ study on stereotactic body radiotherapy of colorectal metastases[J]. Acta Oncol,2006, 45 (7) : 823 –830. DOI:10.1080/02841860600904854 |
| [17] | Lussier Y A, Khodarev N N, Regan K, et al. Oligo-and polymetastatic progression in lung metastasis (es) patients is associated with specific microRNAs[J]. PLoS One,2012, 7 (12) : e50141 . DOI:10.1371/journal.pone.0050141 |
| [18] | Uppal A, Wightman S C, Mallon S, et al. 14q32-encoded microRNAs mediate an oligometastatic phenotype[J]. Oncotarget,2015, 6 (6) : 3540 –3552. DOI:10.18632/oncotarget.2920 |
| [19] | Uppal A, Ferguson M K, Posner M C. Towards a molecular basis of oligometastatic disease: potential role of micro-RNAs[J]. Clin Exp Metastasis,2014, 31 (6) : 735 –748. DOI:10.1007/s10585-014-9664-3 |
| [20] | Formosa A, Markert E K, Lena A M. MicroRNAs, miR-154, miR-299-5p, miR-376a, miR-376c, miR-377, miR-381, miR-487b, miR-485-3p, miR-495 and miR-654-3p, mapped to the 14q32.31 locus, regulate proliferation, apoptosis, migration and invasion in metastatic prostate cancer cells[J]. Oncogene,2014, 33 (44) : 5173 –5182. DOI:10.1038/onc.2013.451 |
| [21] | Bendoraite A, Knouf E C, Garg K S, et al. Regulation of miR-200 family microRNAs and ZEB transcription factors in ovarian cancer: evidence supporting a mesothelial-to-epithelial transition[J]. Gynecol Oncol,2010, 116 (1) : 117 –125. DOI:10.1016/j.ygyno.2009.08.009 |
| [22] | Korpal M, Lee E S, Hu G, et al. The miR-200 family inhibits epithelial-mesenchymal transition and cancer cell migration by direct targeting of E-cadherin transcriptional repressors ZEB1 and ZEB2[J]. J Biol Chem,2008, 283 (22) : 14910 –14914. DOI:10.1074/jbc.C800074200 |
| [23] | Gregory P A, Bert A G, Paterson E L, et al. The miR-200 family and miR-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1[J]. Nat Cell Biol,2008, 10 (5) : 593 –601. DOI:10.1038/ncb1722 |
| [24] | Elson-Schwab I, Lorentzen A, Marshall C J. MicroRNA-200 family members differentially regulate morphological plasticity and mode of melanoma cell invasion[J]. PLoS One,2010, 5 (10) : e13176 . DOI:10.1371/journal.pone.0013176 |
| [25] | Korpal M, Ell B J, Buffa F M, et al. Direct targeting of Sec23a by miR-200s influences cancer cell secretome and promotes metastatic colonization[J]. Nat Med,2011, 17 (9) : 1101 –1108. DOI:10.1038/nm.2401 |
| [26] | Bonnomet A, Brysse A, Tachsidis A, et al. Epithelial-to-mesenchymal transitions and circulating tumor cells[J]. J Mammary Gland Biol Neoplasia,2010, 15 (2) : 261 –273. DOI:10.1007/s10911-010-9174-0 |



