2. 430000 武汉,解放军75709部队卫生队
2. Medical Team of Troop 75709, Wuhan, Hubei Province, 430000, China
目前随着对前列腺癌越来越规范的诊断及治疗,国际上越来越多的临床低危局限性前列腺癌患者选择主动监测作为治疗方案,降低了过度治疗带来的风险。因此选择治疗方案前对前列腺癌的危险等级进行正确评估尤为关键[1]。术前穿刺活检标本的Gleason评分往往低于术后病理标本的Gleason评分,导致部分需手术治疗的患者行主动监测治疗,降低了患者的有效生存期。首次前列腺活检时患者的前列腺相关临床指标预测疾病危险等级的方法越来越多地得到关注。本研究回顾性分析2005年1月至2016年5月我院行前列腺癌根治手术治疗的123例低中危前列腺癌患者的临床资料,探索前列腺癌术后Gleason评分升高的预测因素。
1 资料与方法 1.1 临床资料选取2005年1月至2016年5月于我院泌尿外科经前列腺穿刺明确诊断为中低危前列腺癌,并行前列腺癌根治性手术的123例患者的临床资料。纳入标准:①确诊为低中危前列腺癌患者;②前列腺穿刺>10针;③术前影像学及骨扫描检查均无转移征象;④术前未进行新辅助治疗;⑤前列腺穿刺活检与前列腺癌根治术时间间隔<3个月。排除标准:排除活检前如留置导尿管、服用5α还原酶抑制剂等可能干扰前列腺特异抗原(prostate specific antigen,PSA)水平而又无法取得干扰前PSA数据的病例。临床低中危前列腺癌诊断标准:PSA≤20 μg/L,临床分期≤T2b期,Gleason评分≤7分。
1.2 方法所有患者应用经直肠超声检查确定前列腺的上下、左右及前后径,根据公式计算体积:前列腺体积(mL)=0.52×左右径×上下径×前后径,前列腺特异性抗原密度(prostate specific antigen density,PSAD)=血清PSA/前列腺体积。穿刺活检均为B超引导下经直肠途径完成,使用同一种型号穿刺针(FC 18 G× 250 mm,BARD)。穿刺步骤:患者侧卧位,使用0.25% 碘伏局部消毒,置入直肠探头,观察前列腺声像图,注射2%利多卡因5 mL,5 min后于超声引导下经直肠穿刺前列腺,激发活检枪完成活检,直肠内手指压迫止血5 min,随后用碘伏纱布填塞止血。患者穿刺标本和根治术标本均按2005年ISUP修订的Gleason系统分级标准进行5级10分制评分[2]。其中前列腺癌组织被分为主要分级区和次要分级区,每区的Gleason分值为1~5,Gleason评分是把主要分级区和次要分级区的Gleason分值相加,形成癌组织分级常数。手术方式分别为腹腔镜下前列腺癌根治切除术或开放式前列腺癌根治术,两种术式均完整切除前列腺和精囊。
1.3 数据收集纳入临床数据,包括患者年龄、术前血清总PSA(tPSA)、术前血清游离PSA(fPSA)、fPSA/tPSA、前列腺体积、PSAD、穿刺针数、穿刺阳性针数、穿刺阳性针数比、切缘阳性率(%)。其中术前tPSA及fPSA以术前未经直肠指诊(directeral rectun examination,DRE)及未经直肠超声(transrectal uhrasonography,TRUS)引导下前列腺系统穿刺活检时所测结果为准。穿刺阳性针数比=穿刺阳性针数/穿刺针数。
1.4 统计学方法采用SPSS 17.0统计软件,对符合正态分布的连续变量数据采用t检验,对不符合正态分布的数据采用Mann-Whitney U检验。分类变量比较采用χ2检验或Fisher精确检验。应用受试者工作特征 (receiver operating characteristic,ROC)曲线分析预测因素的诊断价值,以约登系数(敏感性+特异性-1)最大值确定临界值。以P<0.05为差异有统计学意义。
2 结果 2.1 患者临床基线资料及术后Gleason评分升高的关系分析本组123例患者年龄(67.3±6.5)岁,术前tPSA(12.5±9.1)ng/mL、术前fPSA (1.5±2.3)ng/mL、 fPSA/tPSA(0.13±0.07)、前列腺体积(41.9±21.8)mL、 PSAD(0.55±0.32)ng/(mL·g)、穿刺针数(11.6±1.3)、穿刺阳性针数(6.21±3.37)、穿刺阳性针数比 (0.52±0.24)、穿刺至手术间隔时间(34.89±20.02)d。 患者术前经直肠超声引导下前列腺穿刺活检病理分级Gleason评分与前列腺癌根治术后Gleason评分保持一致66例(53.7%),评分下降10例(8.1%),评分升高47例(38.2%)。如表 1所示:患者年龄、tPSA、fPSA/tPSA及穿刺阳性针数比均与术后发生Gleason评分升高无关(P>0.05);前列腺体积、PSAD及穿刺Gleason评分等级与术后发生Gleason评分升高有关(P<0.05,P<0.01)。
| 指标 | 术后Gleason评分降低或不变 | 术后Gleason评分升高 |
| 患者例数(%) | 76(61.8) | 47(38.2) |
| 年龄(岁) | 67.3±10.3 | 67.7±9.5 |
| tPSA(ng/mL) | 12.2±3.3 | 12.7±2.9 |
| fPSA/tPSA | 0.01±0.01 | 0.02±0.01 |
| PSAD | 0.3±0.3 | 0.4±0.2b |
| 前列腺体积(mL) | 42.9±9.3 | 21.6±10.1a |
| 阳性针数 | 6.7±0.8 | 5.8±1.1 |
| 穿刺阳性针数比 | 0.6±0.2 | 0.6±0.1 |
| 穿刺至手术时间(d) | 34.8±6.5 | 35.2±4.9 |
| 切缘阳性率[例数(%)] | ||
| 阴性 | 24(31.8) | 18(38.3) |
| 阳性 | 52(68.2) | 29(61.7) |
| 穿刺评分[例数(%)] | ||
| ≤6 | 24(33.3) | 27(57.4)b |
| =7 | 52(66.7) | 20(42.6) |
| 临床分期[例数(%)] | ||
| T1期 | 36(47.4) | 26(55.3) |
| T2期 | 40(52.6) | 21(44.7) |
| a:P<0.05,b:P<0.01,与术后Gleason评分降低或不变比较 | ||
2.2 前列腺癌术后Gleason评分升高预测因素分析
进一步分别对年龄、前列腺体积、tPSA、PSAD、临床分期、穿刺评分、切缘阳性率、穿刺阳性针数及穿刺至手术间隔时间进行Logistic回归分析,单因素回归结果显示:前列腺体积、PSAD及穿刺评分与根治术后Gleason评分升高有关;Logistic多因素回归分析结果显示仅PSAD与穿刺评分是根治术后Gleason 评分升高的独立预测因子。
| 因素 | 单因素 | 多因素 | ||||
| OR | 95%CI | P | OR | 95%CI | P | |
| PSAD | 1.76 | 1.53~2.14 | 0.005 | 1.52 | 1.23~2.04 | 0.010 |
| 前列腺体积 | 0.83 | 0.78~0.94 | 0.030 | 0.93 | 0.81~0.98 | 0.080 |
| 穿刺评分 | ||||||
| ≤6 | 2.67 | 1.68~3.77 | 0.006 | 2.01 | 1.38~2.87 | 0.030 |
| =7 | 1 | - | - | - | - | - |
2.3 PSAD预测病理Gleason评分升高
按穿刺活检病理分级Gleason评分将患者分为Gleason评分=7组与Gleason评分≤6组。Gleason评分=7的患者中PSAD与术后发生具有临床意义的Gleason评分升高明显相关,可作为临床预测的指标。根据ROC分析,其曲线下面积(area under ROC curve,AUC)为0.795,P=0.002,95%CI:0.613~0.887,PSAD>0.282 ng/(mL·g)时,根治术后发生具有临床意义的Gleason评分升高的可能性大(敏感性78.2%,特异性70.4%,图 1A)。穿刺活检病理分级Gleason评分≤6的患者中,PSAD与术后发生具有临床意义的Gleason评分升高明显有关,可作为临床预测的指标。根据ROC分析,AUC为0.748,P=0.005,95% CI: 0.618~0.857,PSAD>0.265时,根治术后发生具有临床意义的Gleason评分升高的可能性大(敏感性77.1%,特异性68.0%,图 1B)。
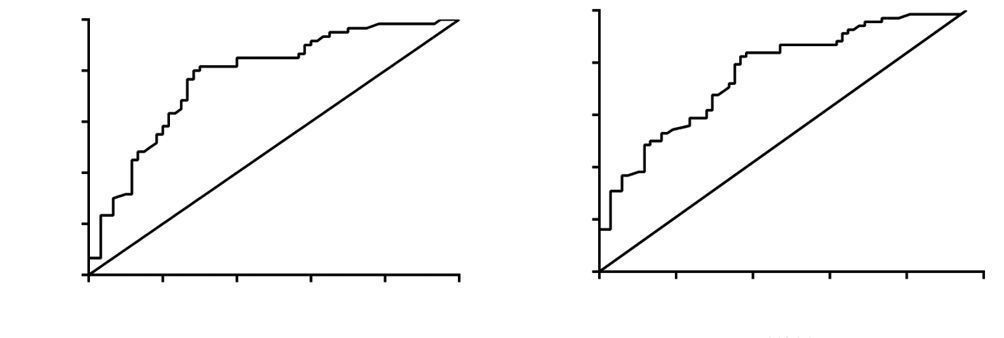
|
| A:Gleason评分=7;B:Gleason评分≤6 图 1 PSAD预测病理Gleason评分升高的ROC曲线 |
3 讨论
目前,美国前列腺癌的发生率居男性恶性肿瘤的第1位,在肿瘤相关死亡原因中排在第2位。我国目前前列腺癌的发病率虽低于欧美国家,但呈逐年上升趋势,部分沿海地区前列腺癌已是男性最常见的恶性肿瘤之一[1, 3]。
对于局限性前列腺癌患者,准确评估前列腺癌的组织分级,关系到临床精准地制定肿瘤治疗方案,如主动监测、内分泌治疗、放射治疗或采取根治性切除手术等。目前PSA检测和穿刺活检Gleason评分对于治疗的选择非常重要,尤其是Gleason评分。Gleason评分较高的患者疾病进展的风险明显增高,生化复发的危险性较高且肿瘤特异性生存率较低。针对这类患者应选择积极治疗,也同样适用于Gleason评分上升的局限性前列腺癌患者。
但是众多研究指出前列腺穿刺标本的Gleason评分与根治术后病理标本的Gleason评分具有不同程度的差异性,两者符合率在28%~58%,穿刺Gleason评分偏低者为27%~60%,偏高者为8%~32%[4-7]。针对这一问题,增加前列腺穿刺针数及其必要时采用饱和穿刺的方式,被证明可以在一定程度上提高前列腺穿刺Gleason评分的准确性[8]。虽然目前术前前列腺穿刺针数并未达成一致,但是大部分学者认为对于初次前列腺穿刺的可疑患者,标准6针穿刺已经不适用,应当为10~14针。对早前穿刺阴性仍怀疑前列腺癌的患者,如果在早前的穿刺中发现非典型小腺泡增生或存在高级别前列腺上皮内瘤变,或已经诊断为前列腺癌,应采取主动监测或考虑行重点治疗,可以采用饱和穿刺等穿刺针数更多的穿刺方案。此外,一些研究者致力于预测患者术后Gleason评分升高的可能性研究。有研究者综合前列腺癌患者术前的临床资料建立了预测术后Gleason评分升高的量表[9-11];但是Iremashvili等[12]的研究表明现有的量表对术后病理 Gleason评分升高的预测价值十分有限,无法用于临床。
患者年龄与术后发生具有临床意义的Gleason评分升高之间的关系存在争议。有研究指出患者年龄与术后Gleason评分升高具有相关性[13-14];还有研究认为患者年龄与术后Gleason评分升高无相关性[15-16]。本研究发现,对于穿刺活检病理分级Gleason评分≤7的中低危患者,年龄与术后发生Gleason评分升高无关。
同样,术前tPSA值与术后Gleason评分升高的关系争议也很大。有研究表明,术前tPSA值高的患者术后发生具有临床意义的Gleason评分升高的可能性较大[9, 15, 17];也有研究认为,术前tPSA值与患者术后Gleason评分升高没有相关性[18]。本研究中,术前tPSA值与患者术后Gleason评分升高无关。这可能与本组患者术前血清tPSA值较低有关。
文献[19-20]指出较小的前列腺体积是术后Gleason评分升高的重要因素。Turley等[19]指出,在前列腺体积的下四分位数(36 mL)的患者与上四分位数(58 mL)的患者比较,前者Gleason评分术后升高的发生率比后者增加50%。但是,也有研究指出前列腺穿刺Gleason评分的准确性与前列腺体积无相关性(P>0.05)[18-22]。本研究中,术后Gleason评分升高组与评分降低或不变组比较发现前列腺体积差异具有统计学意义,进一步单因素Logistic回归分析结果显示前列腺体积是术后Gleason评分升高的危险因素,但多因素Logistic回归分析结果未显示前列腺体积是术后Gleason评 分升高的独立危险因素。这与Mir等[21]的研究结果类似。
PSAD在前列腺癌患者的诊断中具有重要作用。针对PSA值位于4~10 ng/mL的“灰区”范围的患者,《2014版前列腺癌诊断治疗指南》指出PSAD≥0.16 ng/(mL·g) 是前列腺指诊阴性及前列腺影像学检查无阳性表现的患者行超声引导下经直肠穿刺活检的指征。本研究中,PSAD和穿刺活检病理分级Gleason评分≤7的患者发生术后具有临床意义的Gleason评分升高有关,根据ROC分析并计算约登指数,TRUS前列腺穿刺活检病理分级Gleason评分=7的患者中,PSAD>0.282 ng/(mL·g)时,根治术后发生具有临床意义的Gleason评分升高的可能性大(敏感性78.2%,特异性70.4%);而Gleason评分≤6的患者中,PSAD>0.265 ng/(mL·g)时,根治术后发生具有临床意义的Gleason评分升高的可能性大(敏感性77.1%,特异性68.0%)。
本研究证实PSAD与穿刺评分等级是根治术后Gleason评分升高的独立预测因子,PSAD与前列腺癌患者术后发生Gleason评分升高密切相关。根据不同穿刺评分等级参考PSAD值,有助于预测术后Gleason评分升高的风险。
| [1] | 陈超, 谢立平, 郑祥毅, 等. 前列腺特异性抗原密度预测首次前列腺活检标本 Gleason 评分升高的价值[J]. 中华泌尿外科杂志,2013, 34 (10) : 755 –759. DOI:10.3760/cma.j.issn.1000-6702.2013.10.010 |
| [2] | Epstein J I, Allsbrook W C, Amin M B, et al. The 2005 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma[J]. The American Journal of Surgical Pathology,2005, 29 (9) : 1228 –1242. DOI:10.1097/01.pas.0000173646.99337.b1 |
| [3] | 李小攀, 杨琛, 孙乔, 等. 2002-2013 年上海市浦东新区居民前列腺癌发病死亡趋势分析[J]. 中华肿瘤防治杂志,2015, 22 (6) : 412 –415. DOI:10.16073/j.cnki.cjcpt.2015.06.002 |
| [4] | Noguchi M, Stamey T A, Mcneal J E, et al. Relationship between systematic biopsies and histological features of 222 radical prostatectomy specimens: lack of prediction of tumor significance for men with nonpalpable prostate cancer[J]. J Urol,2001, 166 (1) : 104 –110. DOI:10.1016/S0022-5347(05)66086-7 |
| [5] | King C R, Mcneal J E, Gill H, et al. Extended prostate biopsy scheme improves reliability of Gleason grading: implications for radiotherapy patients[J]. Int J Radiat Oncol Biol Phys,2004, 59 (2) : 386 –391. DOI:10.1016/j.ijrobp.2003.10.014 |
| [6] | 任玉嫄, 王功伟, 胡浩, 等. 临床病理学实践中前列腺癌 Gleason 评分变化趋势[J]. 现代肿瘤医学,2015, 23 (8) : 1051 –1053. DOI:10.3969/j.issn.1672-4992.2015.08.06 |
| [7] | Cohen M S, Hanley R S, Kurteva T, et al. Comparing the Gleason prostate biopsy and Gleason prostatectomy grading system: the Lahey Clinic Medical Center experience and an international meta-analysis[J]. Eur Urol,2008, 54 (2) : 371 –381. DOI:10.1016/j.eururo.2008.03.049 |
| [8] | Chun F K, Briganti A, Shariat S F, et al. Significant upgrading affects a third of men diagnosed with prostate cancer: predictive nomogram and internal validation[J]. BJU Int,2006, 98 (2) : 329 –334. DOI:10.1111/j.1464-410X.2006.06262.x |
| [9] | Kulkarni G S, Lockwood G, Evans A, et al. Clinical predictors of Gleason score upgrading: implications for patients considering watchful waiting, active surveillance, or brachytherapy[J]. Cancer,2007, 109 (12) : 2432 –2438. DOI:10.1002/cncr.22712 |
| [10] | Moussa A S, Kattan M W, Berglund R, et al. A nomogram for predicting upgrading in patients with low- and intermediate-grade prostate cancer in the era of extended prostate sampling[J]. BJU Int,2010, 105 (3) : 352 –358. DOI:10.1111/j.1464-410X.2009.08778.x |
| [11] | Tilki D, Schlenker B, John M, et al. Clinical and pathologic predictors of Gleason sum upgrading in patients after radical prostatectomy: results from a single institution series[J]. Urol Oncol,2011, 29 (5) : 508 –514. DOI:10.1016/j.urolonc.2009.07.003 |
| [12] | Iremashvili V, Manoharan M, Pelaez L, et al. Clinically significant Gleason sum upgrade: external validation and head-to-head comparison of the existing nomograms[J]. Cancer,2012, 118 (2) : 378 –385. DOI:10.1002/cncr.26306 |
| [13] | Epstein J I, Feng Z, Trock B J, et al. Upgrading and downgrading of prostate cancer from biopsy to radical prostatectomy: incidence and predictive factors using the modified Gleason grading system and factoring in tertiary grades[J]. Eur Urol,2012, 61 (5) : 1019 –1024. DOI:10.1016/j.eururo.2012.01.050 |
| [14] | 孙娟娟, 王朝夫, 张慧芝, 等. 前列腺癌穿刺标本与对应根治标本Gleason评分符合率的研究[J]. 中国癌症杂志,2012, 22 (12) : 929 –933. DOI:10.3969/j.issn.1007-3969.2012.12.010 |
| [15] | 王祺, 李彦锋, 江军, 等. 血清前列腺特异性抗原对前列腺癌患者Gleason评分的预测价值[J]. 第三军医大学学报,2016, 38 (9) : 1021 –1025. DOI:10.16016/j.1000-5404.201511075 |
| [16] | Davies J D, Aghazadeh M A, Phillips S, et al. Prostate size as a predictor of Gleason score upgrading in patients with low risk prostate cancer[J]. J Urol,2011, 186 (6) : 2221 –2227. DOI:10.1016/j.juro.2011.07.104 |
| [17] | Bright E, Manuel C, Goddard J C, et al. Incidence and Variables Predicting Gleason Score Up-Grading between Trans-Rectal Ultrasound-Guided Prostate Biopsies and Radical Prostatectomy[J]. Urologia Internationalis,2010, 84 (2) : 180 –184. DOI:10.1159/000277595 |
| [18] | Davies J D, Aghazadeh M A, Phillips S, et al. Prostate size as a predictor of Gleason score upgrading in patients with low risk prostate cancer[J]. J Urol,2011, 186 (6) : 2221 –2227. DOI:10.1016/j.juro.2011.07.104 |
| [19] | Turley R S, Hamilton R J, Terris M K, et al. Small transrectal ultrasound volume predicts clinically significant Gleason score upgrading after radical prostatectomy: results from the SEARCH database[J]. J Urol,2008, 179 (2) : 523 –527. DOI:10.1016/j.juro.2007.09.078 |
| [20] | Corcoran N M, Hovens C M, Hong M K, et al. Underestimation of Gleason score at prostate biopsy reflects sampling error in lower volume tumours[J]. BJU Int,2012, 109 (5) : 660 –664. DOI:10.1111/j.1464-410X.2011.10543.x |
| [21] | Mir M C, Planas J, Raventos C X, et al. Is there a relationship between prostate volume and Gleason score?[J]. BJU international,2008, 102 (5) : 563 –565. DOI:10.1111/j.1464-410X.2008.07696.x |
| [22] | Shapiro R H, Johnstone P A. Risk of Gleason grade inaccuracies in prostate cancer patients eligible for active surveillance[J]. Urology,2012, 80 (3) : 661 –666. DOI:10.1016/j.urology.2012.06.022 |





