2. 400016 重庆, 重庆医科大学基础医学院放射医学与肿瘤教研室 ;
3. 563000 贵州 遵义, 遵义医学院附属医院肿瘤科 ;
4. 563000 贵州 遵义, 遵义医学院第三附属医院肿瘤科
2. Department of Radiation Oncology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing 400016 ;
3. Department of Oncology, Affiliated Hospital of Zunyi Medical College, Zunyi, 563000, Guizhou Province ;
4. Department of Oncology, Third Affiliated Hospital of Zunyi Medical College, Zunyi, 563000, Guizhou Province, China
鼻咽癌是一类起源于鼻咽黏膜上皮的恶性肿瘤,放射治疗为其主要的治疗手段 [1]。98%的鼻咽癌属低分化鳞癌,对射线中度敏感;但肿瘤干细胞(cancer stem cells,CSCs)理论认为,鼻咽癌干细胞(nasopharyngeal cancer stem cells,NPCSCs)对放疗具有抵抗性,是导致鼻咽癌原位复发和远处转移的根源 [2-4]。CSCs对放疗抵抗的原因很多,包括在乏氧环境中高度激活的缺氧诱导因子(hypoxia-inducible factor-1,HIF-1)和核转录因子(nuclear factor-kappa B,NF-κB)等 [5-6]。 2-甲氧基雌二醇(2-methoxyestradiol,2-MeOE2)为雌二醇在体内的生理代谢产物,研究发现2-MeOE2能抑制多种肿瘤(包括头颈部肿瘤)的生长及血管形成,并且增加紫杉醇的抗癌效应 [7-11]。2-MeOE2也能抑制前列腺癌 [12]、髓母细胞瘤 [13]及白血病K562细胞 [14]的增殖与凋亡。2-MeOE2作为一种新型的抗癌及放化疗增敏药物被研究 [15],但2-MeOE2对NPCSC的影响尚不清楚。目前,获得CSCs的方法主要有侧群分选、免疫磁珠分选、自体荧光检测等,其中含生长因子的无血清培养基悬浮富集CSCs是一种快速有效获得CSCs的方法,被广泛用于干细胞研究中 [16-17]。本课题组前期利用此方法已成功富集鼻咽癌CNE-2干细胞,并通过体内及体外一系列实验鉴定其干性 [18-19]。本研究在此基础之上,探讨目前热点研究的抗癌药物2-MeOE2对NPCSCs增殖、迁移及放疗敏感性的影响及机制,为彻底根除CSCs进而提高鼻咽癌局部控制率提供实验基础和依据。
1 材料与方法 1.1 主要试剂及仪器青霉素、链霉素、RMPI 1640培养液、DMEM/F12培养液、胎牛血清(fetal bovine serum,FBS)、表皮生长因子(epidermal growth factor,EGF)、成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和细胞消化液Accutase均为美国Gibco公司产品,B27(美国Invitrogen); 2-MeOE2(selleckchem,上海蓝木化工有限公司);CCK-8细胞增殖-毒性检测试剂盒(日本Dojindo公司),Transwell小室(8 μm)(北京明阳科华生物科技有限公司);细胞裂解液和苯甲基磺酰氟(碧云天生物技术研究所);鼠抗人NF-κB p65单抗(美国Cell Signaling公司),鼠抗人HIF-1α和GAPDH单抗(武汉博士德生物工程有限公司);羊抗小鼠IgG-HR(武汉博士德生物工程有限公司);BCA蛋白浓度测定试剂盒、ECL试剂盒、SDS-PAGE凝胶配制试剂盒(碧云天生物技术研究所)。倒置光学显微镜(日本Nikon公司)、正置荧光显微镜(日本Olympus公司),凝胶成像系统(美国Bio-Rad公司),放疗用直线加速器Varian 21EX(美国Varian公司)。
1.2 细胞培养及传代无血清培养基悬浮培养鼻咽癌CNE-2干细胞(NPCSCs):DMEM/F12培养液中加入青霉素(100 U/mL)、链霉素(100 μg/mL)、EGF、bFGF和2% B27,放于37 ℃、CO2体积分数为5%的细胞培养箱中培养。5~7 d传代,传代时先离心收集微球体,再用上述干细胞培养液重悬细胞,然后转入新培养瓶中,继续置于上述细胞培养箱培养。
1.3 2-MeOE2处理细胞及分组根据说明书将购买的2-MeOE2粉末溶解于DMSO中,按1 mg加入3.306 8 mL DMSO配制获得浓度为 1 mmol/L的储备液。实验时收集NPCSC离散为单细胞悬液,倍比稀释为106/mL,以每孔992 μL种植于 6孔板。实验分为3组:①对照组,以培养液中仅加入 8 μL 溶剂DMSO设为对照组;②低浓度组:每孔加入储备液4 μL、DMSO 4 μL 配制为2-MeOE2(4 μmol/L)浓度组;③高浓度组:每孔加入储备液8 μL 配制为 2-MeOE2(8 μmol/L)浓度组。加药后将6孔板置于细胞培养箱培养24 h取出,进行后续实验。
1.4 CCK-8细胞增殖实验收集各组细胞倒入离心管静置5 min,吸弃上层液体,保留下层细胞浑浊液,离心、消化制备成单细胞悬液,计数,倍比稀释为1×104mL,以每孔200 μL加入96孔板,每组设8个复孔,每孔加入20 μL CCK-8,于细胞培养箱孵育3 h后酶标仪检测波长630 nm处各孔光密度值[D(630)]。以0 μmol/L处理为对照组,其他组D(630)值与对照组D(630)值的比值反映相对增殖活力,实验重复3次。
1.5 Transwell小室迁移实验收集各组细胞倒入离心管静置5 min,吸弃上层液体,保留下层细胞浑浊液,离心、消化制备成单细胞悬液。用不含血清的RMPI 1640培养液重悬、计数细胞,梯度倍比稀释为2×105个/mL,100 μL/孔加入至24孔板中的Transwell小室上室,于下室加入500 μL含10% FBS的RMPI 1640培养液,置于37 ℃、CO2体积分为5%的细胞培养箱中进行培养。24 h后取出小室,用棉签轻轻擦去上室中的细胞,4%多聚甲醛溶液室温固定30 min,于下室加入2 mL结晶紫溶液染色后用PBS润洗,于光学显微镜下随机选取5个视野( 200×)照相,并计数穿过膜孔的下室细胞数目,进行统计分析。实验重复3次。
1.6 克隆形成实验收集各组细胞倒入离心管静置5 min,吸弃上层液体,保留下层细胞浑浊液,离心、消化制备成单细胞悬液,以每孔200、400、800、1 600细胞接种于24孔板,为排除悬浮细胞再分化对X射线效应的影响,接种后立即将不同细胞孔分别采用0、2、4、8 Gy X射线照射,X射线能量6 MV,源皮距100 cm,剂量率为300 U/min。照射后置于细胞培养箱培养,14 d后取出用PBS洗涤,99.5%甲醇固定10 min,结晶紫染色20 min ,显微镜观察计数大于50个细胞克隆的集落数。以0 Gy组计算克隆形成率(plating efficiency,PE),PE=克隆数/接种细胞数×100 % ;细胞存活分数(survival fraction,SF)=照射后细胞形成的克隆数/(接种细胞数×PE)。采用多靶单击模型由GraphPad Prism 5.0拟合生存曲线并计算出相关放射学参数,方程为SF=1-(1-eD/D0)N,平均致死剂量(D0),存活曲线肩区(Dq),外推数N,2 Gy细胞存活分数SF2,放射增敏比(sensitivity enhancement ratio,SER)=D0(对照组)/D0(实验组),Dq=D0logN。实验重复3次。
1.7 蛋白质印记法检测干细胞NF-κB p65、HIF-1α蛋白的表达收集各组细胞,离心后弃上清,蛋白提取、浓度测定及Western blot检测参考文献[18]的方法进行,其中抗体稀释倍数为:GAPDH 、HIF-1α均为1∶200,NF-κB p65 1∶1 000稀释,二抗山羊抗鼠IgG 为1∶4 000稀释,凝胶成像系统采集图像,分析。
1.8 统计学方法采用SPSS 16.0统计软件。计量资料以x±s 表示,两组间比较采用t检验;3组比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。相关性分析用pearson 相关分析双侧检验。
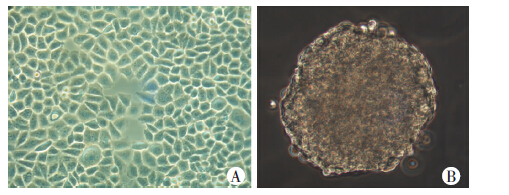
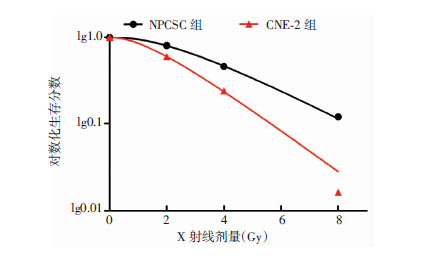
2 结果 2.1 与亲本CNE-2细胞相比,NPCSCs高表达HIF-1α和NF-κB p65蛋白,放疗敏感性降低倒置显微镜观察可见CNE-2细胞贴壁生长,呈多边形(图 1A),NPCSCs紧密结合呈微球体状悬浮生长在含生长因子的无血清培养基中(图 1B)。Western blot结果显示,NPCSCs细胞HIF-1α和NF-κB p65蛋白表达均明显高于CNE-2细胞(P<0.01,图 2)。克隆形成实验检测细胞放疗敏感性,经多靶单击模型拟合生存曲线(图 3),可见NPCSCs的各放射学参数D0、Dq、N、SF2均高于CNE-2细胞。CNE-2细胞SER为1.32,放疗敏感性明显强于NPCSCs(表 1)。
|
| A: CNE-2细胞;B:NPCSC细胞 图 1 倒置显微镜观察CNE-2、NPCSC细胞形态 (×200) |

|
| 1: NPCSC细胞;2:CNE-2细胞 图 2 Western blot 检测两组细胞NF-κB p65 和 HIF-1α蛋白表达 |
|
| 图 3 多靶单击模型拟合两组细胞生存曲线 |
| 细胞 | D0 | Dq | N | SF2 | SER |
| NPCSCs | 2.574 | 1.09 | 2.654 | 0.809 | |
| CNE-2 | 1.950 | 0.65 | 2.244 | 0.629 | 1.32 |
2.2 2-MeOE2处理能降低NPCSCs的增殖、迁移并增强其放疗敏感性
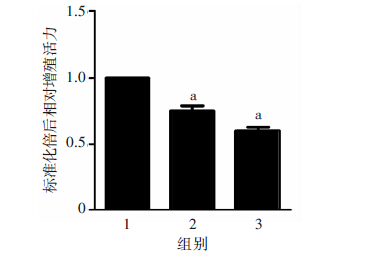
2-MeOE2处理NPCSCs 24 h后,倒置显微镜下可以看到,随浓度增高,致密球状生长的干细胞逐渐变得离散(图 4)。CCK-8法检测细胞增殖活力可见:随2-MeOE2浓度增高,NPCSCs增殖活力逐渐下降,呈浓度依赖方式(P<0.01,图 5)。Transwell迁移实验(图 6)结果显示,0、4、8 μmol/L 2-MeOE2处理组穿过小室膜孔的细胞数分别为(185±20)、(96±14)、(37±10),4、 8 μmol/L 2-MeOE2处理组显著低于0 μmol/L 2-MeOE2 组(P<0.01)。用克隆形成实验检测NPCSCs的放疗敏感性,可见随2-MeOE2浓度增高,不同X射线剂量辐射后NPCSCs的克隆形成率明显降低;经GraphPad Prism 5软件,按多靶单击模型拟合生存曲线(图 7)可见,经不同剂量照射后,随2-MeOE2浓度增高,细胞放射学参数D0、Dq、N、SF2均降低,以 0 μmol/L 2-MeOE2组为对照,4 μmol/L 2-MeOE2组SER为1.19,8 μmol/L 2-MeOE2组SER为1.39(表 2)。

|
| A:0 μmol/L 2-MeOE2组;B:4 μmol/L 2-MeOE2组; C: 8 μmol/L 2-MeOE2组 图 4 倒置显微镜观察药物处理后细胞形态 (×200) |
|
| 1:0 μmol/L 2-MeOE2组;2:4 μmol/L 2-MeOE2组; 3:8 μmol/L 2-MeOE2组; a: P<0.01,与0 μmol/L组比较 图 5 CCK-8检测药物作用后细胞增殖能力变化 |

|
| A:0 μmol/L 2-MeOE2组;B:4 μmol/L 2-MeOE2组;C:8 μmol/L 2-MeOE2组 图 6 Transwell检测药物作用后细胞迁移能力的变化 (结晶紫×200) |

|
| 图 7 多靶单击模型拟合2-MeOE2处理后干细胞生存曲线 |
| 2-MeOE2浓度 | D0 | Dq | N | SF2 | SER |
| 0 μmol/L | 2.600 | 1.048 | 2.53 | 0.80 | |
| 4 μmol/L | 2.160 | 0.669 | 2.04 | 0.64 | 1.194 |
| 8 μmol/L | 1.856 | 0.55 | 1.98 | 0.56 | 1.394 |
2.3 2-MeOE2处理能降低CNE-2干细胞HIF-1α和NF-κB p65的蛋白表达
Western blot检测结果显示,随着2-MeOE2浓度增加,HIF-1α蛋白表达明显降低,NF-κB p65 表达也随之降低,均具有浓度依赖性(图 8)。相关性分析发现,2-MeOE2浓度与HIF-1α和NF-κB p65蛋白表达pearson相关系数r分别为-0.968和-0.983,呈显著负相关(P均<0.01)。经回归分析可得回归方程为:浓度=9.249-0.119×(NF-κB p65蛋白灰度值)-0.039×(HIF-1α蛋白灰度值),R=0.984,回归方程有统计学意义(P<0.01)。用2-MeOE2(终浓度为 4 μmol/L)处理干细胞后,分别0、24、48 h提取蛋白,Western blot发现随时间延长,NPCSCs细胞NF-κB p65、HIF-1α蛋白表达均明显降低(P<0.01,表 3)。HIF-1α和NF-κB p65蛋白表达之间也呈明显的正相关(r=0.999,P=0.032)。

|
| 1: 0 μmol/L 2-MeOE2组; 2: 4 μmol/L 2-MeOE2组; 3: 8 μmol/L 2-MeOE2组 图 8 Western blot检测不同浓度2-MeOE2处理NPCSCs 24 h后HIF-1α、NF-κB p65蛋白的表达 |
| 2-MeOE2处理后时间 | NF-κB p65 | HIF-1α |
| 0 h | 56.54±5.98 | 61.39±6.86 |
| 24 h | 35.41±4.06a | 28.11±3.97a |
| 48 h | 8.04±1.46a | 10.51±2.11a |
| a: P<0.01,与0 h比较 | ||
3 讨论
本课题组前期已富集NPCSCs,经鉴定已明确其比亲本CNE-2细胞具有较高的自我更新、迁移能力,高表达CD133、CD44以及干性相关基因 [18-19]。本研究用Western blot以及克隆形成实验检测NPCSC和亲本CNE-2细胞的HIF-1α和NF-κB p65蛋白表达以及放疗敏感性,可见相对于亲本CNE-2细胞,NPCSCs具有更高的HIF-1α和NF-κB p65蛋白表达和较低的放疗敏感性。
2-MeOE2是雌二醇在体内的代谢产物,目前正作为一种抗癌药物被研究 [15]。最近研究发现它具有调节细胞周期阻滞及凋亡 [20],抗有丝分裂 [15],调节转录因子(包括HIF-1α [7]和NF-κB [12])活性等,对多种肿瘤的发生和进展有重要作用 [7-13],但2-MeOE2对NPCSCs的作用尚不清楚。本实验显示随着2-MeOE2浓度增高,NPCSCs的生长受抑制,细胞增殖活力及迁移能力降低,放疗敏感性增高,说明2-MeOE2能抑制干细胞增殖、迁移并增加NPCSCs的放疗敏感性。
乏氧微环境作为影响肿瘤放疗敏感性的重要因素,普遍存在于实体肿瘤中 [22]。乏氧环境下HIF-1高表达,HIF-1α为HIF-1的氧功能调节亚基 [23]。HIF-1α主要是在缺氧条件下促进靶基因转录从而使细胞发生一系列的缺氧反应,参与肿瘤血管的生成、细胞凋亡、炎症及肿瘤治疗抵抗等 [24-26]。研究表明,2-MeOE2能使微管解聚,并抑制HIF-1α核积累以及HIF-1转录活性 [7]。目前在小鼠急性肺损伤、高血压及骨骼肌、肿瘤等研究中证实2-MeOE2能抑制HIF-1α的表达 [8-11]。所以我们提出假设,2-MeOE2能调节HIF-1α的表达,进而影响NPCSCs的增殖、迁移及放疗敏感性等重要生物特性。采用Western blot 检测不同浓度以及不同时间2-MeOE2处理后各组细胞HIF-1α的表达,结合SPSS统计分析2-MeOE2与HIF-1α 蛋白表达的量效关系及时效关系,结果显示HIF-1α 蛋白表达随2-MeOE2浓度增高而降低,并且随2-MeOE2作用时间延长而降低,具有明显的浓度、时间依赖性。因此,我们推测2-MeOE2抑制HIF-1α的表达很可能是 2-MeOE2抑制NPCSC增殖、迁移及增加其放疗敏感性的重要机制。
NF-κB 是一类核转录因子,在肿瘤(包括鼻咽癌)的发生发展中起着至关重要的作用 [27],p65是NF-κB的关键功能活性亚基 [28]。研究表明,2-MeOE2能调节NF-κB p65的表达及活性影响多种肿瘤的生长与凋亡 [12]。然而NF-κB 在2-MeOE2抑制肿瘤生长中的角色是复杂的,而且不同NF-κB 活性的肿瘤细胞中 2-MeOE2 产生的效应不同。例如,在前列腺LNCaP细胞中,2-MeOE2能增加NF-κB 活性,但在PC3细胞中2-MeOE2能降低NF-κB 活性。并且2-MeOE2增加NF-κB 活性是诱导还是拮抗细胞凋亡取决于细胞的病理类型。同时本课题组先前的研究发现NF-κB能调节细胞EMT进而介导NPCSC对化疗的抵抗 [18]。我们推测:NF-κB在2-MeOE2抑制NPCSC增殖、迁移及放疗抵抗中有重要作用。为进一步探讨2-MeOE2对NPCSC作用的机制,采用Western blot检测了2-MeOE2不同浓度和时间作用后干细胞NF-κB p65蛋白的改变。结合SPSS分析发现NF-κB p65蛋白表达对 2-MeOE2 具有明显的浓度、时间依赖性,表明2-MeOE2能有效抑制鼻咽癌CNE-2干细胞NF-κB p65表达,并且很可能与2-MeOE2抑制NPCSC增殖、迁移及增加其放疗敏感性有关。
本研究显示,随着2-MeOE2浓度增高,NF-κB p65与HIF-1α蛋白的降低有相关趋势。有研究表明,HIF-1α可通过NF-κB独立或依赖途径影响癌细胞的增殖与凋亡 [29],我们推测2-MeOE2对NPCSC的抗癌效应机制可能为2-MeOE2抑制了HIF-1α/NF-κB 信号通路。但也有研究表明,NF-κB能在基因水平调节HIF-1α转录 [30-31]。所以在NPCSC中,NF-κB与 HIF-1α 之间的调控关系还有待进一步研究。为进一步明确NF-κB与HIF-1α在2-MeOE2抑制NPCSC增殖、迁移及放疗抵抗中的作用,本课题组将采用基因干扰技术分别下调NF-κB与HIF-1αRNA,以明确NF-κB和HIF-1α之间的调控关系以及二者在2-MeOE2抗癌效应中的作用,为2-MeOE2抗肿瘤的临床应用提供实验依据。
综上所述,2-MeOE2能抑制NPCSC增殖、迁移并增加其放疗敏感性,其机制可能为2-MeOE2抑制HIF-1α和NF-κB蛋白表达。2-MeOE2有望成为一种新型的肿瘤治疗药物或放疗增敏剂,但需要更多的研究与 论证。
| [1] | 王志海, 曾泉, 陈弢, 等. 抑制NFBD1基因的表达对鼻咽癌CNE-1细胞放射敏感性的影响[J]. 肿瘤,2014, 34 (2) : 101 –107. DOI:10.3781/j.issn.1000-7431 |
| [2] | Long H, Xie R, Xiang T, et al. Autocrine CCL5 signaling promotes invasion and migration of CD133+ ovarian cancer stem-like cells via NF-κB-mediated MMP-9 upregulation[J]. Stem Cells,2012, 30 (10) : 2309 –2319. DOI:10.1002/stem.1194 |
| [3] | Yu S, Zhang R, Liu F, et al. Notch inhibition suppresses nasopharyngeal carcinoma by depleting cancer stem-like side population cells[J]. Oncology Reports,2012, 28 (2) : 561 –566. DOI:10.3892/or.2012.1830 |
| [4] | Guo D, Xu B L, Zhang X H, et al. Cancer stem-like side population cells in the human nasopharyngeal carcinoma cell line cne-2 possess epithelial mesenchymal transition properties in association with metastasis[J]. Oncology Reports,2012, 28 (1) : 241 –247. DOI:10.3892/or.2012.1781 |
| [5] | Oliveira L R, Oliveira-Costa J P, Soave D F, et al. P177. Cancer stem cell immunophenotypes in oral squamous cell carcinoma[J]. Oral Pathol Med,2011, 40 (2) : 135 –142. DOI:10.1111/j.1600-0714.2010.00967 |
| [6] | Annunziata C M, Stavnes H T, Kleinberg L, et al. Nuclear Factor kappa B Transcription Factors Are Coexpressed and Convey a Poor Outcome in Ovarian Cancer[J]. Cancer,2010, 116 (13) : 3276 –3284. DOI:10.1002/cncr.25190 |
| [7] | Masi C M, Hawkley L C, Cacioppo J T. Serum -methoxyestradiol, an estrogen metabolite, is positively associated with serum HDL-C in a population-based sample[J]. Lipids,2012, 47 (1) : 35 –38. DOI:10.1002/cncr.25190 |
| [8] | Qi B, Chen H L, Shang D, et al. Effects of hypoxia-inducible factor-1αand matrix metalloproteinase-9 on alveolar-capillary barrier disruption and lung edema in rat models of severe acute pancreatitis-associated lung injury[J]. Experimental & Therapeutic Med,2014, 8 (3) : 899 –906. DOI:10.3892/etm.2014.1810 |
| [9] | Xie H C, He J P, Zhu J F, et al. Expression of HIF-1alpha and VEGF in skeletal muscle of plateau animals in response to hypoxic stress[J]. Physiological Res,2014, 63 (6) : 801 –805. |
| [10] | Pan H, Chen S, Yuan W, et al. Down-regulated CBS/H2S pathway is involved in high-salt-induced hypertension in Dahl rats[J]. Nitric Oxide Biology & Chemistry,2015, 46 : 192 –203. DOI:10.1016/j.niox.2015.01.004 |
| [11] | Ricker J L, Chen Z, Yang X P, et al. 2-Methoxyestradiol inhibits hypoxia-inducible factor 1α, tumor growth, and angiogenesis and augments paclitaxel efficacy in head and neck squamous cell carcinoma[J]. Clin Cancer Res,2004, 10 (24) : 8665 –8673. DOI:10.1158/1078-0432.CCR-04-1393 |
| [12] | Parrondo R, Pozas D L A, Reiner T, et al. NF-κB activation enhances cell death by antimitotic drugs in human prostate cancer cells[J]. Molecular Cancer,2010, 9 (2) : 1 –13. DOI:10.1186/1476-4598-9-182 |
| [13] | Kumar A P, Garcia G E, Orsborn J, et al. 2-Methoxyestradiol interferes with NFκB transcriptional activity in primitive neuroectodermal brain tumors: implications for management[J]. Carcinogenesis,2003, 24 (2) : 209 –216. DOI:10.1093/carcin/24.2.209 |
| [14] | Zhang X Y, Zhan R, Huang H B, et al. Mechanism underlying 2-methoxyestradiol inducing apoptosis of K562 cells[J]. Zhongguo shi yan xue ye xue za zhi,2009, 17 (2) : 340 –344. |
| [15] | Sutherland T E, Anderson R L, Hughes R A, et al. 2-Methoxyestradiol—a unique blend of activities generating a new class of anti-tumour/anti-inflammatory agents[J]. Drug Discov Today,2007, 12 : 577 –584. DOI:10.1016/j.drudis.2007.05.005 |
| [16] | Zhao C, Setrerrahmane S, Xu H. Enrichment and characterization of cancer stem cells from a human non-small cell lung cancer cell line[J]. Oncology Reports,2015 . DOI:10.3892/or.2015.4163 |
| [17] | Miranda-Lorenzo I, Dorado J, Lonardo E, et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells[J]. Nature Methods,2014, 11 (11) : 1161 –1169. DOI:10.1038/nmeth.3112 |
| [18] | Li Y J, Wu S L, Lu S M, et al. (-)-Epigallocatechin-3-gallate inhibits nasopharyngeal cancer stem cell self-renewal and migration and reverses the epithelial-mesenchymal transition via NF-κB p65 inactivation[J]. Tumor Biology,2015, 36 (4) : 2747 –2761. DOI:10.1007/s13277-014-2899-4 |
| [19] | 李亚军, 郭颖, 吴顺龙, 等. 人鼻咽癌干细胞微球体培养并鉴定其生物特性[J]. 医学研究生学报,2014, 27 (11) : 1133 –1138. DOI:10.3969/j.issn.1008-8199.2014.11.004 |
| [20] | Reumann S, Shogren K L, Yaszemski M J, et al. Inhibition of Autophagy Increases 2-Methoxyestradiol-Induced Cytotoxicity in SW1353 Chondrosarcoma Cells[J]. J Cell Biochem,2016, 117 (3) : 751 –759. DOI:10.1002/jcb.25360 |
| [21] | Shigdar S, Qiao L, Zhou S F, et al. RNA aptamers targeting cancer stem cell marker CD133[J]. Cancer letters,2013, 330 (1) : 84 –95. DOI:10.1016/j.canlet.2012.11.032 |
| [22] | Zhang X, de Milito A, Olofsson M H, et al. Targeting Mitochondrial Function to Treat Quiescent Tumor Cells in Solid Tumors[J]. Mol Sci,2015, 16 (11) : 27313 –27326. DOI:10.3390/ijms161126020 |
| [23] | Yang P, Reece E A. 45: Role of HIF-1alpha in maternal hyperglycemia-induced embryonic vasculopathy[J]. American Journal of Obstetrics & Gynecology,2011, 204 (1) : S27 . DOI:10.1016/j.ajog.2011.01.012 |
| [24] | Tang N, Wang L, Esko J, et al. Loss of HIF-1αin endothelial cells disrupts a hypoxia-driven VEGF autocrine loop necessary for tumorigenesis[J]. Cancer Cell,2004, 6 (5) : 485 –495. DOI:10.1016/j.ccr.2004.09.026 |
| [25] | Li H, Chen J, Zen W, et al. Effect of hypoxia inducible factor-1 antisense oligonucleotide on liver cancer[J]. Int Clin Exp Med,2015, 8 (8) : 12650 –12655. |
| [26] | Zhang H, Qian D Z, Tan Y S, et al. Digoxin and other cardiac glycosides inhibit HIF-1αsynthesis and block tumor growth[J]. Proceedings of the National Academy of Sciences,2008, 105 (50) : 19579 –19586. DOI:10.1073/pnas.0809763105 |
| [27] | Didonato J A, Frank M, Michael K. NF-κB and the link between inflammation and cancer[J]. Immunological Reviews,2012, 246 (1) : 379 –400. DOI:10.1111/j.1600-065X.2012.01099.x |
| [28] | Luqman S, Pezzuto J M. NF-κB: a promising target for natural products in cancer chemoprevention[J]. Phytotherapy Res,2010, 24 (7) : 949 –963. DOI:10.1002/ptr.3171 |
| [29] | Chen C, Yu Z. siRNA targeting HIF-1alpha induces apoptosis of pancreatic cancer cells through NF-kappaB-independent and-dependent pathways under hypoxic conditions[J]. Anticancer Res,2009, 29 (4) : 1367 –1372. |
| [30] | Rius J, Guma M, Schachtrup C, et al. NF-κB links innate immunity to the hypoxic response through transcriptional regulation of HIF-1α[J]. Nature,2008, 453 : 807 –811. DOI:10.1038/nature06905 |
| [31] | Belaiba R S, Bonello S, Zhringer C, et al. Hypoxia up-regulates hypoxia-inducible factor-1αtranscription by involving phosphatidylinositol 3-kinase and nuclear factorκB in pulmonary artery smooth muscle cells[J]. Mol Biol Cell,2007, 18 : 4691 –4697. DOI:10.1091/mbc.E07-04-0391 |



