2. 400042 重庆,第三军医大学大坪医院野战外科研究所第一研究室,创伤、烧伤与复合伤国家重点实验室
2. State Key Laboratory of Trauma, Burns and Combined Injury, Department 1, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042, China
脓毒症是针对感染的失控宿主反应所致危及生命的器官功能障碍, 常发生于严重烧伤、多发伤、外科手术后的临床急危重患者,易发展为脓毒性休克和多器官功能障碍综合征[1-3]。肺脏是脓毒症发生时最易受损伤的靶器官。在脓毒症并发的多器官损伤中,急性肺损伤出现最早、发生率最高,同时也是导致患者死亡的重要原因之一。脓毒症所致的急性肺损伤若不及时治疗其死亡率可高达70%,是当今重症医学面临的重要问题之一[4-6]。寻找急性肺损伤的有效治疗策略具有重要的临床意义。吴茱萸碱(evodiamine,EVO)是从芸香科植物吴茱萸的果实中分离出来的一种喹唑啉咔类生物碱,具有抗动脉硬化、抗炎和抗肿瘤等药理作用[7]。但EVO对脓毒症发生时的器官损害是否有保护作用尚不清楚。本研究通过腹腔给予酵母多糖(zymosan)建立脓毒症模型,观察EVO对其中的急性肺损伤是否具有保护作用。
1 材料与方法 1.1 实验动物24只6~8周龄雄性C57BL/6小鼠, 体质量(20±2)g,购于第三军医大学大坪医院野战外科研究所实验动物中心,动物合格证号:SCXK(渝)2012-0005。
1.2 试剂EVO粉末由西安冠宇生物技术有限公司提供,纯度为99%;酵母多糖购自美国Sigma公司;小鼠髓过氧化物酶(myeloperoxidase,MPO)、白细胞介素-6 (interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)酶联免疫吸附法试剂盒购自武汉博士德生物工程有限公司;核转录因子-κB(NF-κB)p65 DNA结合活性检测试剂盒购自美国Active motif公司;核蛋白提取试剂盒及全细胞裂解液购自上海碧云天生物技术有限公司;TUNEL检测试剂盒购自罗氏公司。
1.3 实验动物分组采用随机数字表法将24只C57BL/6小鼠分为4组:正常对照组、EVO对照组、模型组、EVO治疗组, 每组6只。正常对照组腹腔给予500 μL PBS和100 μL 10%二甲基亚砜(DMSO);EVO对照组腹腔给予500 μL PBS和100 μL EVO(10 mg/kg);模型组腹腔注射500 μL酵母多糖(500 mg/kg)和100 μL 10% DMSO;EVO治疗组腹腔注射500 μL酵母多糖(500 mg/kg)和100 μL EVO (10 mg/kg)。
1.4 检测指标与方法建模后12 h,通过摘除眼球收集各组小鼠血液,同时获取肺组织,进行以下指标的检测。
1.4.1 ELISA检测血清、肺组织中炎症因子及MPO含量将收集的血液静置1 h后400×g离心10 min,取上清备检。同时向肺组织中加入蛋白裂解液,冰上匀浆,12 000 r/min低温离心5 min,收集上清备检。严格按照ELISA试剂盒说明书对血清及肺组织中的MPO及IL-6、TNF-α水平进行测定。
1.4.2 肺组织病理学检查取各组右肺组织,利用4%多聚甲醛固定24 h后依次经梯度乙醇脱水、石蜡包埋、组织切片、二甲苯脱蜡后苏木精-伊红(HE)染色,光镜下观察肺组织的病理变化。
1.4.3 肺组织湿干质量比测定取小鼠右下肺称湿质量,放入60 ℃恒温箱烤72 h至干质量恒定,称干质量,计算湿干质量比。
1.4.4 TUNEL法检测肺实质细胞凋亡以末端脱氧核苷酸转移酶介导的dUTP缺口末端标记法(TUNEL法)原位检测肺组织凋亡情况。按照试剂盒说明书步骤进行TUNEL标记,荧光显微镜检测荧光分布情况。其中细胞核呈绿色表示发生凋亡。
1.4.5 NF-κB p65蛋白DNA结合活性检测使用胞核蛋白抽提试剂盒提取肺组织的核蛋白后,严格按照NF-κB p65转录试剂盒的操作说明操作。
1.5 统计学分析计量资料数据用x±s表示,应用SPSS 21.0统计软件,多组间数据比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠一般情况比较正常对照组及EVO对照组小鼠精神状态正常,活泼好动,饮食、饮水正常,皮毛细密有光泽,双目有神,呼吸均匀,大便呈棕黑色、成形。模型组小鼠明显呈病态,蜷缩少动,饮食、饮水减少,毛竖少泽,双目微闭、分泌物增多,呼吸困难,腹泻,采血时血量少且黏稠。EVO治疗组小鼠一般状态也较差,但较模型组有明显缓解。
2.2 EVO对酵母多糖攻击下小鼠血清中IL-6和TNF-α含量的影响与正常对照组相比,模型组和EVO治疗组血清中IL-6、TNF-α含量均明显升高(P < 0.01),EVO治疗组中IL-6、TNF-α含量显著低于模型组(P < 0.01)。正常对照组和EVO对照组间差异无统计学意义(P>0.05, 表 1)。
| 组别 | IL-6 | TNF-α |
| 正常对照组 | 190.00±9.02 | 27.00±16.55 |
| EVO对照组 | 155.67±14.64 | 34.33±10.26 |
| 模型组 | 6 658.33±664.13a | 483.33±47.60a |
| EVO治疗组 | 2 545.00±468.40ab | 93.67±11.01ab |
| a:P < 0.01, 与正常对照组相比;b:P < 0.01,与模型组相比 | ||
2.3 EVO对酵母多糖攻击下小鼠肺组织中IL-6、TNF-α及MPO含量的影响
模型组及EVO治疗组肺组织中IL-6、TNF-α及MPO均显著高于正常对照组(P < 0.01),正常对照组与EVO单独处理组间差异无统计学意义(P>0.05)。与模型组相比,EVO治疗后可显著降低肺组织中上述指标的含量(P < 0.01)。见表 2。
| 组别 | IL-6 (pg/mg) | TNF-α (pg/mg) | MPO(ng/mg) |
| 正常对照组 | 203.33±31.13 | 156.33±8.62 | 20.00±5.00 |
| EVO对照组 | 251.67±52.64 | 164.00±12.53 | 19.00±3.00 |
| 模型组 | 1 101.67±7.51a | 525.00±36.04a | 54.33±5.03a |
| EVO治疗组 | 586.67±70.95ab | 364.00±36.04ab | 32.33±5.13ab |
| a:P < 0.01, 与对照组相比;b:P < 0.01,与模型组相比 | |||
2.4 EVO对酵母多糖刺激后小鼠肺组织病理学影响
小鼠肺组织病理学切片观察显示,正常对照组和EVO对照组小鼠的肺泡结构完好,肺泡壁薄且完整,肺泡间可见少量炎症细胞浸润;模型组肺泡结构严重破坏,大量肺泡的肺泡间隔增宽、塌陷,并可见大量中性粒细胞浸润;EVO治疗组肺泡结构尚可,肺泡间隔增宽、塌陷及中性粒细胞浸润情况较模型组明显减轻(图 1)。
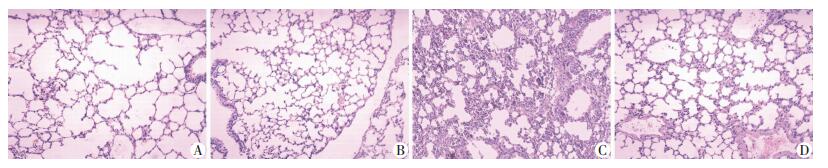
|
| A:正常对照组;B:EVO对照组;C:模型组;D:EVO治疗组 图 1 各组小鼠肺组织病理学改变情况比较(×200) |
2.5 EVO对酵母多糖刺激后小鼠肺组织湿干质量比的影响
模型组(5.573±0.240)及EVO治疗组(3.557±0.225)肺组织的湿干质量比较正常对照组(1.376±0.140)明显升高,差异有统计学意义(P < 0.01),EVO治疗组肺组织的湿干质量比显著低于模型组(P < 0.01),EVO单独处理组(1.280±0.141)与正常对照组比较差异无统计学意义(P>0.05)。说明,酵母多糖腹腔注射后小鼠出现明显的肺水肿,而EVO可缓解该症状。
2.6 EVO对酵母多糖刺激后小鼠肺组织凋亡情况的影响与正常对照组和EVO对照组比较,模型组和EVO治疗组绿色荧光颗粒明显增多;EVO治疗组与模型组比较,绿色荧光颗粒明显减少;正常对照组和EVO对照组的肺组织凋亡情况无显著差别(图 2)。
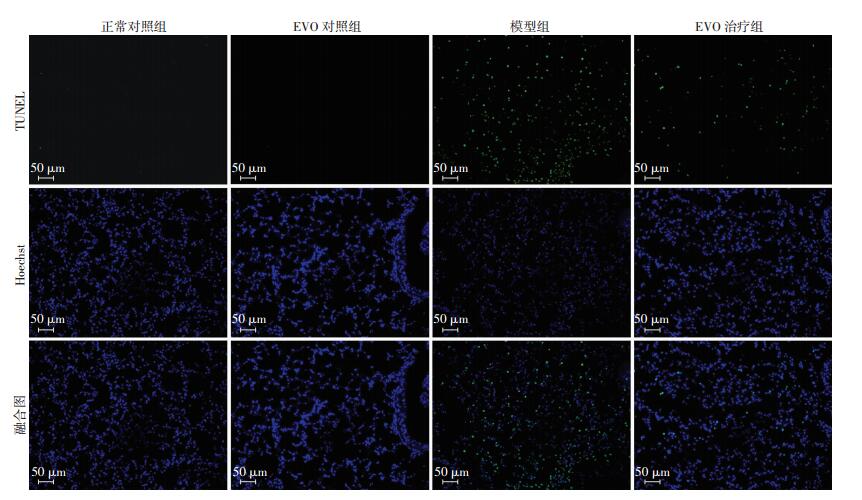
|
| 蓝色荧光代表核,绿色荧光表示凋亡 图 2 荧光显微镜观察各组小鼠肺组织实质细胞凋亡情况 |
2.7 EVO对酵母多糖刺激后小鼠肺组织中NF-κB p65 DNA结合活性的影响
与正常对照组(0.470±0.036)比较,模型组(1.947±0.060)和EVO治疗组(0.993±0.064)中肺组织NF-κB p65活性均显著升高(P < 0.01),EVO能显著降低酵母多糖导致的NF-κB p65活性增高;正常对照组和EVO对照组(0.423±0.035)比较差异无统计学意义(P>0.05)。
3 讨论脓毒症可导致机体各个脏器机能衰退,而肺是脓毒症时最易受损伤的靶器官。脓毒症时机体内各种炎症因子, 如TNF-α、IL-6等大量释放, 导致促炎和抗炎因子平衡失调,机体免疫功能受损, 出现全身炎症反应综合征;同时,炎症细胞在肺组织内聚集,导致肺上皮细胞及血管内皮细胞受损,造成肺水肿等病理变化,引起急性肺损伤[8-9]。酵母多糖是从酵母细胞壁中提取的大分子多糖复合物,小鼠注射后可导致急性腹膜炎、脓毒症和多器官障碍功能障碍[10-11]。本实验中,小鼠腹腔注射酵母多糖后,肺组织炎症因子TNF-α、IL-6及MPO水平明显升高,肺组织病理改变明显、凋亡增加,表明成功建立了小鼠急性肺损伤模型。
近年研究证实EVO具有抗肿瘤、保护心脏、减肥、抗炎、镇痛等多种药理作用[12]。本实验主要目的为研究EVO对小鼠脓毒症急性肺损伤的保护作用。MPO是一种重要的含铁溶酶体,存在于髓系细胞(主要是中性粒细胞和单核细胞)的嗜苯胺蓝颗粒中,是髓细胞的特异性标志[13]。研究[14-15]表明,急性肺损伤时,肺组织中会出现大量中性粒细胞浸润,而MPO是中性粒细胞侵入组织的标志之一,被认为是评价炎症严重程度的一个指标。对于MPO的检测能较好地反映急性肺损伤时中性粒细胞的浸润情况,可评价该病的病理改变和炎症程度。本研究发现,EVO可降低肺组织的MPO含量;肺组织病理切片结果也表明EVO可使肺组织的炎性细胞浸润减少。
IL-6为启动全身炎症反应的最强内源性炎症因子,能够催化和放大炎症反应。研究[16-18]发现,肺损伤患者的肺部和血液中IL-6的含量均比健康者高,其能可靠地反映肺组织的损伤程度。TNF-α为介导肺损伤的主要炎症因子之一,在肺损伤中其可增加肺内皮细胞活化、肺血管内皮通透性和粒细胞脱颗粒,而且TNF-α还可与多种炎症因子相互作用,启动炎症级联反应[14, 17, 19]。研究[20-22]表明,TNF-α又是导致细胞凋亡的重要介质之一。TNF-α可促进肺损伤早期肺泡上皮细胞、内皮细胞等多种细胞的凋亡, 而细胞凋亡又可促进急性肺损伤时的炎症反应。Wang等[23-24]对大鼠脓毒症急性肺损伤的研究表明,在有效药物治疗后,血清IL-6、TNF-α水平均有明显下降,大鼠生存率得到显著提高。提示,降低炎症因子IL-6、TNF-α可成为缓解肺损伤的一个重要策略。本实验采用ELISA法检测EVO对酵母多糖诱导的急性肺损伤小鼠肺组织和血液中的IL-6和TNF-α水平后发现,EVO可以显著减少肺组织和血液中TNF-α和IL-6的产生;同时EVO又可减轻肺组织实质细胞的凋亡。
NF-κB是一个重要的核转录因子,典型的NF-κB是p50和p65构成的异源二聚体,其与NF-κB的抑制性蛋白(inhibitor kappa B,IκB)结合呈非活性状态。当NF-κB被氧化应激、细胞因子、细菌脂多糖等激活后,IκB的上游激酶(inhibitor kappa B kinase,IKK)磷酸化而激活,IKK使IκB降解。NF-κB与IκB解离后转位入核,p65识别特定的DNA序列并与之结合,可调控多种与细胞增殖、分化、凋亡以及炎症相关基因的转录[25-26]。本研究表明, 在酵母多糖诱导的小鼠脓毒症急性肺损伤中, 肺组织中NF-κB p65 DNA结合活性明显增加,而EVO治疗可以显著抑制酵母多糖对NF-κB的激活。提示EVO可能是通过调节NF-κB p65 DNA结合活性,抑制炎症细胞因子的产生,从而减轻肺组织的损伤。但需要进一步的研究来验证这一假设。
综上所述,在酵母多糖诱导的小鼠脓毒症相关急性肺损伤中,EVO可以降低MPO活性、抑制中性粒细胞的肺组织浸润,并且可以通过抑制NF-κB的激活减少TNF-α、IL-6的产生及肺组织凋亡。这一发现可能为急性肺损伤的治疗提供新方法。
| [1] | Peake S L, Delaney A, Bailey M, et al. Goal-directed resuscitation for patients with early septic shock[J]. N Engl J Med,2014, 371 (16) : 1496 –1506. DOI:10.1056/NEJMoa1404380 |
| [2] | Huang C T, Tsai Y J, Tsai P R, et al. Severe Sepsis and Septic Shock: Timing of Septic Shock Onset Matters[J]. Shock,2016, 45 (5) : 518 –524. DOI:10.1097/SHK.0000000000000540 |
| [3] | 姚咏明, 栾樱译. 外科脓毒症免疫功能障碍的监测与调理策略[J]. 中华消化外科杂志,2014, 13 (7) : 516 –519. DOI:10.3760/cma.j.issn.1673-9752.2014.07.005 |
| [4] | Proudfoot A G, McAuley D F, Griffiths M J, et al. Human models of acute lung injury[J]. Dis Model Mech,2011, 4 (2) : 145 –153. DOI:10.1242/dmm.006213 |
| [5] | Zhao H, Zhao M, Wang Y, et al. Glycyrrhizic Acid Prevents Sepsis-Induced Acute Lung Injury and Mortality in Rats[J]. J Histochem Cytochem,2016, 64 (2) : 125 –137. DOI:10.1369/0022155415610168 |
| [6] | Varisco B M. The pharmacology of acute lung injury in sepsis[J]. Adv Pharmacol Sci,2011 : 254619 . DOI:10.1155/2011/254619 |
| [7] | Yang J, Cai X, Lu W, et al. Evodiamine inhibits STAT3 signaling by inducing phosphatase shatterproof 1 in hepatocellular carcinoma cells[J]. Cancer Lett,2013, 328 (2) : 243 –251. DOI:10.1016/j.canlet.2012.09.019 |
| [8] | 陈永锋, 周向东, 杨和平. 姜黄素对内毒素诱导的急性肺损伤的保护作用及机制研究[J]. 第三军医大学学报,2014, 36 (14) : 1492 –1495. |
| [9] | Osterbur K, Mann F A, Kuroki K, et al. Multiple organ dysfunction syndrome in humans and animals[J]. J Vet Intern Med,2014, 28 (4) : 1141 –1151. DOI:10.1111/jvim.12364 |
| [10] | Xie K, Liu L, Yu Y, et al. Hydrogen gas presents a promising therapeutic strategy for sepsis[J]. Biomed Res Int,2014 : 807635 . DOI:10.1155/2014/807635 |
| [11] | Hou L, Xie K, Li N, et al. 100% oxygen inhalation protects against zymosan-induced sterile sepsis in mice: the roles of inflammatory cytokines and antioxidant enzymes[J]. Shock,2009, 32 (4) : 451 –461. DOI:10.1097/SHK.0b013e31819c391a |
| [12] | Kobayashi Y. Effects of evodiamine, a major alkaloid of Goshuyu (Evodia Fruits), on TRPV1[J]. Nihon Yakurigaku Zasshi,2015, 146 (3) : 135 –139. DOI:10.1254/fpj.146.135 |
| [13] | Zolali E, Asgharian P, Hamishehkar H, et al. Effects of gamma oryzanol on factors of oxidative stress and sepsis-induced lung injury in experimental animal model[J]. Iran J Basic Med Sci,2015, 18 (12) : 1257 –1263. |
| [14] | Zhang T Z, Yang S H, Yao J F, et al. Sangxingtang inhibits the inflammation of LPS-induced acute lung injury in mice by down-regulating the MAPK/NF-kappaB pathway[J]. Chin J Nat Med,2015, 13 (12) : 889 –895. DOI:10.1016/S1875-5364(15)30094-7 |
| [15] | Li G, Zhou C L, Zhou Q S, et al. Galantamine protects against lipopolysaccharide-induced acute lung injury in rats[J]. Braz J Med Biol Res,2016, 49 (2) : e5008 . DOI:10.1590/1414-431X20155008 |
| [16] | Steinberg J, Halter J, Schiller H, et al. Chemically modified tetracycline prevents the development of septic shock and acute respiratory distress syndrome in a clinically applicable porcine model[J]. Shock,2005, 24 (4) : 348 –56. DOI:10.1097/01.shk.0000180619.06317.2c |
| [17] | Zhang Y, Liang D, Dong L, et al. Anti-inflammatory effects of novel curcumin analogs in experimental acute lung injury[J]. Respir Res,2015, 16 : 43 . DOI:10.1186/s12931-015-0199-1 |
| [18] | Sun C Y, Xu L Q, Zhang Z B, et al. Protective effects of pogostone against LPS-induced acute lung injury in mice via regulation of Keap1-Nrf2/NF-kappaB signaling pathways[J]. Int Immunopharmacol,2016, 32 : 55 –61. DOI:10.1016/j.intimp.2016.01.007 |
| [19] | Niu X, Wang Y, Li W, et al. Protective effects of Isofraxidin against lipopolysaccharide-induced acute lung injury in mice[J]. Int Immunopharmacol,2015, 24 (2) : 432 –439. DOI:10.1016/j.intimp.2014.12.041 |
| [20] | Kosacka M, Porebska I, Korzeniewska A, et al. Serum levels of apoptosis-related markers (sFasL, TNF-α, p53 and bcl-2) in COPD patients[J]. Pneumonol Alergol Pol,2016, 84 (1) : 11 –5. DOI:10.5603/PiAP.a2015.0080 |
| [21] | Mitola S, Sorbello V, Ponte E, et al. Tumor necrosis factor-alpha in airway secretions from cystic fibrosis patients upregulate endothelial adhesion molecules and induce airway epithelial cell apoptosis: implications for cystic fibrosis lung disease[J]. Int J Immunopathol Pharmacol,2008, 21 (4) : 851 –65. |
| [22] | Kopinski P, Dyczek A, Chorostowska-Wynimko J, et al. Higher incidence of alveolar lymphocytes (AL) apoptosis in smokers depends on BCL-2 expression and specific response to tumor necrosis factor alpha (TNFalpha). Bronchoalveolar lavage (BAL) material analysis from selected interstitial lung diseases (ILD) and healthy controls[J]. Przegl Lek,2012, 69 (10) : 731 –736. |
| [23] | Wang S Y, Li Z J, Wang X, et al. Effect of ulinastatin on HMGB1 expression in rats with acute lung injury induced by sepsis[J]. Genet Mol Res,2015, 14 (2) : 4344 –4353. DOI:10.4238/2015.April.30.7 |
| [24] | Demir M, Taylan M, Kaya H, et al. Histopathological and Biochemical Effects of Ecballium elaterium on Sepsis-Induced Lung Injury[J]. J Invest Surg,2016 : 1 –7. DOI:10.3109/08941939.2015.1111474 |
| [25] | Lopez-Alonso I, Aguirre A, Gonzalez-Lopez A, et al. Impairment of autophagy decreases ventilator-induced lung injury by blockade of the NF-kappaB pathway[J]. Am J Physiol Lung Cell Mol Physiol,2013, 304 (12) : L844 –852. DOI:10.1152/ajplung.00422.2012 |
| [26] | Young A M, Campbell E C, Lynch S, et al. Regional susceptibility to TNF-alpha induction of murine brain inflammation via classical IKK/NF-kappaB signalling[J]. PLoS One,2012, 7 (6) : e39049 . DOI:10.1371/journal.pone.0039049 |



