2. 400010 重庆,重庆医科大学附属第二医院:妇产科
2. Department of Obstetrics and Gynecology, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010, China
骨性关节炎(osteoarthritis,OA)是临床常见的一种关节疾病,是老年人致残的主要原因之一。OA是由关节软骨细胞生物力学性质改变和细胞外基质(extracellular matrix,ECM)合成与分解代谢失衡引发关节软骨进行性破坏的退行性病变[1]。近年国内外研究发现软骨细胞凋亡和ECM合成分解代谢紊乱与OA的发病、演变密切相关[2]。低强度脉冲超声(low-intensity pulsed ultrasound,LIPUS)最初在临床用于新鲜骨折和骨不连的治疗,取得良好疗效[3]。后期研究发现其对于软骨损伤以及其他结缔组织疾病也有一定疗效[4]。临床试验发现LIPUS可以显著缓解OA患者关节症状、减轻关节肿胀、增加关节灵活性、减轻炎症[5-6],但其具体作用机制仍不甚清楚。目前LIPUS对于OA软骨细胞的研究多集中在动物模型或原代细胞[7],其对人软骨细胞是否具有相同或者类似的作用研究较少。本实验采用体外原代培养的OA软骨细胞,分析LIPUS对于人OA关节软骨细胞的影响以及其发挥作用的可能机制,以期为LIPUS用于临床治疗OA提供更有力的理论支持。
1 材料与方法 1.1 标本来源2015年7-12月重庆医科大学附属第二医院骨科行膝关节表面置换术患者11例,年龄65~82岁,包括男性4例,女性7例。纳入标准:术前诊断为OA并计划行膝关节表面置换术的患者软骨标本。排除标准:术中Outerbridge分级0级的正常软骨组织和3~4级不能有效分离软骨细胞的软骨组织。标本取自术中切除的非负重区废弃软骨,根据术前影像学诊断及术中Outerbridge分级确定为实验所需组织。本研究经重庆医科大学附二院伦理委员会批准,并获得患者的知情同意。
1.2 主要仪器与试剂LIPUS仪由重庆医科大学生命科学研究院提供,iQ5荧光定量PCR仪(Bio-Rad公司)。DMEM/F12液体培养基(Gibco公司),FBS(PAN公司),胰蛋白酶(Sigma公司)、Ⅱ型胶原(COL2α1)酶(Sigma公司),甲苯胺蓝染色液(Blotopped公司),鼠anti-COL2α1抗体、鼠抗人蛋白聚糖(aggrecan)抗体(Abcam公司),兔抗人基质金属酶13(matrix metalloproteases 13,MMP13)抗体(Santa Cruz公司),ICC试剂盒(ZSGB-BIO公司),DAB显色试剂盒(BOSTER公司),总RNA提取试剂盒(BioTeke公司),逆转录试剂盒All-in-OneTM First-Strand cDNA Synthesis Kit,qRT-PCR反应试剂盒All-in-OneTM qPCR Mix(GeneCopoeia公司)。
1.3 原代软骨细胞分离培养采用两步酶联合消化法分离人软骨细胞。将术中所取组织标本无菌生理盐水冲洗后置于含适量DMEM/F12培养基的50 mL无菌离心管中,置于无菌干燥冰盒内迅速带回实验室。在超净台内用11号手术刀刮除软骨组织表层软骨膜,最大可能去除成纤维细胞对实验的干扰。PBS液冲洗3遍后用眼科剪和11号手术刀将软骨组织剪碎至1 mm3大小,转至含0.25%胰蛋白酶的15 mL离心管内,倾斜放置于37 ℃恒温敷箱消化30 min,每5分钟摇晃一次,使组织块与消化酶充分接触。加入等量含20%胎牛血清的培养基终止消化,1 000 r/min离心5 min, 弃上清,PBS液冲洗一遍,离心后加入0.2% Ⅱ型胶原酶(使用DMEM/F12培养基配制),倾斜放置于37 ℃细胞孵箱消化8~12 h,每2小时震荡一次,直至组织块大部分消失。将变浑浊的消化液用200目滤网过滤后, 1 000 r/min离心5 min, 收集细胞, PBS液清洗一遍后, 用20%FBS的DMEM/F12培养基重悬细胞并用台盼蓝实验计数并检测细胞活力, 后以1.0×105/mL密度接种于培养瓶, 然后平放于细胞孵箱(CO2浓度5%,温度37 ℃)培养,倒置显微镜下观察细胞大部分贴壁后首次更换培养基(约48 h),贴壁后每隔1天换液一次。
1.4 OA软骨细胞鉴定 1.4.1 甲苯胺蓝染色取传代培养至第一代(P1)软骨细胞(长满约80%),胰酶消化后接种于含细胞爬片的6孔板内,制作细胞爬片,细胞孵箱培养2~3 d,使细胞贴壁较紧,用注射器针头取出爬片,4%多聚甲醛室温固定30 min后用1%甲苯胺蓝染色液(硼酸盐法)室温染色45 min,双蒸水冲洗至爬片背景干净,无水乙醇脱水处理后封片,拍照。
1.4.2 Ⅱ型胶原细胞免疫化学染色细胞爬片制作及固定见1.4.1,将爬片置于含0.2%Triton X-100的PBS缓冲液中,室温下作用15 min,内源性酶灭活及封闭过程具体见ICC试剂盒说明书,封闭后不洗,甩干,滴加鼠anti-COL2α1一抗(1 :100)后置于湿盒内,4 ℃过夜孵育。第2天室温复温后,滴加生物素化二抗,室温孵育1 h,按照DAB试剂盒说明书配制显色液,显微镜观察染色效果,控制显色时间,显色完成后PBS液清洗,脱水,中性树胶封片,拍照。
1.5 细胞处理方法及分组取P1代软骨细胞长满后消化传至6孔板贴壁生长24 h,使用不同强度的脉冲超声处理贴壁细胞(P2),每天20 min, 处理7 d,分为对照组(0 mW/cm2)和实验组(30、60、90 mW/cm2)。确保每日超声处理时间点固定,根据细胞生长情况更换新鲜培养液。6孔板与超声探头间涂抹耦合剂,保证超声刺激到达细胞。
1.6 流式细胞仪检测软骨细胞凋亡率超声刺激细胞1周后,用胰酶消化液(不含EDTA)消化并收集细胞,PBS液清洗2遍(注意消化过程中吹打细胞手法轻柔),按照凋亡检测试剂盒说明书标记,室温下反应10 min(注意避光),后送流式细胞仪检测。
1.7 qPCR检测超声刺激细胞1周后,分别收集细胞提取总RNA,检测COL2α1、aggrecan和MMP13 mRNA表达差异。超纯总RNA快速提取试剂盒(离心柱型)提取细胞总RNA,逆转录试剂盒将总RNA逆转录为cDNA,qRT-PCR试剂盒配制20 μL反应体系(All-in-One qPCR Mix 10 μL;PCR forward primer 1 μL;PCR reverse primer 1 μL;ddH2O 6 μL;cDNA样本2 μL)。iQ5荧光定量PCR仪上机检测。引物序列根据NCBI提供各基因NM编号,由GeneCopoeia公司设计合成,引物序列见表 1。
| 基因名称 | 引物序列(5′→3′) | NM编号 | 片段大小 |
| GAPDH | 上游:GAAGGTGAAGGTCGGAGTC 下游:GAAGATGGTGATGGGATTTC |
NM_002046.3 | 195 bp |
| COL2α1 | 上游:CAGGTGAACCTGGACGAGAG 下游:CCCACAGCACCAGTCTCAC |
NM_001844.4 | 235 bp |
| aggrecan | 上游:GGAATGATGTTCCCTGCAAT 下游:GTCTGCGTTTGTAGGTGGTG |
NM_013227.2 | 215 bp |
| MMP13 | 上游:GAATTAAGGAGCATGGCGA 下游:GGATGTTTAGGGTTGGGGT |
NM_002427.2 | 205 bp |
1.8 Western blot检测
超声刺激细胞1周后,收集并提取6孔板内贴壁细胞总蛋白,检测COL2α1、aggrecan、MMP13在蛋白层面的表达差异。用低温(4 ℃)处理的PBS洗涤细胞3次,大小枪头交替吸干残留液体,加入RIPA裂解液(含1%蛋白酶抑制剂PMSF)冰上反应10 min,刮净细胞并用超声碎细胞机处理,4 ℃,13 000 r/min离心15 min后收集上清液(注意不要吸取底部沉淀),检测蛋白浓度后加入1/4体积的上样缓冲液煮沸,室温平衡后-20 ℃冰箱储存,待用。配胶后加蛋白样本及标记marker,进行SDS-PAGE电泳,切胶,制作电转三明治模型,转膜成功后见marker显色,5%牛奶封闭,加入小鼠Anti-COL2α1抗体(1 :200)、小鼠Anti-aggrecan抗体(1 :300)、兔Anti-MMP13抗体(1 :1 000)一抗,4 ℃孵育过夜。TBST漂洗,生物素化二抗室温孵育2 h后,ECL发光液显影、照相。所得条带使用Image Lab软件分析。
1.9 统计学方法采用SPSS 19.0统计软件,计量资料数据以x±s表示,各组间数据行单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 显微镜观察细胞形态原代软骨细胞2~3 d陆续贴壁生长,细胞呈多角形,扁平型,细胞核可见2~3个核仁。细胞生长速度偏慢,5~7 d后可见部分细胞呈集落式生长。14~17 d原代细胞可长满培养瓶。传代后细胞生长速度略加快,大致7~10 d可长满90%,见图 1。

|
| A:5~7 d后部分细胞集落式生长;B:10~14 d细胞基本融合 图 1 倒置显微镜下观察软骨细胞形态(×100) |
2.2 甲苯胺蓝染色及Ⅱ型胶原免疫化学染色
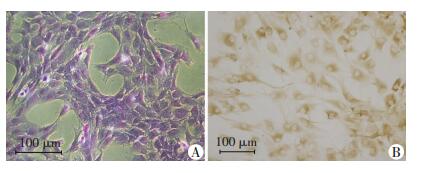
甲苯胺蓝染色及Ⅱ型胶原染色均为阳性,甲苯胺蓝染色可见软骨细胞呈蓝紫色,集落式生长的细胞内及细胞周围可见深蓝色异染颗粒。Ⅱ型胶原细胞免疫化学染色可见软骨细胞细胞质呈棕黄色,见图 2。
|
| A:甲苯胺蓝染色;B:Ⅱ型胶原免疫化学染色 图 2 软骨细胞甲苯胺蓝染色及Ⅱ型胶原染色阳性 |
2.3 流式细胞术检测细胞凋亡
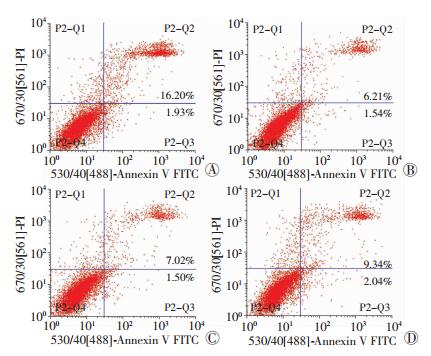
超声刺激1周后,与对照组[(18.13±0.83)%]相比,30、60、90 mW/cm2组细胞凋亡率[(7.75±0.79)%、(8.52±0.91)%、(11.38±0.85)%]降低(P < 0.05),以30 mW/cm2组效果更为明显(图 3)。
|
| A:对照组;B:30 mW/cm2组;C:60 mW/cm2组;D:90 mW/cm2组 图 3 流式细胞术检测各组软骨细胞凋亡率 |
2.4 qPCR检测相关蛋白的mRNA表达水平
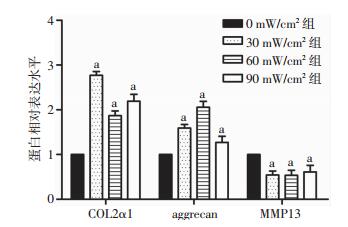
超声刺激1周后,30、60、90 mW/cm2组COL2α1和aggrecan mRNA表达水平明显高于对照组(0 mW/cm2组, P < 0.05),MMP13 mRNA表达水平明显低于对照组(P < 0.05),各处理组间不呈强度依赖性,见图 4。
|
| a:P < 0.05,与对照组(0 mW/cm2组)相比 图 4 qPCR检测不同超声刺激组COL2α1、aggrecan、MMP13 mRNA表达差异 |
2.5 Western blot检测相关蛋白表达水平
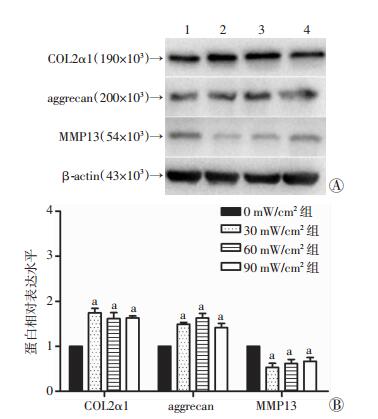
超声刺激1周后,30、60、90 mW/cm2组COL2α1和aggrecan蛋白表达水平明显高于对照组(0 mW/cm2组, P < 0.05),MMP13蛋白表达水平明显低于对照组(P < 0.05),各处理组间不呈强度依赖性,见图 5。
|
| A:Western blot检测1~4:分别为0、30、60、90 mW/cm2组;B:半定量分析a:P < 0.05,与对照组(0 mW/cm2组)相比 图 5 Western blot检测不同超声刺激组COL2α1、aggrecan、MMP13蛋白表达差异 |
3 讨论
OA是一种关节的退行性病变,其发病涉及关节软骨、软骨下骨、滑膜以及整个关节。关节软骨的退变在OA的发病过程中起关键作用[8]。关节软骨退变主要与软骨细胞凋亡增加和ECM代谢紊乱密切相关。研究发现OA软骨细胞的凋亡率远远高于正常软骨细胞[9]。OA软骨细胞的凋亡增加,可造成ECM合成减少,加速关节软骨退变[10]。MMP13是软骨中的主要胶原酶,同时也具有降解蛋白聚糖的能力。MMP13造成的ECM降解增加也在骨性关节炎发病过程中起重要作用[11]。凋亡增加合并ECM代谢紊乱形成恶性循环,共同影响OA的发生发展。所以,对于OA的治疗,关键在于找到一种有效方法,打断关节软骨退变过程中的恶性循环,延缓甚至扭转OA的发展。
LIPUS因其独特生物学效应最初用于促进骨折愈合,后续研究发现其亦可以促进牙槽骨改建和软骨损伤的修复[12]。本课题组在前期临床试验中发现低强度超声能够缓解OA关节肿胀并增加关节活动度,减轻关节炎症指标,对于膝OA有较好的治疗作用[13]。但目前LIPUS治疗OA的基础研究多集中在骨性关节炎动物模型或者IL-1诱导的OA软骨细胞[14-15],在人软骨细胞方面的研究较少。Korstjens等[16]用35S同位素示踪法分析LIPUS刺激体外培养人软骨细胞和组织块后,发现蛋白多聚糖的分泌增加。Choi等[17]采用藻酸盐立体培养体系,使用同位素示踪法分析低强度超声刺激后胶原蛋白与蛋白多糖的分泌和细胞的增殖,Northern blot法分析COL2α1和MMP-1等在基因层面的变化,发现低强度超声能够促进软骨细胞增殖和ECM的合成。本实验通过体外培养人OA软骨细胞,使用更成熟的实验技术探讨LIPUS对于OA软骨细胞的作用效果。甲苯胺蓝染色和Ⅱ型胶原免疫化学染色阳性说明成功建立实验所需细胞模型。为减少软骨细胞在体外单层培养过程中去分化现象的影响[18],本课题组选取第二代(P2)软骨细胞进行实验数据的采集分析。流式细胞术分析发现LIPUS可以降低OA软骨细胞的凋亡率。30、60、90 mW/cm2组细胞凋亡率均明显低于对照组,但以30 mW/cm2组效果更为明显。说明在一定超声强度范围内,LIPUS对于OA软骨细胞凋亡的抑制作用不呈强度依赖性,而是在适宜超声强度范围内产生某种机械效应,通过力化学转导通路将刺激信号传递至细胞内产生一系列的生物学效应。Vaughan等[19]研究发现200 mW/cm2和300 mW/cm2的LIPUS会因为超声探头换能器的局部产热导致成熟的牛软骨细胞的凋亡增加, 推测随着超声强度的增加而引发的热效应也可能对细胞产生细微影响。qPCR和Western blot检测发现,与ECM合成相关的COL2α1和aggrecan在基因和蛋白表达层面均增高,而与ECM分解代谢密切相关的MMP13表达则低于对照组,且不同处理组不呈超声强度依赖性。综合分析LIPUS对于软骨细胞凋亡及ECM合成的作用,30 mW/cm2可以作为最佳的强度选择。
综上所述,适宜强度的LIPUS可以抑制体外培养的OA软骨细胞凋亡,并促进OA软骨细胞合成COL2α1和aggrecan,抑制MMP13的合成, 起到保护软骨细胞,促进关节软骨ECM合成并抑制其分解的作用。但LIPUS是否对更接近人体生理环境的3-D立体培养条件下OA软骨细胞具有相同作用,以及LIPUS对平面培养的软骨细胞作用机制需要进一步的研究。
| [1] | Egloff C, Hügle T, Valderrabano V. Biomechanics and pathomechanisms of osteoarthritis[J]. Swiss Med Wkly,2012, 142 : w13583 . DOI:10.4414/smw.2012.13583 |
| [2] | Hwang H S, Kim H A. Chondrocyte Apoptosis in the Pathogenesis of Osteoarthritis[J]. Int J Mol Sci,2015, 16 (11) : 26035 –26054. DOI:10.3390/ijms161125943 |
| [3] | Padilla F, Puts R, Vico L, et al. Stimulation of Bone Repair with Ultrasound[J]. Adv Exp Med Biol,2016, 880 : 385 –427. DOI:10.1007/978-3-319-22536-4_21 |
| [4] | Khanna A, Nelmes R T, Gougoulias N, et al. The effects of LIPUS on soft-tissue healing: a review of literature[J]. Br Med Bull,2009, 89 : 169 –182. DOI:10.1093/bmb/ldn040 |
| [5] | Loyola-Sánchez A, Richardson J, Beattie K A, et al. Effect of low-intensity pulsed ultrasound on the cartilage repair in people with mild to moderate knee osteoarthritis: a double-blinded, randomized, placebo-controlled pilot study[J]. Arch Phys Med Rehabil,2012, 93 (1) : 35 –42. DOI:10.1016/j.apmr.2011.07.196 |
| [6] | Cakir S, Hepguler S, Ozturk C, et al. Efficacy of therapeutic ultrasound for the management of knee osteoarthritis: a randomized, controlled, and double-blind study[J]. Am J Phys Med Rehabil,2014, 93 (5) : 405 –412. DOI:10.1097/PHM.0000000000000033 |
| [7] | Ji J B, Li X F, Liu L, et al. Effect of low intensity pulsed ultrasound on expression of TIMP-2 in serum and expression of mmp-13 in articular cartilage of rabbits with knee osteoarthritis[J]. Asian Pac J Trop Med,2015, 8 (12) : 1043 –1048. DOI:10.1016/j.apjtm.2015.11.003 |
| [8] | Garstang S V, Stitik T P. Osteoarthritis: epidemiology, risk factors, and pathophysiology[J]. Am J Phys Med Rehabil,2006, 85 (11 Suppl) : S2 –11. DOI:10.1097/01.phm.0000245568.69434.1a |
| [9] | Hashimoto S, Ochs R L, Komiya S, et al. Linkage of chondrocyte apoptosis and cartilage degradation in human osteoarthritis[J]. Arthritis Rheum,1998, 41 (9) : 1632 –1638. DOI:10.1002/1529-0131(199809)41:9<1632::AID-ART14>3.0.CO;2-A |
| [10] | Musumeci G, Loreto C, Carnazza M L, et al. Characterization of apoptosis in articular cartilage derived from the knee joints of patients with osteoarthritis[J]. Knee Surg Sports Traumatol Arthrosc,2011, 19 (2) : 307 –313. DOI:10.1007/s00167-010-1215-0 |
| [11] | Troeberg L, Nagase H. Proteases involved in cartilage matrix degradation in osteoarthritis[J]. Biochim Biophys Acta,2012, 1824 (1) : 133 –145. DOI:10.1016/j.bbapap.2011.06.020 |
| [12] | 杨梅, 向学熔, 叶国, 等. 低强度超声对大鼠牙槽骨改建过程中COX-2和PGE2表达的影响[J]. 第三军医大学学报,2016, 38 (8) : 829 –834. DOI:10.16016/j.1000-5404.201508039 |
| [13] | 唐进, 黄良库, 李东, 等. 低频脉冲超声治疗膝骨关节炎疗效分析[J]. 第三军医大学学报,2010, 32 (23) : 2562 –2564. DOI:10.16016/j.1000-5404.2010.23.017 |
| [14] | Cheng K, Xia P, Lin Q, et al. Effects of low-intensity pulsed ultrasound on integrin-FAK-PI3K/Aktmechanochemical transduction in rabbit osteoarthritis chondrocytes[J]. Ultrasound Med Biol,2014, 40 (7) : 1609 –1618. DOI:10.1016/j.ultrasmedbio.2014.03.002 |
| [15] | Ito A, Aoyama T, Yamaguchi S, et al. Low-intensity pulsed ultrasound inhibits messenger RNA expression of matrix metalloproteinase-13 induced by interleukin-1β in chondrocytes in an intensity-dependent manner[J]. Ultrasound Med Biol,2012, 38 (10) : 1726 –1733. DOI:10.1016/j.ultrasmedbio.2012.06.005 |
| [16] | Korstjens C M, van der Rijt R H, Albers G H, et al. Low-intensity pulsed ultrasound affects human articular chondrocytes in vitro[J]. Med Biol Eng Comput,2008, 46 (12) : 1263 –1270. DOI:10.1007/s11517-008-0409-9 |
| [17] | Choi B H, Woo J I, Min B H, et al. Low-intensity ultrasound stimulates the viability and matrix gene expression of human articular chondrocytes in alginate bead culture[J]. J Biomed Mater Res A,2006, 79 (4) : 858 –864. DOI:10.1002/jbm.a.30816 |
| [18] | Karlsen T A, Shahdadfar A, Brinchmann J E. Human primary articular chondrocytes, chondroblasts-like cells, and dedifferentiated chondrocytes: differences in gene, microRNA, and protein expression and phenotype[J]. Tissue Eng Part C Methods,2011, 17 (2) : 219 –227. DOI:10.1089/ten.TEC.2010.0200 |
| [19] | Vaughan N M, Grainger J, Bader D L, et al. The potential of pulsed low intensity ultrasound to stimulate chondrocytes matrix synthesis in agarose and monolayer cultures[J]. Med Biol Eng Comput,2010, 48 (12) : 1215 –1222. DOI:10.1007/s11517-010-0681-3 |



