2. 401147重庆,重庆医科大学附属口腔医院:口腔疾病与生物医学重庆市重点实验室,重庆市高校市级口腔生物医学工程重点实验室 ;
3. 401147重庆,重庆医科大学附属口腔医院:口腔颌面外科
2. Chongqing Key Laboratory of Oral Diseases and Biomedical Sciences, Chongqing Municipal Key Laboratory of Oral Biomedical Engineering at Colleges and Universities, Stomatological Hospital of Chongqing Medical University, Chongqing, 401147, China ;
3. Department of Maxillofacial Surgery, Stomatological Hospital of Chongqing Medical University, Chongqing, 401147, China
口腔癌是世界上最常见的肿瘤之一,据WHO统计,每年新增口腔癌病例超过26万人,其中近13万人死亡。口腔癌在不同国家、地区的发病率差别很大,将近2/3的新增病例在发展中国家[1-3]。在我国,口腔癌的发病率为3.6/10万~8.0/10万,已居全身恶性肿瘤发病率的第10位[4]。现已证实,口腔癌的发生和发展受环境因素和遗传因素共同制约[5]。研究发现口腔癌的危险因素主要有吸烟、滥用酒精、辐射、病毒入侵、免疫缺陷等,其中病毒入侵主要是指人乳头瘤状病毒(human papillomavirus, HPV)感染,尤其是年轻人的扁桃体和口咽部感染[6-8]。
HPV是一种环状双链DNA病毒,属于乳多空病毒科A属,目前已发现和分离出100多种亚型,其中50多种亚型可以感染黏膜组织,引起黏膜鳞状上皮增生[9]。HPV-16型的早期基因E6(HPV16E6)和HPV-18型的早期基因E7(HPV18E7)被证实可导致细胞癌变或永生化[10-11]。虽然E6和E7都可导致肿瘤的发生发展,但它们的作用机制大有不同,E6与p53有关,而E7则与pRb有关[8]。在宫颈癌中,过表达的HPV16E6可与抑癌基因p53结合,进而促进p53泛素化,导致细胞恶化[12]。也有学者发现,在宫颈癌中HPV16E6可与p53结合,干扰细胞凋亡相关信号,从而抑制细胞凋亡,最终使细胞发生恶化[13]。
本研究根据以上研究基础和科学理论,采用免疫组织化学方法,对口腔癌癌周正常组织、癌前病变组织和口腔癌变组织以及口腔癌不同病理分级和临床分期的组织标本进行检测和分析,探讨HPV16E6和p53在口腔癌中的表达,评价HPV16E6和p53的表达变化与口腔癌恶性程度的关系,以期为阐明口腔癌的发病机制奠定基础。
1 资料与方法 1.1 一般资料本研究中149例口腔癌病例、88例口腔癌癌前病变病例(其中白斑患者35例、红斑患者31例、口腔黏膜下纤维化症11例、口腔扁平苔藓8例和慢性溃疡3例)均来自2008-2015年我院颌面外科和黏膜科患者的病理组织切片,49例癌周正常组织病例来自口腔癌患者距癌组织大于1.5 cm的正常组织病理切片。149例口腔癌患者中男性107例、女性42例,年龄42~81(59.2±15.7)岁。根据口腔癌2010年第7版AJCC标准进行TNM分期,其中Ⅰ期23例、Ⅱ期30例、
Ⅲ期42例、Ⅳ期54例。按口腔癌病理分化程度将口腔癌分为3级,其中高度分化(Ⅰ级)47例、中度分化(Ⅱ级)56例、轻度分化(Ⅲ级)46例。实验条件和技术均由口腔疾病与生物医学重庆市重点实验室支持,并获得重庆医科大学伦理道德委员会支持。
1.2 主要仪器与试剂冰冻切片机[德国徕卡公司(CM1900UV)],倒置生物显微镜[日本奥林巴斯公司(CKX31)],免疫染色封闭液[江苏海门碧云天生物技术有限公司(P0102)],实验用兔抗人HPV16E6单克隆抗体(sc-1584,Santa,USA)和兔抗人p53单克隆抗体(No.2527S, CST, USA)。
1.3 免疫组织化学方法(DAB染色法)石蜡切片法将病理组织进行切片。具体染色步骤如下:将石蜡切片脱蜡酒精水化;将切片放至3%H2O2甲醇溶液8 min,清除内源性过氧化物酶,PBST洗涤;再将切片放入柠檬酸缓冲液95 ℃水浴条件下,20 min抗原修复,自然冷却后PBST洗涤;5%驴血清封闭1 h;孵育一抗(兔抗人HPV16E6单克隆抗体或兔抗人p53单克隆抗体)4 ℃过夜。第2天PBST洗涤后孵育二抗(驴抗兔)1 h,PBST洗涤;常规DAB-H2O2染色10 min;苏木精复染7 min;10%醋酸水溶液作为分化剂分化切片,流水冲洗15 min,乙醇梯度水化;最后放入二甲苯内1 min,用90%中性树胶封片。
1.4 阳性标准的判断和定义HPV16E6和p53属于核蛋白,DAB染色以细胞核出现棕黄色颗粒记为阳性细胞。确定阳性标准:任选5个阳性区的高倍视野,按阳性细胞所占肿瘤细胞百分比的平均数划分,比例>25%且染色深确定为阳性,≤25%且染色浅确定为阴性。
1.5 统计学处理运用SPSS 19.0统计软件,根据计数资料类型,采用四格表的χ2检验。检验水准α=0.05。
2 结果 2.1 年龄和性别因素对口腔癌HPV16E6和p53阳性表达的影响年龄和性别因素对149例口腔癌病例HPV16E6、p53阳性表达率没有显著影响(P>0.05,表 1)。
| 分类 | 病例数 | HPV16E6 | p53 |
| 年龄(岁) | |||
| ≥50 | 87 | 66(75.9) | 24(27.6) |
| < 50 | 62 | 53(85.5) | 14(22.6) |
| 性别 | |||
| 男 | 107 | 93(86.9) | 24(22.4) |
| 女 | 42 | 32(76.2) | 12(28.6) |
2.2 口腔癌组织中HPV16E6和p53的表达
HPV16E6和p53属于核蛋白,DAB染色时细胞核呈棕黄色颗粒。在口腔癌组织中,HPV16E6阳性细胞呈粗大颗粒状,弥漫性分布,染色深;p53阴性细胞较为分散,染色浅(图 1)。
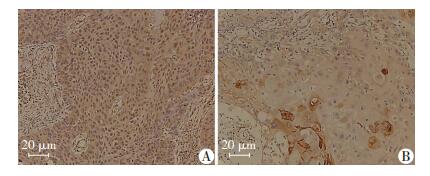
|
| 图 1 S-P染色观察口腔癌组织中HPV16E6蛋白(A)和p53蛋白(B)表达 |
2.3 不同口腔病变组织中HPV16E6和p53的阳性表达
在口腔癌、癌前病变和癌周正常组织中,HPV16E6阳性表达率分别是79.9%、38.6%、2.0%,口腔癌的阳性表达率明显高于其他2组(P < 0.05);p53阳性表达率分别是24.2%、55.7%、91.8%,口腔癌的阳性表达率明显低于其他2组(P < 0.05,表 2)。
| 组织类型 | 病例数 | HPV16E6 | p53 |
| 口腔癌 | 149 | 119(79.9)a | 36(24.2)a |
| 癌前病变 | 88 | 34(38.6)a | 49(55.7)a |
| 癌周正常组织 | 49 | 1(2.0) | 45(91.8) |
| a:P < 0.05,与癌周正常组织比较 | |||
2.4 口腔癌临床分期与HPV16E6和p53的阳性表达
149例口腔癌病例按临床分期分为4期。随着临床分期的增加,HPV16E6阳性表达率逐渐增加,而p53阳性表达率逐渐减少(P < 0.05,表 3)。
| 临床分期 | 病例数 | HPV16E6 | p53 |
| Ⅰ | 23 | 11(47.8) | 15(65.2) |
| Ⅱ | 28 | 22(78.6)a | 9(32.1)a |
| Ⅲ | 44 | 38(86.4)a | 8(18.2)a |
| Ⅳ | 54 | 49(90.7)a | 6(11.1)a |
| a:P < 0.05,与临床分期Ⅰ期比较 | |||
2.5 口腔癌病理分级与HPV16E6和p53的阳性表达
149例口腔癌病例按病理分级分为3级。随着病理分级的增加,HPV16E6阳性表达率逐渐增加,而p53阳性表达率逐渐减少(P < 0.05,表 4)。
| 病理分级 | 病例数 | HPV16E6 | p53(5) |
| Ⅰ | 47 | 31(66.0) | 18(38.3) |
| Ⅱ | 56 | 48(85.7)a | 10(20.8)a |
| Ⅲ | 46 | 43(93.5)a | 6(13.0)a |
| a:P < 0.05,与病理分级Ⅰ级比较 | |||
3 讨论
近年来发现非吸烟、非饮酒患者口腔癌的发病可能与HPV有关。HPV的存在十分广泛,其中HPV-16型在口腔鳞癌患者中的检出率很高[8, 14-15]。
本研究结果显示,在不同年龄阶段和不同性别之间,HPV16E6和p53的阳性表达率并没有统计学差异。然而,有研究[16]报道,年龄大于55岁是口腔癌发病的主要原因之一。本研究结果与之前的研究结果有一定的出入,可能是因为按年龄分组时并没有考虑吸烟、酗酒等因素。本实验结果提示,HPV16E6在口腔癌中的阳性表达率明显高于口腔癌癌前病变和口腔癌癌周正常组织,而p53则相反;随着临床分期和病例级数的增加,HPV16E6的阳性表达率逐渐升高,而p53的阳性表达率则逐渐降低。这一结果提示,HPV16E6可能与口腔癌的发生、发展呈正相关,而p53可能与其呈负相关。因此,本研究结果提示,检测口腔病变组织中HPV16E6和p53的表达对于口腔癌的判定及其恶性程度的评定有借鉴意义。
有文献报道,HPV-16和p53与口腔癌有一定的相关性。Wang等[8]发现,当HPV-16呈阳性时,病例组与对照组的比值比(odds ratio, OR)值为2(HPV-16阴性时,病例组与对照组的OR值为1),这一结果表明HPV-16是口腔癌的危险因素。Li等[7]发现注射慢病毒rAd-p53的同时结合化学治疗,能够使促凋亡蛋白Bax表达增加,抗凋亡蛋白Bcl-2表达减少,显著提高病理Ⅲ级口腔癌患者的生存率。同时,结果表明p53表达增加能促进细胞凋亡,从而抑制肿瘤的发生。在口腔癌的发生和发展过程中,HPV16E6与p53也可能通过相互作用,促进肿瘤发生的进程。研究发现,当机体内HPV16E6过表达时,它会与抑癌基因p53结合,促进p53泛素化降解,最终导致细胞恶性增殖[12, 17];或者,过表达的HPV16E6与p53结合后,干扰细胞凋亡信号,最终抑制细胞凋亡[13, 15, 17];也有可能是过表达的HPV16E6蛋白通过其他途径和机制影响口腔癌的进程,如HPV16E6与端粒酶催化亚基启动子的抑制因子x1-91特异性结合,经HPV16E6相关蛋白介导的泛素酶体途径降解,从而减少对启动子的抑制,使端粒酶活性增加[12-13, 16];或者HPV16E6过度表达时中心体数目增多,引起细胞多级分裂、染色体不分离及非整倍体出现,最终导致基因组不稳定性增加[12, 15, 18]。
HPV16E6和p53在宫颈癌发生发展的研究已经取得了一定进展,然而,在口腔癌中HPV16E6和p53是通过上述哪种机制参与肿瘤的发生发展过程还有待进一步研究。
| [1] | 傅锦业, 高静, 郑家伟, 等. 口腔癌相关危险因素的流行病学调查分析[J]. 中国口腔颌面外科杂志,2011, 9 (4) : 316 –322. |
| [2] | 李军. 540例口腔癌及口咽癌的临床病例分析[D].福州:福建医科大学口腔医学院, 2014. |
| [3] | 陈燕青, 王家东. 头颈部多原发癌-附28例病例分析[J]. 现代肿瘤医学,2007, 15 (12) : 1758 –1761. |
| [4] | 张建祖. 口腔癌流行病学研究进展[J]. 包头医学院学报,2012, 29 (1) : 114 –115. |
| [5] | Zygogianni A G, Kyrgias G, Karakitsos P, et al. REVIEW Open Access Oral squamous cell cancer: early detection and the role of alcohol and smoking[J]. Head Neck Oncol,2011, 3 : 2 . DOI:10.1186/1758-3284-3-2 |
| [6] | 刘瑶, 张志霞, 严玉仙. 口腔癌和口咽癌的流行病学[J]. 国外医学(医学地理分册),2010, 31 (4) : 266 –269. |
| [7] | Li Y, Li L J, Wang L J, et al. Selective intra-arterial infusion of rAd-p53 with chemotherapy for advanced oral cancer: a randomized clinical trial[J]. BMC Med,2014, 12 : 16 . DOI:10.1186/1741-7015-12-16 |
| [8] | Wang Z, Sturgis E M, Zhang Y, et al. Combined p53-related genetic variants together with HPV infection increase oral cancer risk[J]. Int J Cancer,2012, 131 (3) : E251 –E258. DOI:10.1002/ijc.27335 |
| [9] | 刘玲.人乳头瘤状病毒(HPV)感染和MHC-Ⅰ类分子表达与食管鳞状细胞癌发生关系的研究[D].石家庄:河北医科大学第二医院, 2014. |
| [10] | Togawa K, Rustgi A K. Human papillomavirus-16 esophagus squamous cancer cell lines does not require heterologous E1 and E2 proteins[J]. J Med Virol,1995, 45 (4) : 435 –438. DOI:10.1002/(ISSN)1096-9071 |
| [11] | Maeda H, Kubo K, Sugita Y, et al. DNA vaccine against hamster oral papillomavirus-associated oral cancer[J]. J Int Med Res,2005, 33 (6) : 647 –653. DOI:10.1177/147323000503300606 |
| [12] | 吕秀芳, 孔令非. 人乳头状瘤病毒E6/E7mRNA研究进展[J]. 中华实用诊断与治疗杂志,2016, 30 (2) : 111 –113. |
| [13] | Ji X, Neumann A S, Sturgis E M, et al. p53 codon 72 polymorphism associated with risk of human papillomavirus-associated squamous cell carcinoma of the oropharynx in never-smokers[J]. Carcinogenesis,2008, 29 (4) : 875 –879. DOI:10.1093/carcin/bgn039 |
| [14] | Sturgis E M, Cinciripini P M. Trends in head and neck cancer incidence in relation to smoking prevalence: an emerging epidemic of human papillomavirus-associated cancers[J]. Cancer,2007, 110 (7) : 1429 –1435. DOI:10.1002/(ISSN)1097-0142 |
| [15] | Liang F, Kina S, Takemoto H, et al. HPV16E6-dependent c-fos expression contributes to AP-1 complex formation in SiHa cells[J]. Mediators Inflamm,2011, 2011 : 263216 . DOI:10.1155/2011/263216 |
| [16] | 刘宇, 罗治彬, 王彝, 等. 212例口腔癌患者的流行病学危险因素分析[J]. 实用癌症杂志,2014, 29 (2) : 160 –161. |
| [17] | Chen X, Sturgis E M, Etzel C J, et al. p73 G4C14-to-A4T14 polymorphism and risk of human papillomavirus associated squamous cell carcinoma of the oropharynx in never smokers and never drinkers[J]. Cancer,2008, 113 (12) : 3307 –3314. DOI:10.1002/cncr.23976 |
| [18] | Chen X, Sturgis E M, Lei D, et al. Human papillomavirus seropositivity synergizes with MDM2 variants to increase the risk of oral squamous cell carcinoma[J]. Cancer Res,2010, 70 (18) : 7199 –7208. DOI:10.1158/0008-5472.CAN-09-4733 |



