脑出血(intracerebral hemorrhage,ICH)是一种常见的、病死率和致残率极高的重症疾病。目前有研究证实高盐摄入与高血压发病密切相关[1],而高血压是脑出血的一个重要病因和诱因[2],因此推测高盐摄入导致脑出血原因可能为高盐摄入首先导致血压升高,继而发生脑出血。但有临床研究报道高盐除了可直接引起血压增高,还可单独诱发脑出血并对脑出血预后产生重要影响[3]。高血压可导致全身中小动脉平滑肌细胞增殖、血管壁增厚等改变[4],而高血压与高盐相互作用对脑血管的影响则可表现为使脑血管出现渗透性改变。Lee等[5]采用卒中易感型自发性高血压大鼠(stroke-prone spontaneous hypertensive rats, SHRsp)饲喂高盐饮食的方法诱导SHRsp出现自发性脑出血,并用磁共振研究的方法观察了脑出血特点及血管渗透性增加。本研究以饲喂高盐饮食诱导不同血压大鼠脑出血的方法,观察大鼠脑出血特点,并从组织学和超微结构上观察大鼠脑微血管结构的改变,以期探索高盐摄入与脑出血发生发展过程之间的关系。
1 材料与方法 1.1 实验动物与分组SPF级6周龄雄性自发性高血压大鼠(spontaneously hypertensive rats,SHR)和日本京都大鼠(Wistar-Kyoto rats,WKY)各60只,均购于北京维通利华实验动物技术有限公司。按随机数字表法将实验动物分为4组,即SHR+常规饮食组(SHRN)、SHR+高盐饮食组(SHRS)、WKY+常规饮食组(WKYN)、WKY+高盐饮食组(WKYS),每组30只。每组取20只用于观察监测其血压改变、行为学表现、存活分析、脑组织HE染色、脑微血管透射电镜检查,取5只用于脑组织含水量检测,取5只用于脑血管壁通透性检查。
1.2 高盐饮食饲喂方法及血压测量SHRS和WKYS饲喂4%高盐饮食(饮水中加入食盐),SHRN和WKYN饲喂常规饮食,从开始饲喂高盐饮食后每日观察大鼠行为学表现及神经功能症状,采用美国IITC Life Science公司生产的无创血压测试仪测量大鼠尾动脉收缩压,每周1次,至20只死亡至5只。动物室温度(22±5)℃,相对湿度(45±10)%。
1.3 行为学观察和神经功能缺损评分每日观察大鼠行为学表现,参照Longa等[6]的5分制方法进行神经功能缺损评分。0分:无神经功能缺损症状;1分:轻度神经功能缺损(前爪不能完全伸直);2分:中度神经功能缺损(行走时转圈);3分:重度神经功能缺损(行走时倾倒);4分:不能自发行走, 意识丧失。大鼠开始出现上述行为学表现后开始评分,记录死亡前最高分。
1.4 灌注取脑10%水合氯醛5 mL/kg腹腔注射麻醉,仰卧位固定大鼠,打开胸腔,暴露心脏,迅速将输液针经左心室插入升主动脉内固定,剪开右心耳,0.9%温生理盐水250 mL(含0.5 mL注射用肝素钠)灌注至右心耳流出清亮液体,4%多聚甲醛(pH 7.4)300 mL先快后慢灌注约30 min,至鼠尾完全变硬后,开颅取脑,并用上述灌注液密闭固定1周。
1.5 HE染色观察饲喂8周高盐饮食后,SHRS组和WKYS组各取出现神经功能缺损大鼠5只,SHRN组和WKYN组随机取5只作为对照,灌注取脑并固定后,将固定好的脑组织,以0.01 mol/L PBS冲洗,常规梯度乙醇溶液脱水,二甲苯透明,经石蜡包埋,用组织切片机制备厚度为6 μm的组织切片,常规HE染色,显微镜观察。
1.6 脑含水量测定参照1.5中HE染色的方法每组取大鼠5只,麻醉后迅速取出脑组织,立即称湿质量。然后将组织块切细后放入电热烘箱中,100 ℃烘烤24 h,称取干质量,按公式计算脑水肿含量。
组织含水量=(湿质量-干质量)/湿质量×100%
1.7 伊文氏蓝(Evans blue,EB)检测血脑屏障(blood-brain barrier,BBB)通透性根据文献[7]报道的方法,取死亡高峰时间段内出现神经功能缺损大鼠5只,按30 mg/kg给予2 mg/mL EB(Sigma公司)经股静脉注射2 h后,经心脏灌注生理盐水,迅速断头取脑,取出血周围约160 mg脑组织,称质量后放入3 mL甲酰胺中,避光,37 ℃恒温水浴箱中72 h后,用分光光度计测其光密度,依据EB/甲酰胺标准品求出每个标本所含EB含量。
1.8 脑血管免疫荧光染色将石蜡组织标本切片,常规脱蜡至水,置于Tris-EDTA缓冲液(pH 8.5)中微波加热20 min进行抗原修复,5%驴血清室温封闭30 min,去血清后分别滴加兔抗鼠多克隆抗体vWF、兔抗鼠多克隆抗体claudin-5抗体(美国Santa Cruz),4 ℃孵育过夜,PBS冲洗5 min×3次,滴加荧光二抗,室温孵育1 h,PBS洗涤后荧光封片剂封片,荧光显微镜(德国CarlZeiss)下观察并拍照,检测微血管内皮细胞vWF和claudin-5的表达情况,免疫荧光强度结果根据文献[8]方法观察分析。
1.9 透射电镜观察将大鼠用10%水合氯醛5 mL/kg腹腔注射麻醉后暴露脑组织,活体迅速取基底节区及皮质区组织,迅速放入2.5%戊二醛中,并将组织修成1 mm3的组织块,放入2.5%戊二醛(电镜级)中充分固定。经1%锇酸后固定,丙酮梯度脱水,环氧树脂618包埋,超薄切片,铀染,铅染后日本电子公司JEM-1400PLUS透射电镜观察血管超微结构。
1.10 统计学分析采用SPSS 13.0统计软件,计量资料以x±s表示,采用多因素方差分析,方差齐性检验如齐性用LSD法,不齐则用校正Dunnett T3检验,以P < 0.01表示差异有统计学意义。
2 结果 2.1 各组大鼠血压变化WKYN血压值较稳定,未见血压值有显著改变(P>0.05),SHRN大鼠血压值随年龄增长而增加(P < 0.01),WKYS出现血压增高(P < 0.01),但仍较SHRN血压值低(P < 0.01),SHRS血压明显增高(P < 0.01),最高可达256 mmHg(图 1)。
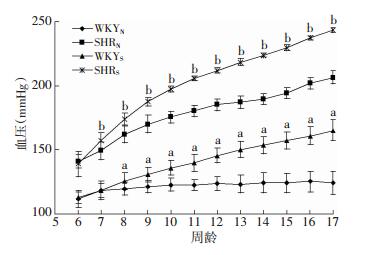
|
| a:P < 0.01,与WKYN比较;b:P < 0.01,与SHRN比较 图 1 各组大鼠随年龄增长血压变化 |
2.2 行为学表现及评分
WKYN和SHRN均未见明显神经功能缺损表现,WKYS、SHRS均出现神经功能缺损症状,最明显表现为握前爪和转圈,SHRS更为为明显,出现走路不稳、不能自发行走等严重神经功能缺损症状,Longa评分WKYS(1.35±0.93)分,SHRS(2.05±1.15)分,两者差异有统计学意义(P < 0.01)。
2.3 高盐饮食饲喂后大鼠死亡情况SHRN和WKYN正常存活;SHRS和WKYS均从11周龄开始死亡,SHRS于13~14周龄达高峰,18周龄时全部死亡,WKYS于14~15周龄达死亡高峰,19周龄时全部死亡(图 2)。
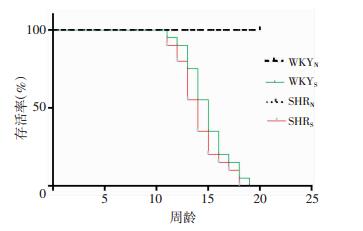
|
| 图 2 各组大鼠存活率曲线 |
2.4 脑含水量及EB含量
WKYN与SHRN脑含水量差异无统计学意义(P>0.01),WKYS和SHRS脑含水量较WKYN和SHRN明显增加(P < 0.01),SHRS脑含水量较WKYS明显增加(P < 0.01)。EB含量与脑含水量变化一致,WKYN与SHRN EB含量差异无统计学意义(P>0.01),WKYS与SHRS EB含量较WKYN与SHRN明显增加(P < 0.01),且SHRS EB含量较WKYS明显增加(P < 0.01,表 1)。
| 组别 | 含水量(%) | EB含量(μg/g) |
| WKYN | 77.16±0.06a | 3.98±0.06a |
| SHRN | 77.41±0.07ab | 4.11±0.12ab |
| WKYS | 79.55±0.59 | 9.78±0.63 |
| SHRS | 81.93±1.28 | 13.47±1.76 |
| a:P < 0.01,与WKYS比较;b:P < 0.01,与SHRS比较 | ||
2.5 脑出血大鼠脑组织HE染色观察
SHRS、WKYS两组均出现脑出血,但与WKYS组比较,SHRS出血较明显,出血点数量较多、出血量较大。SHRS组HE染色的10只大鼠均观察到圆形出血点,数量均在5个以上,最多1只可见20余个大小不等的出血点,最大直径可达800 μm;WKYs组染色的10只大鼠中有4只可见出血点,出血点最少1只仅有1个微小出血点,最多1只可见7个出血点,最大直径约500 μm。两者均为圆形渗出性出血,未见完整的红细胞,出血部位脑组织HE染色处均有碎裂,出血点紧邻血管(图 3)。SHRN和WKYN两组均未观察到类似出血。
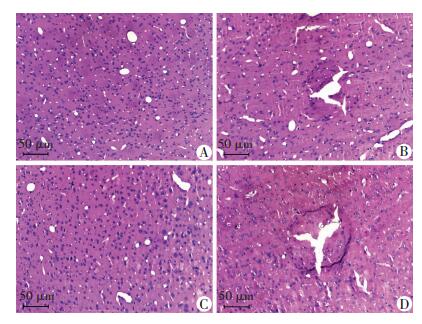
|
| A:WKYN;B:WKYS;C:SHRN;D:SHRS 图 3 HE染色观察各组大鼠脑组织改变特点及出血情况 |
2.6 大鼠脑血管免疫荧光染色
以vWF标记的脑血管中,WKYN及SHRN组中血管平滑,呈连续条带状分布,强阳性表达(图 4A、C)。WKYs及SHRS组可见血管断续性改变,血管粗细不均匀,WKYs呈阳性表达(图 4B),SHRS呈弱阳性表达(图 4D)。在血管claudin-5免疫荧光染色中,WKYN和SHRN呈强阳性表达(图 5A、C),WKYs和SHRS荧光信号减弱,WKYs呈阳性表达(图 5B),SHRS呈弱阳性表达(图 5D)。
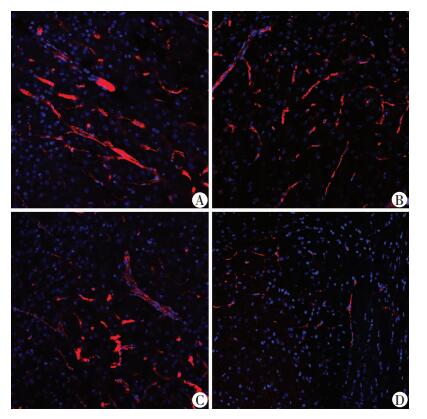
|
| A:WKYN;B:WKYS;C:SHRN;D:SHRS 图 4 免疫荧光染色观察各组大鼠脑微血管内皮细胞vWF的表达(×100) |
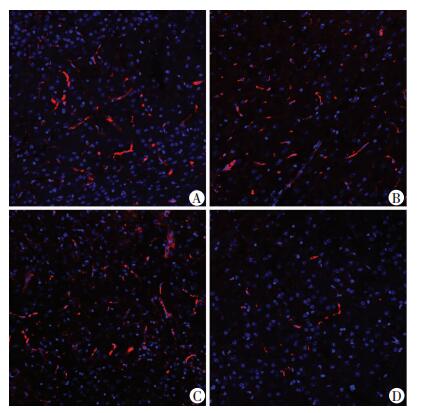
|
| A:WKYN;B:WKYS;C:SHRN;D:SHRS 图 5 免疫荧光染色观察各组大鼠脑微血管内皮细胞claudin-5的表达(×100) |
2.7 大鼠脑血管透射电镜检查
透射电镜结果可见WKYN和SHRN组管壁平滑,与血管周围组织联系紧密,紧密连接成连续带状,细胞间未见间隙(图 6A、C);WKYs、SHRS血管与周围组织间隙增宽,管壁厚薄不均,出现空泡样改变,内皮细胞间紧密连接消失,细胞间出现明显裂隙(图 6B、D)。
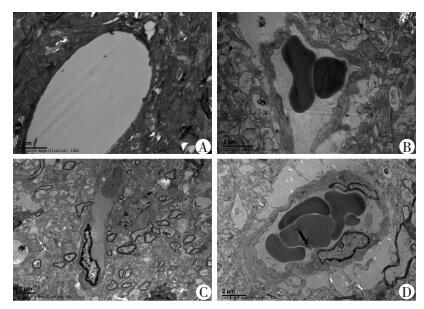
|
| A:WKYN;B:WKYS;C:SHRN;D:SHRS 图 6 透射电镜观察各组大鼠脑微血管结构改变 |
3 讨论
脑出血又称出血性脑卒中,是脑卒中的一个亚型。高血压病是脑出血最常见的病因,同时严重影响脑出血患者的预后[9]。一项统计研究[10]显示:血压是出血性脑卒中及缺血性脑卒中的重要危险因素,当血压高于140/90 mmHg时,77%的患者出现了首次脑卒中。高盐摄入与原发性高血压病(essential hypertension, EH)关系密切。大量临床研究报道高血压发生率与平均每日的钠摄入量呈正相关,即钠摄入量越多,血压越高;也有动物模型研究显示,饲喂高盐饮食的大鼠血压较饲喂正常饮食的大鼠血压升高[14-16]。因此,脑出血是继发于高盐引起血压增高以后还是高盐可直接作用于脑血管引起脑出血还需要通过实验研究证实。
新近研究显示,高盐摄入可直接影响脑出血的发生及预后且不依赖于血压升高,这可能是由于高盐可直接损伤靶器官的结构。日本一项对12个区域进行的调查研究[17]显示,盐摄入与平均动脉压及脑卒中病死率呈正相关,但是平均动脉压与病死率并不相关,多因素分析显示盐摄入是脑卒中一个独立的死亡因素,与高血压无关。美国一项以人群为基础的队列研究[18]显示,当人每日盐摄入量超过4 g时,每增加0.5 g盐摄入,脑中风概率增加17%。英国一项研究[19]显示,在19~64岁的人口中减少15%的盐摄入量,血压降低,脑卒中及缺血性心脏病病死率降低。但是这些研究主要集中于临床研究,有关盐摄入与脑出血直接关系的实验性研究还不多。
除Lee等[5]的报道研究外,Bailey等[20]报道SHRsp内皮细胞紧密连接的早期改变增加了血脑屏障功能障碍和脑出血概率。高盐可加重对紧密连接的改变,这些改变包括claudin-5、MMP-9、胶质纤维酸性蛋白等。此外,高盐也损伤了正常血压的WKY大鼠的神经血管单元。SHRsp是SHR的一个亚型,其卒中发生率较SHR高。SHR的遗传性高血压与临床上人的原发性高血压相似,是最常用的高血压动物模型。1963年,京都医学院Okamoto利用有显著高血压症状的远交Wistar Kyoto雄性鼠与带有轻微高血压症状的雌性鼠交配,自此开始兄妹交配并连续选择具有自发高血压性状的大鼠,从而培育成SHR。该大鼠自发性高血压、心血管疾病发病率高,对降压药物有反应。以SHR为模型饲喂高盐饮食可更好地研究高盐和血压与脑卒中的关系。
本研究结果中WKYs与SHRS血压、行为学表现、血脑屏障、脑血管构筑等改变均提示高盐可升高大鼠血压,对大鼠脑血管造成损伤。SHRS的损伤较WKYs明显,提示高盐可作为一个独立危险因素对大鼠血压及脑血管造成影响,高血压可加重有基础病变的脑血管损害,增加脑出血风险。高盐和高血压是大鼠脑出血的两个独立危险因素,但两者可共同增加脑出血发生概率,其原因之一为高盐可增加大鼠脑血管管壁损伤,降低脑血管应力承受力,而高血压可增加脑血管的应力,最终导致SHRS比WKYS更易出现脑出血。
有关SHR饲喂高盐饮食后脑血管构筑改变及脑出血尚少见报道。本研究中SHR饲喂高盐饮食后脑出血的特点与以往学者提出的“环状出血(ring hemorrhage)”或“点状出血”较相似,这是一种广泛存在于脑出血之中的病理改变[21]。高盐诱导SHR脑出血可能会是一种新的自发性高血压脑出血动物模型,可用于自发性高血压脑出血发生机制的研究,包括血流动力学、高盐与血脑屏障相关机制等研究。但是SHR饲喂高盐饮食诱导脑出血的研究还需进一步探讨。包括目前文献报道饲喂的盐浓度有1%、4%、6%、8%,最高8.9%,高盐形式有日本饮食、盐水、高盐低脂饲料及常规大鼠饲料加高盐等[5, 14-16, 20, 22-23],哪种形式的饲料和盐浓度最易诱发SHR出现脑出血?采用该方法出现脑出血后具体发生位置及发生率?SHR与SHRsp饲喂高盐饮食后出血量、出血部位、脑出血发生率是否有差异等。
| [1] | Mohan S, Campbell N R C. Salt and high blood pressure[J]. Clinical Science,2009, 117 (1) : 1 –11. DOI:10.1042/CS20080207 |
| [2] | Strazzullo P, D'Elia L, Kandala N B, et al. Salt intake, stroke, and cardiovascular disease: meta-analysis of prospective studies[J]. BMJ,2009, 339 : b4567 . DOI:10.1136/bmj.b4567 |
| [3] | Appel L J. Reducing Sodium Intake to Prevent Stroke: Time for Action, Not Hesitation[J]. Stroke,2014, 45 (3) : 909 –911. DOI:10.1161/STROKEAHA.113.002870 |
| [4] | 刘赟, 李敬诚, 尹延伟, 等. 激活TRPV1对自发性高血压大鼠血管平滑肌细胞增殖的影响[J]. 第三军医大学学报,2015, 37 (8) : 762 –766. DOI:10.16016/j.1000-5404.201411015 |
| [5] | Lee J M, Zhai G, Liu Q, et al. Vascular Permeability Precedes Spontaneous Intracerebral Hemorrhage in Stroke-Prone Spontaneously Hypertensive Rats[J]. Stroke,2007, 38 (12) : 3289 –3291. DOI:10.1161/STROKEAHA.107.491621 |
| [6] | Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989, 20 (1) : 84 –91. DOI:10.1161/01.STR.20.1.84 |
| [7] | Cole D J, Matsumura J S, Drummond J C, et al. Time-and pressure-dependent changes in blood-brain barrier permeability after temporary middle cerebral artery occlusion in rats[J]. Acta Neuropathol,1991, 82 (4) : 266 –273. DOI:10.1007/BF00308811 |
| [8] | 李兵, 陈祎招, 蒋伟平, 等. 脑出血后血脑屏障紧密连接蛋白occludin的表达变化[J]. 中华神经医学杂志,2012, 11 (6) : 575 –580. DOI:10.3760/cma.j.issn.1671-8925.2012.06.009 |
| [9] | 赵继宗, 周定标, 周良辅, 等. 2464例高血压脑出血外科治疗多中心单盲研究[J]. 中华医学杂志,2005 (32) : 2238 –2242. DOI:10.3760/j:issn:0376-2491.2005.32.004 |
| [10] | Go A S, Mozaffarian D, Roger V L, et al. Executive Summary: Heart Disease and Stroke Statistics--2013 Update: A Report From the American Heart Association[J]. Circulation,2013, 127 (1) : 143 –152. DOI:10.1161/CIR.0000000000000366 |
| [11] | Hatton D C, Mccarron D A. Dietary salt and hypertension[J]. Current opinion in nephrology and hypertension,1996, 5 (2) : 166 –169. DOI:10.1097/00041552-199603000-00012 |
| [12] | Mozaffarian D, Fahimi S, Singh G M, et al. Global sodium consumption and death from cardiovascular causes[J]. N Engl J Med,2014, 371 (7) : 624 –634. DOI:10.1056/NEJMoa1304127 |
| [13] | Mente A, O'Donnell M J, Rangarajan S, et al. Association of urinary sodium and potassium excretion with blood pressure[J]. N Engl J Med,2014, 371 (7) : 601 –611. DOI:10.1056/NEJMoa1311989 |
| [14] | Koga Y, Hirooka Y, Araki S, et al. High salt intake enhances blood pressure increase during development of hypertension via oxidative stress in rostral ventrolateral medulla of spontaneously hypertensive rats[J]. Hypertens Res,2008, 31 (11) : 2075 –2083. DOI:10.1291/hypres.31.2075 |
| [15] | Gao F, Han Z Q, Zhou X, et al. High salt intake accelerated cardiac remodeling in spontaneously hypertensive rats: time window of left ventricular functional transition and its relation to salt-loading doses[J]. Clin Exp Hypertens,2011, 33 (7) : 492 –499. DOI:10.3109/10641963.2010.551795 |
| [16] | Hayakawa Y, Aoyama T, Yokoyama C, et al. High salt intake damages the heart through activation of cardiac (pro) renin receptors even at an early stage of hypertension[J]. PLoS ONE,2015, 10 (3) : e120453 . DOI:10.1371/journal.pone.0120453 |
| [17] | Tomonari T, Fukuda M, Miura T, et al. Is salt intake an independent risk factor of stroke mortality? Demographic analysis by regions in Japan[J]. J Am Soc Hypertens,2011, 5 (6) : 456 –462. DOI:10.1016/j.jash.2011.07.004 |
| [18] | Gardener H, Rundek T, Wright C B, et al. Dietary Sodium and Risk of Stroke in the Northern Manhattan Study[J]. Stroke,2012, 43 (5) : 1200 –1205. DOI:10.1161/STROKEAHA.111.641043 |
| [19] | He F J, Pombo-Rodrigues S, Macgregor G A. Salt reduction in England from 2003 to 2011: its relationship to blood pressure, stroke and ischaemic heart disease mortality[J]. BMJ Open,2014, 4 (4) : e4549 . DOI:10.1136/bmjopen-2013-004549 |
| [20] | Bailey E L, Wardlaw J M, Graham D, et al. Cerebral small vessel endothelial structural changes predate hypertension in stroke-prone spontaneously hypertensive rats: a blinded, controlled immunohistochemical study of 5-to 21-week-old rats[J]. Neuropathol Appl Neurobiol,2011, 37 (7) : 711 –726. DOI:10.1111/j.1365-2990.2011.01170.x |
| [21] | 吕田明, 陆兵勋, 尹恝, 等. 脑出血血肿形成过程中的管涌现象[J]. 中华老年心脑血管病杂志,2007, 9 (7) : 489 –491. DOI:10.3969/j.issn.1009-0126.2007.07.017 |
| [22] | Groholm T, Finckenberg P, Palojoki E, et al. Cardioprotective effects of vasopeptidase inhibition vs. angiotensin type 1-receptor blockade in spontaneously hypertensive rats on a high salt diet[J]. Hypertens Res,2004, 27 (8) : 609 –618. DOI:10.1291/hypres.27.609 |
| [23] | Wang H, D'Ambrosio M A, Garvin J L, et al. Connecting Tubule Glomerular Feedback in Hypertension[J]. Hypertension,2013, 62 (4) : 738 –745. DOI:10.1161/HYPERTENSIONAHA.113.01846 |



