类风湿性关节炎(rheumatoid arthritis,RA)的主要病理特征为滑膜炎症、滑膜增生、新生血管生成和软骨组织破坏。其中滑膜细胞增生在RA的发生发展中起重要作用。如何有效抑制滑膜细胞的增殖及促进其凋亡是治疗RA的关键。研究报道二甲双胍具有全身性抗炎的作用,可有效保护类风湿性关节炎,但具体机制尚不明确[1]。本研究观察二甲双胍对体外培养的滑膜细胞的增殖、凋亡,以及上清分泌的炎性因子[包括肿瘤坏死因子α(tumor necrosis factor,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)及抗炎因子白细胞介素-10(interleukin-10,IL-10)]水平的影响,探讨二甲双胍对RA的保护机制,以期为临床上RA的治疗提供一定的理论依据。
1 材料与方法 1.1 组织来源人关节滑膜组织取自12例在本院四肢关节外科行膝关节置换术的RA患者,年龄(49±6)岁,以及5例正常外伤后行滑膜切除术的患者,年龄(45±6)岁。RA患者的诊断根据美国风湿病协会(American College of Rheumatology,ACR)修订的分类标准(1987版)进行。滑膜细胞的分离培养方法见1.3.1。
1.2 主要材料二甲双胍(Sigma公司),DMEM培养基(HyClone公司),胎牛血清、胰酶(Gibco公司),青-链霉素、DAPI核染料、抗荧光淬灭封片剂(Beyotime公司),流式细胞周期检测试剂盒(BD公司),TUNEL细胞凋亡检测试剂盒(Roche公司),Ki67抗体(Abcam公司),荧光二抗(Invitrogen公司),ELISA检测试剂盒(MultiScience)。流式细胞仪(Accuri公司),倒置荧光显微镜(Nikon公司),CO2细胞培养箱(Heal Force),全自动酶标仪(Thermo Multiskan)。
1.3 方法 1.3.1 人滑膜细胞体外分离培养无菌取滑膜组织置于冰上,PBS缓冲液漂洗3遍去血渍,于平皿中将组织块剪至1 mm3小块,加入0.15%胰蛋白酶连续消化3次,每次2 min,消化的细胞悬液转移至带血清的离心管中终止消化,加入0.08%Ⅱ型胶原酶37 ℃继续消化30 min。合并消化液后过筛,将细胞悬液置于10 mL离心管,1 000 r/min离心5 min,弃上清,用含有10%胎牛血清的DMEM培养基吹打成细胞悬液,置于37 ℃,5% CO2培养箱中培养,隔天换液。待细胞长至80%的融合度时,用0.25%胰蛋白酶消化传代培养,至第3代时开始实验(图 1)。

|
| 图 1 分离培养的第3代人滑膜细胞(×200) |
1.3.2 CCK-8法检测滑膜细胞增殖
制备细胞悬液并以2 000/孔接种至96孔板,摇匀,于37 ℃培养箱中培养2~4 h至细胞贴壁,用10、20、30 mmol/L二甲双胍干预。对照组同样加入等量PBS,24、48、72 h后分别每孔加入10 μL CCK-8反应液,摇匀,放入培养箱中培养2 h后用酶标仪检测其450 nm吸光度值[D(450)]。
1.3.3 流式细胞术检测滑膜细胞周期生长至第3~5代的细胞以6×105/孔接种至6孔板,待细胞融合率约75%时,用30 mmol/L二甲双胍处理。对照组用等量PBS处理。48 h后用胰酶消化成单细胞悬液,PBS清洗一遍,1 000 r/min离心5 min,加入100 μL PI-RNase A室温孵育15 min,避光,流式细胞仪检测分析比较细胞周期各时期的DAN含量差异。
1.3.4 流式细胞术检测滑膜细胞凋亡生长至第3~5代的细胞以6×105/孔接种至6孔板,待细胞融合率约75%时,用20 mmol/L二甲双胍处理。对照组用等量PBS处理。48 h后用胰酶消化成单细胞悬液,PBS清洗一遍,1 000 r/min离心5 min,每组分别加入100 μL 1× binding buffer重悬细胞,按顺序分别加入5 μL Annexin V与5 μL PI,混匀,室温避光15 min,流式检测细胞凋亡。
1.3.5 TUNEL法检测滑膜细胞凋亡将细胞以1.2×105/孔接种至铺有细胞爬片的12孔板,培养4 h后分为对照组和二甲双胍组,干预36 h,弃去培养基,固定,PBS清洗3遍,打孔15 min,分别进行TUNEL染色,显微镜下观察染色结果。
1.3.6 ELISA法检测细胞培养液上清中的炎性因子取生长状态良好的滑膜细胞,按6×105/孔接种于6孔板,于CO2培养箱中培养,4 h后分为对照组、炎症诱导组、二甲双胍组,每组6个孔,分别用PBS、类风湿关节炎诱导乳剂,以及10、20、30 mmol/L二甲双胍处理,48 h后收集上清。ELISA法分别检测上清中TNF-α、IL-6、IL-1β、IL-10的水平。
1.4 统计学处理采用SPSS 16.0统计软件,计量资料数据以x±s表示,进行单因素方差分析及t检验,以P < 0.05为差异有统计学意义。
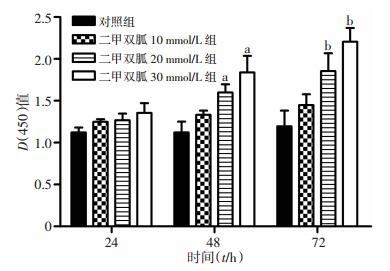
2 结果 2.1 二甲双胍对滑膜细胞增殖的影响CCK-8检测显示,10、20、30 mmol/L二甲双胍对人滑膜细胞的增殖具有抑制作用,且呈时间与浓度依赖性,其中20、30 mmol/L二甲双胍处理48、72 h后,与对照组相比,其抑制作用差异有统计学意义(P < 0.05,图 2)。
|
| a:P < 0.05, 与处理48 h的对照组相比;b:P < 0.05, 与处理72 h的对照组相比 图 2 CCK-8法检测二甲双胍对滑膜细胞增殖的影响 |
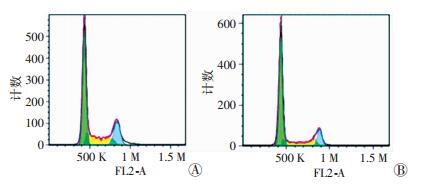
流式细胞术检测显示,与对照组相比,20 mmol/L二甲双胍处理48 h显著抑制了滑膜细胞的增殖(图 3),G0/G1期滑膜细胞的百分比显著增加约20%,S期和G2/M期细胞比例分别显著下降9%和11%(表 1)。
|
| A:对照组;B:二甲双胍处理组 图 3 流式细胞术检测人滑膜细胞增殖 |
| 组别 | G0/G1期 | S期 | G2/M期 |
| 对照组 | 56.81±3.41 | 28.16±1.64 | 17.13±2.33 |
| 二甲双胍组 | 76.16±2.09a | 19.77±2.64a | 6.44±2.11a |
| a:P < 0.05, 与对照组相比 | |||
2.2 二甲双胍对滑膜细胞凋亡的影响
10、20、30 mmol/L二甲双胍处理滑膜细胞后,TUNEL染色发现,与对照组细胞凋亡率相比[(0.37±0.05)%],10 mmol/L二甲双胍处理对滑膜细胞的凋亡影响差异无统计学意义[(1.97±0.03)%,P>0.05],但20、30 mmol/L二甲双胍处理显著促进了滑膜细胞的凋亡[(12.64±0.10)%、(15.80%±0.41)%,P < 0.05]。
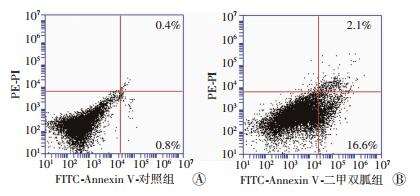
流式细胞术检测滑膜细胞凋亡结果如图 4所示,20 mmol/L的二甲双胍处理细胞48 h后,可以显著诱导滑膜细胞的凋亡,其中早期和晚期的滑膜细胞凋亡率约17.5%,与对照组比较差异有统计学意义(P < 0.05)。
|
| A:对照组;B:二甲双胍处理组 图 4 流式细胞术检测二甲双胍对人滑膜细胞凋亡的影响 |
2.3 ELISA法检测人滑膜细胞上清中的炎症因子及抗炎因子含量
ELISA检测(图 5)显示,对照组炎性因子IL-6、IL-1β、TNF-α及抗炎因子IL-10含量均在正常范围内。诱导组炎性因子含量显著升高,抗炎因子含量降低。在此基础上,10、20、30 mmol/L二甲双胍处理,与诱导组相比降低了炎症因子IL-6、IL-1β和TNF-α的表达水平,其中20、30 mmol/L二甲双胍处理后表达差异有统计学意义(P < 0.05)。20、30 mmol/L二甲双胍处理后,与诱导组相比,IL-6水平分别降低约52%和63%,IL-1β和TNF-α则分别降低约39%、55%和25%、44%,抗炎因子IL-10显著增加约66%和76%。

|
| A: IL-6; B: TNF-α; C: IL-10; D: IL-1β 1:对照组;2:诱导组;3~5:分别为二甲双胍10、20、30 mmol/L组; a:P < 0.05, 与相应指标中的诱导组相比 图 5 ELISA法检测二甲双胍对人滑膜细胞上清中炎性因子及抗炎因子含量的影响 |
3 讨论
RA的病理特征表现为滑膜增生、新生血管翳生成以及炎性细胞的渗透等[2]。其中滑膜组织增生主要由成纤维样滑膜细胞的过度增生导致,并且在RA的发病机制中起着至关重要的作用。与癌细胞相似,成纤维样滑膜细胞同样具有异常增殖与凋亡的特性,这种特性可致使滑膜肥厚,侵入性血管翳组织形成,最终导致关节的破坏[3]。因此,如何有效抑制滑膜细胞的增殖和介导成纤维样滑膜细胞的凋亡是RA的潜在治疗策略。
二甲双胍是治疗二型糖尿病比较广泛的规定用药,主要通过抑制肝糖原异生,增强肌肉葡萄糖摄取及抑制小肠对葡萄糖的吸收等降血糖[4-6]。研究表明二甲双胍还具有降血脂的作用,主要是减少血液中游离脂肪酸、甘油三酯及极低密度脂蛋白的含量[5]。二甲双胍的主要分子靶点是通过激活AMPK[Adenosine 5’-monophosphate(AMP)-activated protein kinase]信号通路和上述抗糖尿病的作用改善胰岛素的敏感性[7-9]。此外研究报道二甲双胍同样可以作为治疗炎症相关疾病的潜在用药[10-13]。二甲双胍的抗炎机制目前还不明确。本研究观察二甲双胍对滑膜细胞增殖与凋亡的影响,以及滑膜细胞相关炎性因子及抗炎因子的表达,探讨二甲双胍对类风湿性关节炎的作用机制。
TNF-α生物作用广泛,可影响细胞增殖、凋亡、分化及免疫反应[14]。TNF-α可刺激免疫细胞、激活炎性反应抵抗感染,但同样可以介导脓毒性休克、类风湿性关节炎与肿瘤[15-16]。TNF-α的促炎作用目前研究比较深入。研究报道TNF-α对细胞的增殖与凋亡也有一定的影响,鉴于组织特异性,对免疫细胞表现为促增殖作用,对多数的肿瘤细胞则具有一定的促凋亡作用[17]。TNF-α对RA的滑膜细胞,则起到促进其增殖的作用[18]。本研究发现,二甲双胍处理诱导滑膜细胞可显著降低TNF-α的表达,同时有效抑制滑膜细胞的增生,促进滑膜细胞的凋亡。IL-1β、IL-6等也是滑膜细胞在炎症反应中分泌的炎性因子,20、30 mmol/L二甲双胍处理同样显著降低了这些炎性因子的含量,抑制了滑膜细胞的增殖。IL-10是炎症反应中的负性调节因子,可起到抵抗炎性介质的作用。研究表明在给予RA IL-10治疗后能明显抑制炎症的发生[19]。本研究发现,10、20、30 mmol/L二甲双胍处理人滑膜细胞后,其上清中IL-10含量显著升高,表明二甲双胍显著增加滑膜细胞上清中IL-10的含量,从而有效抑制滑膜细胞的增殖,促进滑膜细胞的凋亡。
综上所述,本研究提示二甲双胍可通过明显降低炎性因子IL-6、IL-1β、TNF-α水平,以及增加抗炎因子IL-10水平显著抑制滑膜细胞的增殖和促进其凋亡。
| [1] | Hyun B, Shin S, Lee A, et al. Metformin Down-regulates TNF-alpha Secretion via Suppression of Scavenger Receptors in Macrophages[J]. Immune Netw,2013, 1 (13) : 123 –132. DOI:10.4110/in.2013.13.4.123 |
| [2] | Svensson B, Andersson M, Forslind K, et al. Persistently active disease is common in patients with rheumatoid arthritis, particularly in women: a long-term inception cohort study[J]. Scand J Rheumatol,2016, 4 (20) : 1 –8. DOI:10.3109/03009742.2016.1147595 |
| [3] | Ma Z, Wang B, Wang M, et al. TL1A increased IL-6 production on fibroblast-like synoviocytes by preferentially activating TNF receptor 2 in rheumatoid arthritis[J]. Cytokine,2016, 12 (83) : 92 –98. DOI:10.1016/j.cyto.2016.04.005 |
| [4] | Mostafa D K, Ismail C A, Ghareeb D A. Differential metformin dose-dependent effects on cognition in rats: role of Akt[J]. Psychopharmacology (Berl),2016, 4 (25) : 12 –19. DOI:10.1007/s00213-016-4301-2 |
| [5] | Wise J. Metformin is backed as first line therapy for type 2 diabetes[J]. BMJ,2016, 4 (19) : 2231 –2236. DOI:10.1136/bmj.i2236 |
| [6] | Muscelli E, Astiarraga B, Barsotti E, et al. Metabolic consequences of acute and chronic empagliflozin administration in treatment-naive andmetformin pretreated patients with type 2 diabetes[J]. Diabetologia,2016, 59 (4) : 700 –708. DOI:10.1007/s00125-015-3845-8 |
| [7] | Jiang Y, Huang W, Wang J, et al. Metformin plays a dual role in MIN6 pancreatic beta cell function through AMPK-dependent autophagy[J]. Int J Biol Sci,2014, 10 (31) : 268 –277. DOI:10.7150/ijbs.7929 |
| [8] | Yang Z, Chen X, Chen Y. PGC-1 mediates the regulation of metformin in muscle irisin expression and function[J]. Am J Transl Res,2015, 7 (10) : 1850 –1859. |
| [9] | Lee S K, Lee J O, Kim J H, et al. Metformin sensitizes insulin signaling through AMPK-mediated PTEN down-regulation in preadipocyte 3T3-L1 cells[J]. J Cell Biochem,2011, 12 (35) : 1259 –1267. DOI:10.1002/jcb.23000 |
| [10] | Liu Y, Tang G, Li Y, Wang Y, et al. Metformin attenuates blood-brain barrier disruption in mice following middle cerebral artery occlusion[J]. J Neuroinflammation,2014, 10 (15) : 171 –177. DOI:10.1186/s12974-014-0177-4 |
| [11] | Tsoyi K, Jang H J, Nizamutdinova I T, et al. Metformin inhibits HMGB1 release in LPS-treated RAW 264.7 cells and increases survival rate of endotoxaemic mice[J]. Br J Pharmacol,2011, 3 (162) : 1498 –1508. DOI:10.1111/j.1476-5381.2010.01126.x |
| [12] | Kalariya N M, Shoeb M, Ansari N H, et al. Antidiabetic drug metformin suppresses endotoxin-induced uveitis in rats[J]. Invest Ophthalmol Vis Sci,2012, 11 (53) : 3431 –3440. DOI:10.1167/iovs.12-9432 |
| [13] | Yuan H, Li L, Zheng W, et al. Antidiabetic drug metformin alleviates endotoxin-induced fulminant liver injury in mice[J]. Int Immunopharmacol,2012, 12 (53) : 682 –688. DOI:10.1016/j.intimp.2012.01.015 |
| [14] | Girven M, Dugdale H F, Owens D J, et al. 1-glutamine Improves Skeletal Muscle Cell Differentiation and Prevents Myotube Atrophy After Cytokine (TNF-α) Stress via Reduced p38 MAPK Signal Transduction[J]. J Cell Physiol,2016, 231 (12) : 2720 –2732. DOI:10.1002/jcp.25380.DOI:10.1002/jcp.25380 |
| [15] | Gomes A F, Magalhäes K G, Rodrigues R M, et al. Toxoplasma gondii-skeletal muscle cells interaction increases lipid droplet biogenesis and positively modulates the production of IL-12, IFN-g and PGE2[J]. Parasites & Vectors,2014, 7 (1) : 47 . DOI:10.1186/1756-3305-7-47 |
| [16] | Song Z H, Li Z Y, Li D D, et al. Seminal plasma induces inflammation in the uterus through the γδ T/IL-17 pathway[J]. Sci Rep,2016, 6 : 25118 . DOI:10.1038/srep25118 |
| [17] | 安家印, 周政, 刘俊, 等. Rock信号通路参与TNF-α刺激兔基底动脉平滑肌增殖[J]. 第三军医大学学报,2013, 35 (18) : 1952 –1956. DOI:10.16016/j.1000-5404.2013.18.015 |
| [18] | Kim H B, Lee S W, Mun C H, et al. O-linked N-acetylglucosamine glycosylation of p65 aggravated the inflammation in both fibroblast-like synoviocytes stimulated by tumor necrosis factor-α and mice with collagen induced arthritis[J]. Arthritis Res Ther,2015, 17 : 248 . DOI:10.1186/s13075-015-0762-7 |
| [19] | Atta D S, Girbash E F, Abdelwahab S M, et al. Maternal cytokines and disease severity influence pregnancy outcomes in women with rheumatoid arthritis[J]. J Matern Fetal Neonatal Med,2016, 29 (20) : 3358 –3363. DOI:10.3109/14767058.2015.1127342 |



