神经病理性疼痛是一种由神经压迫、癌症、糖尿病等其他多种疾病引起的神经损伤,常表现为痛觉过敏、自发性疼痛等症状[1]。神经病理性疼痛的发病过程受K+、Ca2+离子通道及炎性细胞因子的调节,同时涉及神经元损伤、中枢敏化、胶质细胞活化等病理生理学改变[2]。其发病机制极为复杂,临床治疗效果不尽人意。细胞自噬是真核细胞中一种保守的细胞学行为,对于细胞形态结构及功能的维持具有重要调控作用[3]。研究[4]表明,细胞自噬功能的紊乱与神经病理性疼痛的发生存在关系,然而其具体机制尚不明确。Rap1a是Ras肿瘤基因家族成员之一。研究表明Rap1a分子与神经系统功能及神经退行性变化等疾病的发生存在关系[5]。本实验以L5脊神经结扎(SNL)大鼠模型及分离培养的星形胶质细胞为对象,分析Ras肿瘤基因家族成员Rap1a在神经病理性疼痛大鼠脊髓组织中的表达水平,分析Rap1a对星形胶质细胞自噬和SNL大鼠机械痛阈的影响,以期为解析神经病理性疼痛的发病机制提供依据。
1 材料与方法 1.1 主要试剂兔源Rap1a、mTOR、磷酸化mTOR(S2481)、β-actin一抗及羊源二抗(HRP)均购自北京博奥森生物技术有限公司,鼠源LC3-Ⅱ、LC3-Ⅰ为英国VIVA Bioscience公司产品,兔源p62为美国Santa Cruz公司产品,腺病毒载体pAd/PL-Dest购自Invitrogen公司。
1.2 实验动物与分组60只雄性成年SD(Sprague-Dawley)大鼠,体质量(300±20)g,购自第四军医大学实验动物中心。分为假手术组(n=6)、SNL模型组(n=30)、生理盐水组(n=6)、Cont-shR组(n=6)、Rap1a-shR组(n=6)、雷帕霉素组(n=6)。造模前于大鼠L4、L5脊椎间隙行鞘内注射。生理盐水组、Cont-shR组、Rap1a-shR组分别注射生理盐水、Cont-shR腺病毒、Rap1a shRNA腺病毒,注射剂量均为25 μL/次,1次/d,连续注射7 d后进行造模及后续检测。雷帕霉素组鞘内注射自噬诱导剂雷帕霉素(0.5 μg/μL),注射剂量100 μL/次,1次/d,连续注射7 d,检测细胞自噬对SNL大鼠机械痛阈的影响。
1.3 方法 1.3.1 SNL大鼠模型制备参照Shi等[6]的方法,采用L5脊神经结扎法制备神经疼痛大鼠模型。3%戊巴比妥钠腹腔注射麻醉大鼠,沿背部右侧剪开皮肤,将肌肉分离,咬开L5横突,暴露L5脊神经,用丝线结扎脊神经,缝合切口。假手术组不结扎脊神经,其余操作同手术组。
1.3.2 机械痛阈检测参照高润兴等[7]的方法于造模前1 d测大鼠痛阈基础值,造模后第1、3、7、10、14天测大鼠痛阈值。大鼠自适应环境15~30 min至安静后,将Von-Frey纤维丝置于大鼠右后足掌心处,从0×g开始缓慢增加力度,以恒定速度刺激大鼠足部,至大鼠出现抬腿或缩足反应时,记录阈值。分别测定5次,取平均值记为大鼠机械痛阈值。
1.3.3 RT-PCR检测分离处理后的大鼠脊髓组织或细胞,Trizol法提取总RNA后反转录出cDNA,行实时定量PCR检测。反应程序:94 ℃,50 s;54 ℃,50 s;72 ℃,50 s;72 ℃,10 min,30个循环。检测结果以GAPDH为内参,采用2-ΔΔCT法计算mRNA相对表达量。
1.3.4 Western blot检测分离处理后的大鼠脊髓组织或细胞,SDS裂解法提取组织或细胞中总蛋白,测定蛋白浓度后,各取60 μg蛋白经由SDS-PAGE电泳分离并转至PVDF膜。加3%脱脂奶粉封闭,加入1 :1 000稀释的一抗4 ℃过夜,TBST洗膜,加入1 :5 000稀释的二抗室温孵育1 h,经ECL显色曝光,灰度分析条带密度,β-actin为内参,计算蛋白表达水平。通过Western blot检测自噬标志分子LC3 II/LC3 I、p62蛋白的水平变化,反应细胞在不同状态下的自噬水平。
1.3.5 脊髓星形胶质细胞的分离与培养参照杨镭镭等[8]的方法进行。取SNL造模7 d后的大鼠,于无菌条件下分离出脊髓组织,置于预冷的DMEM/F12培养液,剪碎并用胰蛋白酶液消化,细胞悬液离心后加入含血清的正常培养液,105/mL接种于培养瓶,37 ℃恒温培养箱培养。后经阿糖胞苷(Ara-C)处理及差速贴壁,获得纯化的胶质细胞。
1.3.6 腺病毒载体构建及感染参照李钢等[9]的方法进行。以Rap1a基因序列为模板,设计合成Rap1a shRNA及阴性对照序列(Cont-shR),将shRNA序列亚克隆至pAd/PL-Dest腺病毒载体中,经测序验证后,转染至HEK293细胞中包装腺病毒颗粒,获得含pAd/shRap1a及pAd/shCont的腺病毒,经TCID50法测定病毒滴度后,用于SNL大鼠鞘内注射及胶质细胞的感染实验。
1.4 统计学分析采用SPSS 16.0统计软件,计量资料数据以x±s表示,组间比较采用t检验或单因素方差分析,以P < 0.05表示差异有统计学意义。
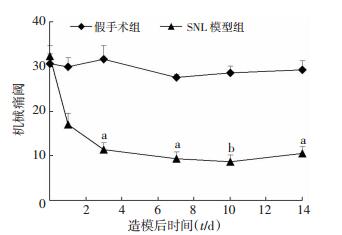
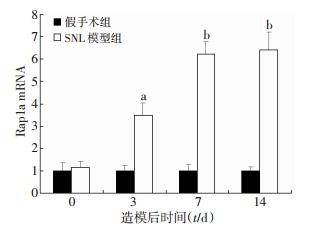
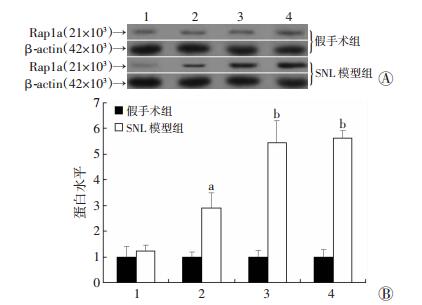
2 结果 2.1 SNL大鼠脊髓组织中Rap1a表达水平的测定与假手术组相比,SNL大鼠术后机械痛阈明显降低,持续至14 d(图 1)。而SNL大鼠脊髓组织中Rap1a mRNA和蛋白表达水平均出现上升,术后第3天增加显著(P < 0.05),并持续至14 d(图 2、3)。
|
| a:P < 0.05,b:P < 0.01,与假手术组比较 图 1 Von-Frey纤维丝法检测2组大鼠机械痛阈值随造模时间的变化 |
|
| a:P < 0.05,b:P < 0.01,与假手术组比较 图 2 定量PCR检测造模后不同时间2组大鼠脊髓组织中Rap1a mRNA表达 |
|
| 1~4:分别为造模后0、3、7、14 d;A:Western blot检测;B:半定量分析a:P < 0.05,b:P < 0.01,与假手术组比较 图 3 Western blot检测造模后不同时间2组大鼠脊髓组织中Rap1a基因表达 |
2.2 Rap1a对SNL大鼠机械痛阈的影响
Rap1a shRNA腺病毒感染后,SNL术后第7天,大鼠脊髓组织中Rap1a的表达水平(1.96±0.59)较生理盐水组(6.24±0.54)及Cont-shR组(6.02±0.67)显著降低(P < 0.05);大鼠机械痛阈(7 d)则明显升高(依次为29.00±3.39、13.20±1.48、14.20±2.16,P < 0.05)。
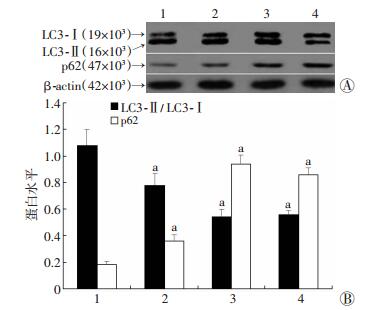
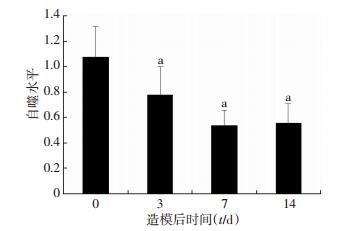
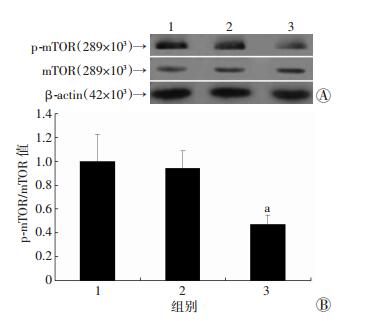
2.3 Rap1a对SNL大鼠脊髓组织中细胞自噬水平的影响SNL术后,大鼠脊髓组织中细胞自噬标志分子LC3-Ⅱ/LC3-Ⅰ值逐步降低,p62表达水平升高,表明细胞自噬水平降低(P < 0.05,图 4、5)。与生理盐水组及Cont-shR组相比,Rap1a shRNA腺病毒感染后,SNL术后第7天,大鼠脊髓组织细胞自噬水平增加(依次为0.52±0.13、0.49±0.08、0.90±0.17),且mTOR活化水平降低(P < 0.05,图 6)。
|
| 1~4:分别为造模后0、3、7、14 d; A:Western blot检测;B:半定量分析a:P < 0.05,与0 d比较 图 4 Western blot检测造模后不同时间大鼠脊髓组织中LC3-Ⅱ/LC3-Ⅰ与p62蛋白表达 |
|
| a:P < 0.05,与0 d比较 图 5 Western blot检测造模后不同时间大鼠脊髓组织自噬水平 |
|
| 1:生理盐水组;2:Cont-shR组;3:Rap1a-shR组A:Western blot检测;B:半定量分析a:P < 0.05,与生理盐水组及Cont-shR组比较 图 6 Western blot检测造模后7 d各组大鼠脊髓组织中p-mTOR/mTOR表达 |
2.4 Rap1a对星形胶质细胞自噬的影响
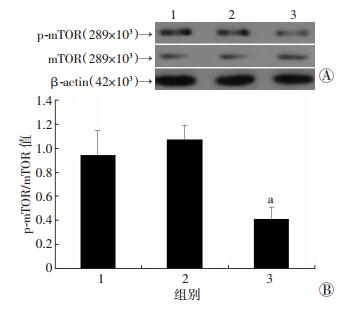
与生理盐水组及Cont-shR组相比,Rap1a shRNA腺病毒感染后,大鼠分离获得的星形胶质细胞中细胞自噬水平增加(分别为0.32±0.14、0.35±0.10、0.80±0.12),且mTOR活化水平降低(P < 0.05,图 7)。
|
| 1:生理盐水组;2:Cont-shR组;3:Rap1a-shR组A:Western blot检测;B:半定量分析a:P < 0.05,与生理盐水组及Cont-shR组比较 图 7 Western blot检测处理2 d后各组大鼠星形胶质细胞中p-mTOR/mTOR的表达 |
2.5 星形胶质细胞自噬对SNL大鼠机械痛阈的影响
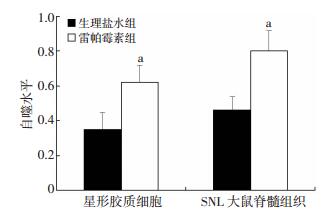
细胞自噬诱导剂雷帕霉素(0.5 μg/μL)作用后,星形胶质细胞(2 d)及SNL大鼠脊髓组织(7 d)细胞自噬水平均明显增加(P < 0.05,图 8);SNL大鼠的机械痛阈(7 d)(33.20±4.43)较生理盐水对照组(13.20±1.48)显著升高(P < 0.05)。
|
| a:P < 0.05,与生理盐水组比较 图 8 Western blot检测2组星形胶质细胞(2 d)及SNL大鼠脊髓组织(7 d)自噬水平 |
3 讨论
本研究以SNL大鼠模型及分离培养的星形胶质细胞为对象,分析Ras肿瘤基因家族成员Rap1a在神经病理性疼痛大鼠脊髓组织中的表达及作用。Rap1a是Ras家族成员之一,可作为分子开关调节下游MAPKs相关信号通路,进而调控不同靶分子表达及细胞功能的变化,参与肿瘤等疾病的发生过程。已有研究表明,Rap1a分子也与神经系统功能及神经退行性变化等疾病的发生有关[5]。Li等[10]报道Rap1a作为miR-203的下游直接靶基因,受miR-203的抑制作用;在慢性神经压迫损伤模型大鼠的脊髓背角神经节中,miR-203的表达水平下调,而Rap1a则被过量表达。Rap1a还可通过对MEK/ERK通路产生调控而参与外周神经敏感化过程。本实验发现在SNL模型大鼠脊髓组织中,Rap1a的表达水平显著上调,且Rap1a的高表达与SNL大鼠机械痛阈的变化存在联系,而抑制Rap1a表达可有效改善模型大鼠的疼痛症状。证实Rap1a分子表达的失调还与神经病理性疼痛的发病机制密切相关。
细胞自噬是真核细胞中一种依赖溶酶体的清除途径,可降解胞内的蛋白质聚集体及受损的细胞器,对于细胞形态结构及功能的维持具有重要调控作用[11-12]。细胞自噬与神经退行性疾病的关系已多有报道。神经类疾病的发生多伴有神经元及其他神经细胞中蛋白质的异常聚集,细胞自噬过程可有效清除这些异常的蛋白质聚集体,使受损的神经细胞继续行使正常功能,防止疾病的发生[13-14]。研究发现,在神经病理性疼痛发病过程中,细胞自噬功能的紊乱对于神经疼痛的加剧具有促进作用,而特异性的激活细胞自噬功能则可缓解神经疼痛症状[6, 15]。本研究发现,SNL大鼠脊髓组织中Rap1a高表达与自噬水平呈反向关系,高表达的Rap1a能激活mTOR通路,引起细胞自噬水平发生下降;而抑制Rap1a后,mTOR通路活性降低,细胞自噬水平增加,相应的大鼠神经疼痛症状也得到明显改善。我们推测,Rap1a分子对大鼠神经病理性疼痛的影响可能与其对脊髓组织细胞自噬的抑制作用有关。
神经胶质细胞是神经系统中一类提供营养和支撑作用的重要细胞。近年来,胶质细胞在神经病理性疼痛中的作用也逐渐被人们认识。周围神经、腰脊神经的结扎、横断等创伤均能刺激胶质细胞激活,激活的胶质细胞可分泌ROS、NO、前列腺素、神经生长因子等一系列神经活性物质以及TNF和白介素等多种炎性因子,促使神经元处于敏化状态[16]。而通过米诺环素、氟柠檬酸等药物阻断神经胶质细胞的活化,可有效抑制神经活性物质的释放,缓解神经病理性疼痛症状[17]。本研究通过SNL大鼠体内外实验证实,Rap1a可激活星形胶质细胞内mTOR信号通路,抑制星形胶质细胞自噬的发生。推测其对星形胶质细胞自噬的影响可能参与了大鼠神经病理性疼痛的发病过程。
值得注意的是,胶质细胞包含星形胶质细胞、少突胶质细胞、小胶质细胞等多种类型,而不同类型的胶质细胞在神经疼痛病理过程中发挥的作用不尽相同。其中,小胶质细胞的活化多出现在疼痛起始阶段,而激活的星形胶质细胞则主要参与疼痛的发展和维持阶段。本研究仅在体外条件下分析了Rap1a对星形胶质细胞自噬的影响,而对于星形胶质细胞及其他类型胶质细胞自噬活性在神经病理性疼痛中的作用还需要进一步的综合分析验证。
综上所述,本研究证实了神经损伤引起的Rap1a高表达对于神经病理性疼痛的发展具有促进作用,而这一过程可能与Rap1a对mTOR信号通路及星形胶质细胞自噬水平的调节有关。
| [1] | Zimmermann M. Pathobiology of neuropathic pain[J]. Eur J Pharmacol,2001, 429 (1-3) : 23 –37. DOI:10.1016/S0014-2999(01)01303-6 |
| [2] | 伍磊, 林洪, 沙漠, 等. 神经病理性疼痛的发病机制研究进展[J]. 中国临床神经外科杂志,2014, 19 (3) : 186 –188. |
| [3] | Dunlop E A, Tee A R. mTOR and autophagy: a dynamic relationship governed by nutrients and energy[J]. Semin Cell Dev Biol,2014, 36 : 121 –129. DOI:10.1016/j.semcdb.2014.08.006 |
| [4] | 杨湘怡, 陶润知, 聂亚雄. mTOR依赖的自噬通路与神经变性疾病[J]. 中南医学科学杂志,2014, 42 (2) : 191 –195. |
| [5] | Jacqueline S, Alena B, Nekeisha N, et al. The Ras-related protein, Rap1A, mediates thrombin-stimulated, integrin-dependent glioblastoma cell proliferation and tumor growth[J]. J Biol Chem,2014, 289 (25) : 17689 –17698. DOI:10.1074/jbc.M113.536227 |
| [6] | Shi G, Shi J, Liu K, et al. Increased miR-195 aggravates neuropathic pain by inhibiting autophagy following peripheral nerve injury[J]. Glia,2013, 61 (4) : 504 –512. DOI:10.1002/glia.22451 |
| [7] | 高润兴, 王汉兵, 仲吉英, 等. 鞘内注射TRESK基因重组腺病毒对坐骨神经分支选择性损伤大鼠的镇痛作用[J]. 临床和实验医学杂志,2014, 13 (23) : 1929 –1932. |
| [8] | 杨镭镭, 王清秀, 彭成为, 等. 大鼠脊髓星形胶质细胞的分离与纯化[J]. 解剖学杂志,2008, 31 (2) : 207 –209. |
| [9] | 李钢, 冯彪, 邓彦超, 等. HPV18 E6、E7基因-shRNA重组腺病毒表达载体的构建及鉴定[J]. 世界华人消化杂志,2014, 22 (24) : 3608 –3612. |
| [10] | Li H, Huang Y, Ma C, et al. MiR-203 involves in neuropathic pain development and represses Rap1a expression in nerve growth factor differentiated neuronal PC12 cells[J]. Clin J Pain,2015, 31 (1) : 36 –43. DOI:10.1097/AJP.0000000000000070 |
| [11] | Maiese K. Targeting molecules to medicine with mTOR, autophagy, and neurodegenerative disorders[J]. Br J Clin Pharmacol,2016, 82 (5) : 1245 –1266. DOI:10.1111/bcp.12804 |
| [12] | 许梦雪, 秦新月, 冯金洲, 等. 自噬在实验性自身免疫性脑脊髓炎小鼠中的抗炎作用[J]. 第三军医大学学报,2015, 37 (16) : 1624 –1628. DOI:10.16016/j.1000-5404.201411248 |
| [13] | Jung K T, Lim K J. Autophagy: Can It be a New Experimental Research Method of Neuropathic Pain?[J]. Korean J Pain,2015, 28 (4) : 229 –230. DOI:10.3344/kjp.2015.28.4.229 |
| [14] | 秦利燕, 戴旭芳. 雷帕霉素对自闭症大鼠病症行为的改善作用[J]. 第三军医大学学报,2015, 37 (5) : 420 –424. DOI:10.16016/j.1000-5404.201409094 |
| [15] | Guo J S, Jing P B, Wang J A, et al. Increased autophagic activity in dorsal root ganglion attenuates neuropathic pain following peripheral nerve injury[J]. Neurosci Lett,2015, 599 : 158 –163. DOI:10.1016/j.neulet.2015.05.046 |
| [16] | 赵喆, 何文娟, 温惠中, 等. 脊髓背角P2X7受体激活引起神经病理性疼痛的发生[J]. 第三军医大学学报,2014, 36 (9) : 897 –901. |
| [17] | 邹晓琴, 黄诚. 胶质细胞在神经病理性痛中的作用[J]. 赣南医学院学报,2013, 33 (1) : 144 –146. |



