2. 400016 重庆,重庆医科大学:基础医学院病理科
2. Department of Pathology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
根据肿瘤组织学类型分类的“二元论”,Ⅰ型卵巢癌包括低级别浆液性癌、低级别子宫内膜样癌、透明细胞癌、黏液性癌和移行细胞癌;Ⅱ型则包括高级别浆液性癌、高级别子宫内膜样癌、未分化癌及癌肉瘤[1-2]。临床总结发现:Ⅰ型卵巢癌患者多数较年轻,表现为单侧膨胀性生长的包块[3],诊断时多为早期,但仍有部分患者表现为浸润性生长导致病灶无法完整切除。由于其对目前一线化疗用药的天然抵抗,肿瘤呈浸润性生长或复发的Ⅰ型卵巢癌患者的预后甚至较侵袭力更强的Ⅱ型卵巢癌更差。
Wnt信号的异常激活与卵巢癌发生的关系已被报道[4],但机制不明。b-环连蛋白抑制基因1(dapper antagonist of catenin-1,DACT1),位于14号染色体q22.3,编码一种由836个氨基酸残基组成的蛋白质。DACT1作为Wnt信号通路中的关键调节子散乱蛋白(dishevelled-1, Dvl)的直接互作蛋白,可通过拮抗Dvl的作用调节经典和非经典Wnt信号通路,并调控非洲爪蟾蜍的胚胎发育[5-6]。DACT1与Dvl结合并通过溶酶体依赖途径诱导其降解,继而抑制经典和非经典Wnt信号通路活性[6]。目前发现DACT1在多种肿瘤中发挥着不同的功能:在肝细胞肝癌、胃肠道间质瘤和非小细胞肺癌中,DACT1的表达显著降低[7-9];而在结直肠癌和头颈部鳞状细胞癌中,DACT1的表达较正常组织显著升高[10-11]。我们检测到Ⅰ型EOC细胞中DACT1呈稳定低表达,但其在卵巢癌中的功能尚不清楚。因此,本研究检测了DACT1在Ⅰ型EOC中的表达,并对其功能进行了探讨。
1 材料与方法 1.1 材料人卵巢黏液性腺癌细胞株3AO细胞株购买自中国科学院上海细胞库。临床组织均来源于2013年8月至2015年7月重庆医科大学附属第一医院妇科手术切除的标本,患者均已签署知情同意书。其中有3例低级别浆液性乳头状腺癌,22例透明细胞癌,6例低级别子宫内膜样腺癌,8例黏液性腺癌,5例高级别浆液性乳头状腺癌,3例高级别子宫内膜样腺癌和10例正常卵巢组织。标本均经病理学诊断。
携带全长DACT1 DNA序列或阴性对照序列的慢病毒构建于上海吉凯基因化学技术有限公司。
1.2 方法 1.2.1 细胞培养、转染及稳转株筛选人卵巢癌细胞株3AO使用含10%胎牛血清RPMI1640于5%CO2、37 ℃培养箱中培养。使用携带全长DACT1 DNA序列或阴性对照序列的慢病毒分别转染3AO细胞株,转染感染复数(MOI值)为40。1 mg/mL嘌呤霉素处理72 h以筛选稳转株。文中过表达组表示为3AO DACT1,阴性对照组表示为3AO NC。
1.2.2 划痕实验对数生长期3AO DACT1细胞及阴性对照组(NC)细胞种于6孔板中,待两组细胞融合度均达到100%时划线,于无血清1640中培养并分别在划痕0、24、48 h后于倒置显微镜下观察拍照并计算划痕愈合率。所有实验重复3次。
1.2.3 细胞迁移及基质胶侵袭实验Transwell小室购自Millipore公司。于上室内接种1.2×105个细胞,于培养箱中培养10 h后4%多聚甲醛固定,结晶紫染色后于显微镜下拍照并计数。与上述迁移实验类似,将Matrigel基质胶1:7稀释后取40 μL包被于小室内,凝固过夜。上室接种1.2×105个细胞,培养箱内孵育30 h后固定染色,显微镜下拍照计数。以上实验重复3次并进行统计学分析。
1.2.4 Western blot检测3AO DACT1和阴性对照组细胞按照体积比1:3加入含有PMSF和磷酸酶抑制剂的RIPA蛋白裂解液,冰上裂解30 min,14 000 r/min低温离心弃沉淀后按照体积比1:4加入含SDS上样缓冲液,95 ℃加热使蛋白失活。上样时每孔加入总蛋白15 μg。经SDS-PAGE凝胶电泳,PVDF膜转膜,脱脂奶粉封闭后,加入一抗4 ℃孵育过夜。兔抗人DACT1一抗稀释比为1:1 000,鼠抗人α-tubulin一抗稀释比为1:2 000。次日复温、洗膜后加入1:2 000稀释山羊抗兔、山羊抗鼠二抗,室温孵育2 h。ECL显影后,使用Fusion软件分析条带灰度值。实验重复3次。
1.2.5 免疫组织化学临床组织均经常规固定、包埋并切片。切片经二甲苯及梯度酒精脱蜡脱水,0.3%Trtiton-X破膜后,使用0.3%过氧化氢溶液阻断内源性过氧化物酶。枸橼酸钠溶液高温修复抗原后,采用正常山羊血清封闭,滴加一抗4 ℃过夜(DACT1稀释比为1:200)。次日一抗复温洗涤后先后滴加生物素标记的二抗、SABC液,最后经DAB显色,苏木精复染,脱水封片。采用H-Score分析,即根据每张切片的表达强度及表达范围计算并分析[12]。切片均采用Olympus BX51显微镜采像。
1.2.6 裸鼠腹腔内成瘤实验选取3周龄,质量约18 g的雌性裸鼠(购自重庆医科大学实验动物中心)进行实验,裸鼠均于适应性培养1周后进行实验。取对数生长期3AO DACT1细胞及阴性对照组(NC)细胞,经胰蛋白酶消化重悬后计数并使用PBS调整细胞浓度为5×107/mL,小鼠腹部常规消毒后腹腔内注射细胞悬液200 μL,每组为6只裸鼠。每周观察小鼠一般状态、体质量及腹围,5周后处死小鼠,解剖并观察其成瘤情况及大小、有无腹水及腹腔内脏器转移状态。
1.3 统计学分析采用SPSS 17.0统计软件,计量数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,非正态分布数据以中位数表示,采用非参数检验中的秩和检验分析。P < 0.05为差异有统计学意义。
2 结果 2.1 DACT1在原发性卵巢癌组织中的表达显著下调免疫组化检测DACT1在临床样本中的表达可见,在39例Ⅰ型卵巢癌组织中DACT1处于低表达或沉默的状态(H-Score中位值4),而在Ⅱ型卵巢癌组织中DACT1仍有表达(H-Score中位值8),但其蛋白表达水平仍低于正常卵巢组织(H-Score中位值12, P < 0.01, 图 1)。
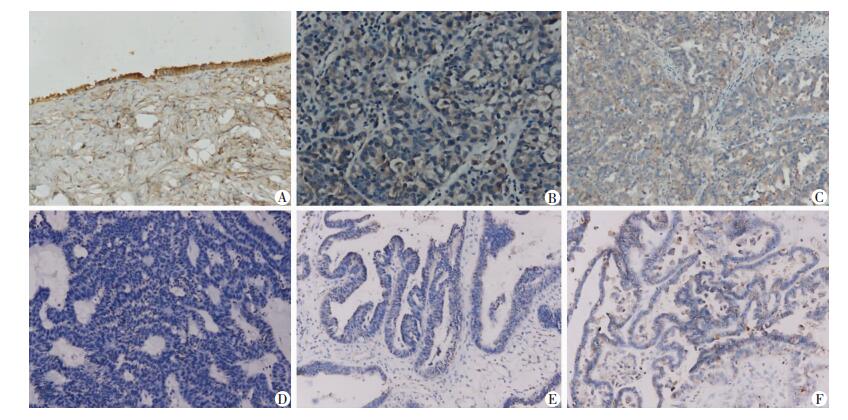
|
| A:正常卵巢上皮; B:高级别子宫内膜样腺癌; C:高级别浆液性乳头状腺癌; D:黏液性腺癌; E:低级别子宫内膜样腺癌; F:低级别浆液性乳头状腺癌 图 1 免疫组化检测DACT1在不同类型卵巢癌及正常卵巢组织中的表达(SABC ×200) |
2.2 外源性表达DACT1抑制Ⅰ型卵巢癌的迁移能力
实验发现黏液性卵巢癌组织中DACT1基本处于沉默状态,且3AO分离自原发性黏液性卵巢癌,具有明确的细胞遗传学背景,故选择3AO作为实验对象,通过慢病毒转染构建DACT1过表达稳转株及阴性对照细胞株,采用Western blot验证了细胞的转染效果(图 2A),过表达组与阴性对照组细胞DACT1表达相对灰度值之比为(31.85±4.93)。DACT1过表达组的划痕愈合率显著低于阴性对照组(P < 0.01,图 2B、C)。DACT1表达恢复后,穿膜细胞数显著降低[(347.67±34.27) vs (172.67±7.37),P < 0.01,图 3]。提示DACT1表达恢复抑制了3AO细胞株的迁移能力。

|
| A:Western blot验证DACT1过表达效率1:过表达组;2:阴性对照组;B:倒置显微镜下采像比较DACT1对3AO细胞迁移能力的影响(×200);C:划痕愈合率分析a:P < 0.01,与阴性对照组比较 图 2 划痕实验检测DACT1对3AO细胞迁移能力的影响 |

|
| A:阴性对照组;B:过表达组 图 3 Transwell实验检测DACT1对3AO细胞株迁移能力的影响(倒置显微镜×200) |
2.3 外源性表达DACT1抑制Ⅰ型卵巢癌细胞株的侵袭能力
采用基质胶侵袭实验检测DACT1对于3AO侵袭力的影响,结果提示DACT1同样抑制了3AO细胞株的侵袭能力[(183.67±21.39) vs (54.33±8.33),P < 0.01,图 4]。
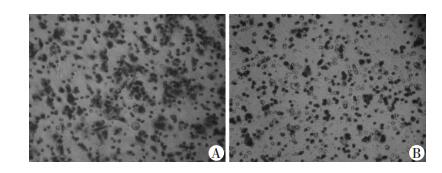
|
| A:阴性对照组;B:过表达组 图 4 基质胶侵袭实验检验DACT1恢复表达对3AO细胞株侵袭能力的影响(倒置显微镜×200) |
2.4 外源性表达DACT1抑制裸鼠腹腔内3AO细胞成瘤能力及转移能力
对照组6只裸鼠腹腔内均出现癌灶,且均有恶病质表现,腹腔明显膨隆,癌灶广泛存在于腹膜、脾周、肝脏表面及膈肌,其中4只裸鼠腹腔内可见血性腹水。而过表达组中仅有2只裸鼠腹腔内存在癌灶并表现出消瘦状态,未见腹水,且其腹腔内浸润转移情况及大小均明显弱于阴性对照组,余4只裸鼠一般状况良好,腹腔内未见癌灶(图 5)。这提示过表达DACT1显著抑制了3AO的成瘤能力和腹腔内转移能力。
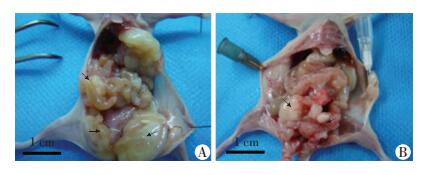
|
|
A:阴性对照组;B:过表达组 ↑:示腹腔内成瘤瘤体 图 5 裸鼠腹腔内成瘤大体观察 |
2.5 DACT1通过抑制非经典Wnt信号通路发挥对3AO迁移侵袭能力的抑制作用
采用鬼笔环肽染色细胞骨架的主要成分F-actin,探讨DACT1对Ⅰ型卵巢癌细胞株3AO恶性表型抑制效应的机制,并在激光共聚焦显微镜下观察对细胞运动及变形能力起着重要作用的细胞特化膜结构。过表达DACT1后细胞膜上的特化膜结构如板状伪足显著减少(图 6),提示DACT1可能通过抑制了非经典Wnt信号通路削弱了Ⅰ型卵巢癌细胞株3AO的运动能力。
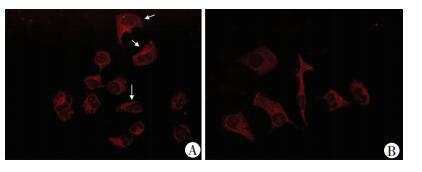
|
|
A:阴性对照组;B:过表达组 ↑:示板状伪足 图 6 F-actin荧光染色比较DACT1对3AO细胞特化膜结构形成的影响(×600) |
3 讨论
Ⅰ型卵巢癌发病率相对较低,相关研究较少。由于仍有部分患者诊断时为进展期,对其发病基础及进展机制的探讨仍然是十分必要的。
Wnt信号通路在胚胎发育[13]和肿瘤发生、发展[14-15]中起着关键的作用。β-catenin依赖性的经典Wnt信号通路在细胞增殖中发挥着重要的作用,而非经典Wnt信号通路,如平面细胞极通路(PCP信号通路)目前已证明与细胞骨架重塑有关,并通过调控JNK信号通路、Rac-GTP酶、Rho-GTP酶的活性而影响细胞极性及运动能力[16-18]。
既往研究已经证实:DACT1可调控Wnt信号通路,在非洲爪蟾蜍的发育过程中起到了重要的作用[5]。DACT1作为Wnt信号通路核心调节子Dvl的互作蛋白,可诱导Dvl降解从而抑制Wnt信号通路的活性,包括经典和非经典Wnt信号通路[6, 19]。本研究检测了DACT1在人卵巢癌临床标本中的表达,发现相较于正常组织中DACT1的强表达,其在卵巢癌组织中处于低表达状态,尤以Ⅰ型为甚。这提示DACT1可能与上皮性卵巢癌的恶性生物学行为存在潜在的关联。然而,在Ⅰ型和Ⅱ型卵巢癌组织中DACT1的缺失程度并不一致,考虑到Ⅰ型卵巢癌较Ⅱ型卵巢癌更加惰性的生物学行为,我们更倾向认为DACT1的缺失表达与Ⅰ型卵巢癌的疾病起源存在更大的相关性。但由于Ⅰ型卵巢癌发病率较低,故暂无法对Ⅰ型卵巢癌临床样本进行大样本的分析,未来的研究中仍需进一步增加样本量以评估DACT1在Ⅰ型卵巢癌组织中的蛋白表达水平。
为明确DACT1在Ⅰ型卵巢癌恶性表型中的作用,本研究选择人黏液性卵巢癌细胞株3AO作为研究对象,外源性转染DACT1并构建稳转株,通过细胞划痕实验及Transwell实验验证了DACT1对3AO细胞株迁移能力的抑制效应,基质胶侵袭实验反映了肿瘤细胞侵入细胞外基质的能力,DACT1恢复表达同样影响了3AO细胞株的侵袭能力。体内腹腔成瘤实验进一步验证了上述结果。
非经典Wnt信号通路,如平面细胞极通路(PCP信号通路)目前已证明与细胞骨架重塑有关,既往已有文献提示DACT1可通过诱导Dvl2降解而抑制Wnt信号通路活性[20],而非经典Wnt信号通路如平面细胞极信号通路可调控细胞骨架的重塑而干预细胞的运动及变形能力[19],但DACT1对Ⅰ型卵巢癌的抑癌效应通过何种途径实现仍属未知。本研究通过鬼笔环肽对细胞骨架的主要成分F-actin进行染色,过表达DACT1显著影响了细胞骨架中重要的特化膜结构,如板状伪足的形成,提示了DACT1可能通过抑制非经典Wnt信号通路调节细胞骨架重塑,继而抑制Ⅰ型卵巢癌细胞株的运动及侵袭能力。在本项目另一部分研究中,我们已证实DACT1可通过抑制经典Wnt信号通路抑制Ⅰ型卵巢癌细胞株的增殖及体内成瘤能力。但目前本课题组所获得的多株人卵巢癌细胞株中仅3AO具有明确的组织学及遗传学背景,分离自人卵巢黏液性腺癌,是一种典型的Ⅰ型卵巢癌细胞株,故选择此细胞株进行功能学及机制研究。但未来的研究中需增加另一种Ⅰ型卵巢癌细胞株进行实验以验证DACT1对Ⅰ型卵巢癌运动能力的抑制效应。
以上结果提示:在Ⅰ型卵巢癌的疾病起源及进展中,DACT1的缺失可能起到了重要的作用,尽管以3AO为代表的黏液性腺癌在卵巢癌二元论分类法中被认定为侵袭力较弱的Ⅰ型卵巢癌,但临床中仍可见部分黏液性卵巢癌患者肿瘤表现为浸润性生长,无法进行满意的肿瘤减灭术,从而显著影响了患者的预后。本研究发现,在Ⅰ型卵巢癌中存在DACT1表达缺失,其引起的Wnt信号通路的异常调控,可能是Ⅰ型卵巢癌独特恶性表型的潜在基础。DACT1能否作为临床预后的生物学标记物及其在临床治疗中的应用,尚需进一步研究。
| [1] | Kurman R J, Shih I M. The origin and pathogenesis of epithelial ovarian cancer: a proposed unifying theory[J]. Am J Surg Pathol,2010, 34 (3) : 433 –443. DOI:10.1097/PAS.0b013e3181cf3d79 |
| [2] | 曹文枫, 刘明, 孙保存. 上皮性卵巢癌起源二元论及分子生物学基础[J]. 中国肿瘤临床,2013, 40 (20) : 1264 –1267. DOI:10.3969/j.issn.1000-8179.20130790 |
| [3] | Gershenson D M, Sun C C, Lu K H, et al. Clinical behavior of stage Ⅱ-Ⅳ low-grade serous carcinoma of the ovary[J]. Obstet Gynecol,2006, 108 (2) : 361 –368. DOI:10.1097/01.AOG.0000227787.24587.d1 |
| [4] | 柳华, 彭芝兰. Wnt信号通路关键蛋白与上皮性卵巢癌间的关系[J]. 现代肿瘤医学,2010, 18 (2) : 377 –379. DOI:10.3969/j.issn.1672-4992.2010.02.061 |
| [5] | Cheyette B N, Waxman J S, Miller J R, et al. Dapper, a Dishevelled-associated antagonist of beta-catenin and JNK signaling, is required for notochord formation[J]. Dev Cell,2002, 2 (4) : 449 –461. DOI:10.1016/S1534-5807(02)00140-5 |
| [6] | Zhang L, Gao X, Wen J, et al. Dapper 1 antagonizes Wnt signaling by promoting dishevelled degradation[J]. J Biol Chem,2006, 281 (13) : 8607 –8612. DOI:10.1074/jbc.M600274200 |
| [7] | Yau T O, Chan C Y, Chan K L, et al. HDPR1, a novel inhibitor of the WNT/beta-catenin signaling, is frequently downregulated in hepatocellular carcinoma: involvement of methylation-mediated gene silencing[J]. Oncogene,2005, 24 (9) : 1607 –1614. DOI:10.1038/sj.onc.1208340 |
| [8] | Astolfi A, Nannini M, Pantaleo M A, et al. A molecular portrait of gastrointestinal stromal tumors: an integrative analysis of gene expression profiling and high-resolution genomic copy number[J]. Laboratory Investigation,2010, 90 (9) : 1285 –1294. DOI:10.1038/labinvest.2010.110 |
| [9] | Yang Z Q, Zhao Y, Liu Y, et al. Downregulation of HDPR1 is associated with poor prognosis and affects expression levels of p120-catenin and beta-catenin in nonsmall cell lung cancer[J]. Molecular Carcinogenesis,2010, 49 (5) : 508 –519. |
| [10] | Hou J, Li E M, Shen J H, et al. Cytoplasmic HDPR1 is involved in regional lymph node metastasis and tumor development via beta-catenin accumulation in esophageal squamous cell carcinoma[J]. J Histochem Cytochem,2011, 59 (7) : 711 –718. DOI:10.1369/0022155411409941 |
| [11] | Yuan G, Wang C, Ma C, et al. Oncogenic function of DACT1 in colon cancer through the regulation of beta-catenin[J]. PLoS One,2012, 7 (3) : e34004 . DOI:10.1371/journal.pone.0034004 |
| [12] | Budwit-Novotny D A, McCarty K S, Cox E B, et al. Immunohistochemical analyses of estrogen receptor in endometrial adenocarcinoma using a monoclonal antibody[J]. Cancer Res,1986, 46 (10) : 5419 –5425. |
| [13] | 谢宝国, 朱伟杰. Wnt/b-catenin信号通路在胚胎着床和发育中的作用[J]. 生殖与避孕,2013, 33 (5) : 328 –332. DOI:10.7669/j.issn.0253-357X.2013.05.0328 |
| [14] | 冯琛, 周雨峡, 许科斌, 等. Wnt/b-catenin信号通路相关蛋白在胃癌组织中的表达和肿瘤转移的关系[J]. 现代生物医学进展,2014, 14 (21) : 4109 –4112. DOI:10.13241/j.cnki.pmb.2014.21.028 |
| [15] | 李春艳, 高宁, 侯颖春. 经典Wnt信号通路与人类肿瘤[J]. 中国生物化学与分子生物学报,2014, 30 (5) : 447 –452. |
| [16] | Wang J, Wynshaw-Boris A. The canonical Wnt pathway in early mammalian embryogenesis and stem cell maintenance/differentiation[J]. Curr Opin Genet Dev,2004, 14 (5) : 533 –539. DOI:10.1016/j.gde.2004.07.013 |
| [17] | Angers S, Moon R T. Proximal events in Wnt signal transduction[J]. Nat Rev Mol Cell Biol,2009, 10 (7) : 468 –477. DOI:10.1038/nrm2717 |
| [18] | 张万秋, 田寅辉, 朱一超, 等. Wnt5a/Dvl2/Rac1信号通路调控MDA-MB-231人乳腺癌细胞的迁移[J]. 南京医科大学学报:自然科学版,2013, 33 (12) : 1664 –1668. DOI:10.7655/NYDXBNS20131204 |
| [19] | Wen J, Chiang Y J, Gao C, et al. Loss of Dact1 disrupts planar cell polarity signaling by altering dishevelled activity and leads to posterior malformation in mice[J]. J Bioll Chem,2010, 285 (14) : 11023 –11030. DOI:10.1074/jbc.M109.085381 |
| [20] | Ma B, Liu B, Cao W, et al. The Wnt Signaling Antagonist Dapper1 Accelerates Dishevelled2 Degradation via Promoting Its Ubiquitination and Aggregate-induced Autophagy[J]. J Biol Chem,2015, 290 (19) : 12346 –12354. DOI:10.1074/jbc.M115.654590 |



