2. 400010 重庆,重庆医科大学附属第二医院妇产科 ;
3. 400010 重庆,重庆医科大学超声影像学研究所
2. Department of Obstetrics and Gynecology, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010 ;
3. Institute of Ultrasound Imaging, Chongqing Medical University, Chongqing, 400010, China
类风湿关节炎(rheumatoid arthritis, RA)是一种常见的自身免疫性疾病, 其发病机制尚不明确[1]。其中,由于RA关节内炎症细胞的浸润、滑膜组织的增生以及新血管的生成,关节内形成乏氧微环境[2]。作为对乏氧的回应低氧诱导因子-1(hypoxia inducible factor-1α, HIF-1α)水平明显上调,从而提高血管内皮生长因子(vascular endothelial growth factor, VEGF)基因的转录,并促进致炎因子(如TNF-α和IL-6等)的大量释放,因此乏氧在RA病理机制中扮演着非常重要的角色。目前RA的治疗手段主要是抑制免疫细胞功能及滑膜细胞增殖,但对发病关节乏氧微环境的发病机制缺乏针对性。
脂质微泡不仅可以包裹药物或基因,也可实现对氧气的荷载[3-4],而超声微泡靶向破坏技术(ultrasound targeted microbubble destruction, UTMD)是可靠的药物靶向释放技术,其通过超声空化效应可以促进药物在靶向区域的释放,并提高辐照部位的药物吸收[5]。紫杉醇作为一线抗肿瘤药,可以抑制滑膜细胞增殖并对关节软骨有一定的保护作用[6]。本实验采用机械振荡法制备携氧载紫杉醇脂质微泡,以乏氧巨噬细胞为研究对象,联合超声辐照干预处理,观察超声介导携氧载紫杉醇脂质微泡对乏氧巨噬细胞的作用,为RA的治疗提供新的手段。
1 材料与方法 1.1 主要试药、试剂和仪器紫杉醇纯品购自南通飞宇生物科技有限公司,携氧载紫杉醇脂质微泡为本课题组制备,粒径(1.7±0.1) μm,紫杉醇包封率(97.71±1.13)%,载药量(22.70±0.82)%,见参考文献[7]。CoCl2、MTT均购自美国Sigma公司。ELISA试剂盒为进口分装。超声转染治疗仪(由重庆医科大学超声影像学研究所自行研制,UGTI205型,频率300 kHz),HIF-1α抗体(Santa Cruz, CA),其他细胞培养用品购自美国Corning公司。
1.2 细胞系与培养小鼠单核巨噬细胞RAW264.7由中国科学技术大学徐晓嵘教授馈赠,培养于含10%胎牛血清、2%双抗的DMEM高糖培养液中,置于37 ℃、5%CO2及饱和湿度的细胞培养箱恒温孵育,每2天更换1次培养液,取对数生长期的细胞进行实验。
1.3 巨噬细胞乏氧模型的构建及评价 1.3.1 乏氧模型构建及细胞活性检测参照文献[8]用CoCl2化学诱导法构建巨噬细胞乏氧模型,用MTT法检测不同CoCl2孵育浓度和时间对RAW264.7细胞活性的影响,筛选出合适的诱导参数。将对数生长期的RAW264.7细胞用0.25%胰酶消化,于96孔板每孔种10 000个细胞,每组设有5个复孔。细胞贴壁后分别加入浓度为50、100、150、200、300 μmol/L的CoCl2,于恒温培养箱中孵育6、12、24、48 h后,每孔分别加入20 μL MTT液孵育3 h后,弃去上清液,加入150 μL DMSO,振荡10 min后,酶标仪测波长490 nm处光密度值,计算细胞活性。
1.3.2 模型成功评价用RT-PCR法检测CoCl2处理后巨噬细胞HIF-1α基因的表达,评价乏氧模型是否构建成功。取对数生长期的RAW264.7细胞,1×106 个/孔分别接种于6孔板中,贴壁过夜后加入CoCl2(100 μmol/L)或正常培养液处理,分为乏氧组和常氧组,每组设有3个复孔,作用12 h后收集细胞。按照TRIzol试剂盒说明书的方法提取细胞总的RNA,PCR扩增HIF-1α,同时扩增GAPDH作为内参。小鼠巨噬细胞HIF-1α的引物序列(由上海吉玛制药合成)上游:5′-TTCCAGTTACGTTCCTTTGATCAG-3′,下游:5′-GTGGCAGTGGCAGTGATGGT-3′,扩增产物为128 bp。GAPDH的引物序列上游:5′-GGCGCTGAGTACGTCGTGGAGTC-3′,下游:5′-GACGCCTGCTTCACCACCTTCT-3′,其扩增产物片段的长度为527 bp。扩增条件为:94 ℃ 预变性5 min,94 ℃变性30 s,57 ℃退火30 s,72 ℃ 延伸60 s,该过程循环30次。扩增产物经1.5%琼脂糖凝胶电泳,凝胶结果拍照。每组实验重复3次。
1.4 超声介导携氧载紫杉醇脂质微泡对乏氧巨噬细胞HIF-1α表达的影响 1.4.1 实验分组及超声介导携氧载紫杉醇脂质微泡对乏氧巨噬细胞的处理实验分为6组(n=13):①对照组,②紫杉醇组,③携氧微泡组,④超声组,⑤携氧载紫杉醇脂质微泡组,⑥超声介导携氧载紫杉醇脂质微泡组。根据预实验,选择超声辐照时间为30 s、辐照强度为0.5 W/cm2对超声组和超声介导携氧载紫杉醇脂质微泡组进行超声辐照处理。紫杉醇浓度约为6×10-6 mol/L,携氧载紫杉醇脂质微泡组紫杉醇终浓度约为6×10-6 mol/L。
1.4.2 RT-PCR检测乏氧巨噬细胞HIF-1α基因的表达乏氧巨噬细胞经各组处理6 h后收集细胞,按照1.3.2的方法测定各组处理后乏氧巨噬细胞HIF-1α基因的表达情况。每组实验重复3次。
1.4.3 Western blot检测乏氧巨噬细胞HIF-1α蛋白的表达各组处理乏氧巨噬细胞24 h后,收集细胞,用蛋白裂解液裂解,收取裂解液,4 ℃,13 050×g离心15 min,取上清液,依据BCA蛋白浓度测定试剂盒(碧云天,中国)测定蛋白浓度,调整各组上清液蛋白含量一致。取上清液样品进行SDS-PAGE电泳分离蛋白,分离条带用5%脱脂奶粉封闭4 h,加入小鼠单克隆抗体HIF-1α孵育过夜,辣根过氧化物标记的二抗室温下孵育2 h,化学发光试剂作用3 min进行化学发光、显影。每组实验重复3次。
1.4.4 ELISA检测TNF-α和IL-6的蛋白水平按照试剂盒说明书对各组上清液中TNF-α和IL-6的蛋白水平进行测定。
1.5 统计学处理实验数据以x±s表示,采用SPSS 19.0统计软件包,不同浓度不同时间CoCl2对细胞活性的影响采用双因素方差分析,乏氧模型HIF-1α表达采用独立样本t检验,其他结果采用单因素方差分析。
2 结果 2.1 CoCl2对巨噬细胞活性的影响不同浓度CoCl2作用巨噬细胞不同时间,巨噬细胞活性抑制率见表 1。在CoCl2 100 μmol/L作用12 h时,细胞活性抑制率接近8%,然而随着作用时间的延长或者浓度增大时,细胞活性抑制率明显降低,其抑制作用与CoCl2呈剂量-时间依赖关系(P<0.05)。提示巨噬细胞随着CoCl2浓度增加及时间延长,其活性受到明显抑制。
| CoCl2浓度(μmol/L) | 6 h | 12 h | 24 h | 48 h |
| 50 | 2.93±0.56 | 5.07±1.02 | 14.57±1.22 | 33.80±4.50 |
| 100 | 5.94±1.41 | 7.97±1.38 | 22.33±3.70b | 41.04±4.43b |
| 150 | 16.25±2.42 | 18.46±1.84a | 35.99±5.16 | 48.89±3.72 |
| 200 | 24.27±3.74 | 20.39±1.67a | 42.44±4.81 | 63.21±6.75 |
| 300 | 32.51±4.04 | 32.35±5.58a | 47.57±5.91 | 71.73±3.71 |
| a:P<0.05,与相同时间浓度为100 μmol/L比较;b:P<0.05,与相同浓度时间为12 h比较 | ||||
2.2 巨噬细胞乏氧模型的评价
通过RT-PCR检测CoCl2乏氧诱导巨噬细胞HIF-1α mRNA的表达(图 1),评价模型乏氧情况。结果显示,乏氧组HIF-1α mRNA 的表达较常氧组提高4倍(t=23.136,P<0.05),提示巨噬细胞乏氧模型构建成功。

|
| 1:乏氧组;2:常氧组 图 1 RT-PCR检测CoCl2对巨噬细胞HIF-1α mRNA的表达 |
2.3 超声介导携氧载紫杉醇脂质微泡对乏氧巨噬细胞HIF-1α mRNA表达水平的影响
通过RT-PCR检测超声介导携氧载紫杉醇脂质微泡等处理组对乏氧小鼠巨噬细胞HIF-1α mRNA的表达(图 2A)。结果显示,只有超声介导携氧载紫杉醇脂质微泡组能显著降低HIF-1α mRNA的表达同对照组及其他处理各组之间的差异有统计学意义(F=21.942,P<0.05)。

|
| 1:对照组;2:紫杉醇组;3:携氧微泡组;4:超声组;5:携氧载紫杉醇脂质微泡组;6:超声介导携氧载紫杉醇脂质微泡组 图 2 各组处理后乏氧巨噬细胞HIF-1α mRNA(A)和蛋白(B)的表达 |
2.4 超声介导携氧载紫杉醇脂质微泡对乏氧巨噬细胞HIF-1α蛋白水平的影响
通过Western blot检测超声介导携氧载紫杉醇脂质微泡等处理组对乏氧巨噬细胞HIF-1α蛋白的表达(图 2B)。结果显示,只有超声介导携氧载紫杉醇脂质微泡组能明显降低HIF-1α蛋白的表达,与对照组及其他各处理组之间的差异有统计学意义(F=37.638, P<0.05)。
2.5 超声介导携氧载紫杉醇脂质微泡对乏氧巨噬细胞分泌TNF-α和IL-6的影响乏氧巨噬细胞经超声介导携氧载紫杉醇脂质微泡组处理后,TNF-α和IL-6的分泌水平较其他各组显著降低(P<0.05,图 3),提示该治疗手段可能降低乏氧细胞炎症因子TNF-α和IL-6的分泌。
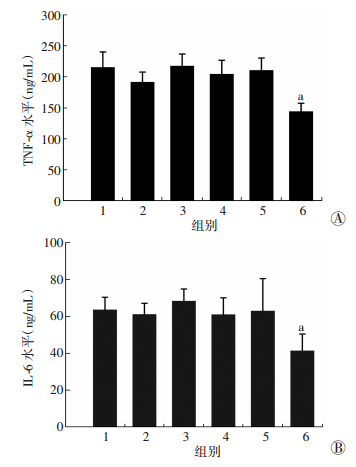
|
| 1:对照组;2:紫杉醇组;3:携氧微泡组;4:超声组;5:携氧载紫杉醇脂质微泡组;6:超声介导携氧载紫杉醇脂质微泡组 a:P<0.05,与其他5组比较 图 3 各组处理后乏氧巨噬细胞TNF-α(A)和IL-6(B) 的分泌(n=15,x±s) |
3 讨论
乏氧是某些疾病的特征,而在RA的病理生理过程中,乏氧是血管生成和炎症的重要调节因子,对疾病的发生、发展产生深远的影响[9-11]。抑制其表达可能成为RA治疗新策略。本课题组已经成功制备出稳定的携氧载药脂质微泡,并在体内以及体外研究均发现超声介导携氧载药脂质微泡可以改善卵巢癌的乏氧耐药抵抗[7, 12]。由于RA的乏氧特点,因此我们假设该治疗手段可能用于对RA乏氧状态的改善。
为了验证该治疗思路的可行性,本研究构建了体外巨噬细胞乏氧模型。乏氧模型的建立主要有两种方法,即物理模拟乏氧环境或者采用CoCl2化学方法进行诱导。前者不适用于体外局部氧浓度改善研究,而后者利用Co2+置换氧感受器血红素中的二价铁离子,同时HIF-1α被羟基化,从而上调并稳定HIF-1α的表达,达到了和缺氧条件在体外和体内近似的结果[13-14]。
本实验采用CoCl2诱导法构建巨噬细胞乏氧模型。首先检测不同浓度和时间条件下CoCl2对小鼠巨噬细胞活性的影响,结果显示,CoCl2对巨噬细胞活性抑制作用呈剂量-时间依赖性抑制,浓度小于150 μmol/L,作用时间12 h,巨噬细胞活性抑制低于8%。因此,巨噬细胞乏氧模型采用CoCl2 100 μmol/L,诱导12 h,建立巨噬细胞乏氧模型。通过RT-PCR检测CoCl2诱导巨噬细胞HIF-1α mRNA的表达,评价乏氧模型情况,结果提示乏氧模型组HIF-1α mRNA的表达提高几倍,提示该方法可以稳定构建巨噬细胞乏氧模型。
用超声介导携氧载紫杉醇脂质微泡处理乏氧巨噬细胞模型后,RT-PCR和Western blot结果显示,只有超声介导携氧载药微泡组使得乏氧小鼠巨噬细胞HIF-1α基因与蛋白表达明显下降,同时,在各组处理后的乏氧巨噬细胞TNF-α和IL-6的分泌情况也取得了类似的结果。这提示超声介导携氧载紫杉醇脂质微泡处理在体外可以有效改善乏氧巨噬细胞的乏氧状态,并减少相关炎症因子的分泌,这对于RA关节炎的治疗有一定治疗意义。然而我们同样观察到未经超声辐照的携氧微泡组和携氧载紫杉醇微泡组均未能抑制巨噬细胞HIF-1α基因和蛋白的表达,可能是由于未经超声辐照的微泡不能产生空化效应,脂质微泡包裹的氧气无法进入乏氧巨噬细胞内,改变细胞内的氧压差,而联合超声辐照的携氧微泡组,由于UTMD的作用,有效提高了乏氧巨噬细胞内的氧压差,抑制了HIF-1α基因和蛋白的表达。而UTMD提高乏氧细胞内氧浓度的可能机制是低强度超声使得微泡产生振荡,进而微泡破裂并产生稳定的微气流,微气流产生的剪切力破坏细胞膜使其产生可恢复的小孔,提高了细胞膜的通透性[15],同时微泡释放的氧气被动转运进入乏氧巨噬细胞内,改善乏氧巨噬细胞的乏氧状态。与此同时,单纯的药物组不能下调HIF-1α基因和蛋白表达,因此,微泡中包裹的氧气可能是治疗的关键。上述研究结果表明,超声以及携氧载药微泡相结合是改善乏氧巨噬细胞乏氧状态的关键,并为后续的超声介导携氧载紫杉醇脂质微泡治疗类风湿关节炎的在体实验奠定了基础。
| [1] | McInnes I B, Schett G. The pathogenesis of rheumatoid arthritis[J]. N Engl J Med,2011, 365 (23) : 2205 –2219. DOI:10.1056/NEJMra1004965 |
| [2] | Biddlestone J, Bandarra D, Rocha S. The role of hypoxia in inflammatory disease (review)[J]. Int J Mol Med,2015, 35 (4) : 859 –869. DOI:10.3892/ijmm.2015.2079 |
| [3] | Hernot S, Klibanov A L. Microbubbles in ultrasound-triggered drug and gene delivery[J]. Adv Drug Deliv Rev,2008, 60 (10) : 1153 –1166. DOI:10.1016/j.addr.2008.03.005 |
| [4] | 肖欢, 唐毅, 杨春江, 等. 新型载氧超声微泡的制备及其基本特性研究[J]. 第三军医大学学报,2013, 35 (17) : 1809 –1812. DOI:10.16016/j.1000-5404.2013.17.001 |
| [5] | Sirsi S R, Borden M A. Advances in ultrasound mediated gene therapy using microbubble contrast agents[J]. Theranostics,2012, 2 (12) : 1208 –1222. DOI:10.7150/thno.4306 |
| [6] | Dyondi D, Sarkar A, Banerjee R. Joint Surface-Active Phospholipid-Mimetic Liposomes for Intra-Articular Delivery of Paclitaxel[J]. J Biomed Nanotechnol,2015, 11 (7) : 1225 –1235. DOI:10.1166/jbn.2015.2061 |
| [7] | Liu L, Chang S, Sun J, et al. Ultrasound-mediated destruction of paclitaxel and oxygen loaded lipid microbubbles for combination therapy in ovarian cancer xenografts[J]. Cancer Lett,2015, 361 (1) : 147 –154. DOI:10.1016/j.canlet.2015.02.052 |
| [8] | Shweta, Mishra K P, Chanda S, et al. A comparative immunological analysis of CoCl2 treated cells with in vitro hypoxic exposure[J]. Biometals,2015, 28 (1) : 175 –185. DOI:10.1007/s10534-014-9813-9 |
| [9] | Konisti S, Kiriakidis S, Paleolog E M. Hypoxia--a key regulator of angiogenesis and inflammation in rheumatoid arthritis[J]. Nat Rev Rheumatol,2012, 8 (3) : 153 –162. DOI:10.1038/nrrheum.2011.205 |
| [10] | Fearon U, Canavan M, Biniecka M, et al. Hypoxia, mitochondrial dysfunction and synovial invasiveness in rheumatoid arthritis[J]. Nat Rev Rheumatol,2016, 12 (7) : 385 –397. DOI:10.1038/nrrheum.2016.69 |
| [11] | Cummins E P, Keogh C E, Crean D, et al. The role of HIF in immunity and inflammation[J]. Mol Aspects Med,2016, 47-48 : 24 –34. DOI:10.1016/j.mam.2015.12.004 |
| [12] | Sun J, Yin M, Zhu S, et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded lipid microbubbles for combination therapy in hypoxic ovarian cancer cells[J]. Ultrason Sonochem,2016, 28 (1) : 319 –326. DOI:10.1016/j.ultsonch.2015.08.009 |
| [13] | Masoud G N, Li W. HIF-1alpha pathway: role, regulation and intervention for cancer therapy[J]. Acta Pharm Sin B,2015, 5 (5) : 378 –389. DOI:10.1016/j.apsb.2015.05.007 |
| [14] | Cheng J C, Klausen C, Leung P C. Hypoxia-inducible factor 1 alpha mediates epidermal growth factor-induced down-regulation of E-cadherin expression and cell invasion in human ovarian cancer cells[J]. Cancer Lett,2013, 329 (2) : 197 –206. DOI:10.1016/j.canlet.2012.10.029 |
| [15] | Lentacker I, De-Cock I, Deckers R, et al. Understanding ultrasound induced sonoporation: definitions and underlying mechanisms[J]. Adv Drug Deliv Rev,2014, 72 : 49 –64. DOI:10.1016/j.addr.2013.11.008 |



