2. 401220 重庆,重庆市长寿区妇幼保健院儿科
2. Department of Paediatrics, Maternal and Child Health Hospital of Changshou District, Chongqing, 401220, China
胎粪吸入综合征(meconium aspiration syndrome,MAS)是新生儿常见的疾病之一,发病率为1.2%~1.6%[1],是足月儿和过期产儿的主要死因之一[2]。胎粪吸入引起的肺损伤病理学改变非常复杂,包括炎症细胞浸润、不均匀气道阻塞、肺表面活性物质失活、继发肺动脉高压等病理生理的改变[3]。稳定的接近新生儿病理生理条件的胎粪吸入综合征动物模型可以为临床治疗新生儿肺损伤提供较好的研究平台,但是该模型需要进行机械通气,使小型动物模型应用受限,因而限制了研究。国内外研究大多使用较大的动物,如新生猪[4-5]或成年兔[6-8],甚至采用新生的小羊羔[9]制备胎粪吸入模型,动物成本相对较高,且进行分子生物学实验时受到抗体试剂的限制。新生大鼠更接近新生儿肺发育特征[10],且费用便宜、操作方便。因此,本实验选用新生大鼠,在小动物呼吸机辅助呼吸下通过气管插管、气管导管内注入胎粪后制备新生大鼠胎粪吸入模型,监测血气分析、胸片及肺组织病理情况,为胎粪吸入、肺损伤等疾病相关机制研究提供合适的动物模型。
1 材料与方法 1.1 材料 1.1.1 实验动物5~7日龄、体质量12~20 g的健康新生大鼠25只(第三军医大学实验动物中心提供),雌雄不限。
1.1.2 主要仪器和试剂小动物呼吸机(Mouse Ventilator MiniVent Type 845,HUGO SACHS ELEKTRONIK HARVARD APPARATUS DmbH in Germany)、Abbott i-STAT微量血气分析仪(美国雅培公司)、医用氧气、小动物X线机MX-20(美国Faxitron公司)。
1.1.3 胎粪悬液的制备取多个足月健康新生儿头次胎粪(征得家属同意),真空冷冻干燥,研磨成粉末状,用无菌生理盐水稀释成20%的均匀胎粪混悬液,分装-20 ℃冰箱保存[11],备用。
1.2 试验方法 1.2.1 分组将24只新生大鼠采用配对比较法(日龄、体质量)分为胎粪吸入性肺炎模型组(MAS组)和假手术组(NS组),保证造模成功后每组10只。另取1只健康新生大鼠(正常大鼠)作为胸部X线表现及肺组织病理学观察的对照。
1.2.2 动物模型的制备操作前,将新生大鼠称量后放在异氟醚麻醉罐8 min左右[8],待新生大鼠麻醉成功后,取出大鼠仰卧位固定于手术台,行气管、左侧颈总动脉及右侧颈外静脉分离插管术,予气管插管,胶带固定,记录生理参数,待通气稳定后,气管导管内注入2 mL/kg的胎粪混悬液,继续给予机械通气30 min确保胎粪均匀进入支气管及肺泡,撤离呼吸机,敷料贴粘好皮肤,给予喂食。NS组新生大鼠气管插管内注入等量无菌生理盐水,余操作步骤同实验组。观察8 h,操作过程中30 min通气过程中MAS组死亡1只,8 h内死亡2只,遂MAS组以同样实验方法再次追加4只,存活3只。最终MAS组、NS组造模成功各10只新生大鼠。
1.2.3 观察指标8 h内大鼠病死率,检测血气分析,包括pH、氧分压[p(O2)]、二氧化碳分压[p(CO2)]、氧饱和度(SaO2)等及肺湿/干质量比,观察大鼠胸部X线表现及肺组织病理学变化。X线表现参照诊断标准分为轻、中、重型[12]。
1.2.4 标本的采集与检测将10只新生大鼠行胸片检查,然后麻醉、开胸、血气分析(左心室采血),处死动物,肉眼观察肺组织病理情况;然后取左上肺组织标本行病理检查,余下的标本称湿质量,放入80 ℃的烤箱烘烤48 h,称干质量。
1.2.5 肺组织肉眼观察肉眼观察肺组织病理情况,按文献[13]的方法将其分为5级,Ⅰ级:正常肺;Ⅱ级:肺较饱满,有水肿;Ⅲ级:点状肺出血,整个肺可见针尖或绿豆大小的出血;Ⅳ级:局灶性肺出血;Ⅴ级:弥散性肺出血,肺表面可见总面积达2叶以上的斑块状或大片状暗红色出血。
1.2.6 肺组织病理学检查取左上肺整叶肺组织(肉眼观MAS组左上肺明显水肿、充血),用4%多聚甲醛液固定,常规石蜡包埋切片,苏木精-伊红(HE)染色,400倍光镜下任取10个视野,观察肺组织病理改变。肺组织病理损伤评分标准[14-15],按3个特征分为0~4分,①白细胞在肺组织中的浸润范围:0分为0%,1分为0~25%,2分为>25%~50%,3分为>50%~75%,4分别为>75%~100%;②肺泡腔白细胞量:0=无,1=偶有,2=大量白细胞,3=肺泡腔几乎充满白细胞,4=肺泡腔充满白细胞并扩张;③肺泡腔渗出物的量:包括纤维素、透明膜、水肿液及胎粪,0=无渗出物,1=偶见渗出物,2=清晰可见渗出物,3=几乎充满渗出物,4=肺泡腔充满渗出物并扩张。
1.3 统计学处理实验数据以x±s表示,采用SPSS 13.0统计软件,两两比较采用配对样本t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 两组大鼠血气分析NS组在8 h内均未出现死亡;MAS组在30 min内死亡1只,8 h内死亡2只,观察过程中有明显呼吸及肤色改变(死亡后予以解剖发现肉眼观及病理切片提示肺组织大面积出血)。血气分析提示:MAS组pH值(7.19±0.11)低于NS组(7.31±0.08),差异有统计学意义(P < 0.05);MAS组p(O2)[(25±9)mmHg]明显低于NS组[(62±12)mmHg],差异有统计学意义(P < 0.05);MAS组p(CO2)[(57±10)mmHg]高于NS组[(47±16)mmHg],差异无统计学意义(P=0.137);MAS组SaO2(35±16)%明显低于NS组(86±7)%,差异有统计学意义(P < 0.05)。
2.2 两组胸部X线表现结果见图 1,正常大鼠X线结果提示双肺纹理清晰;NS组9只大鼠胸片提示双肺纹理清晰,另外1只提示上肺散在斑片状影;而MAS组4只大鼠胸部X线主要表现轻型:肺纹理增粗,心影正常;6只大鼠胸部X线表现为中型:肺野有高密度增加的粗颗粒状或片状云絮状阴影或有节段性肺不张及肺气肿,心影缩小。
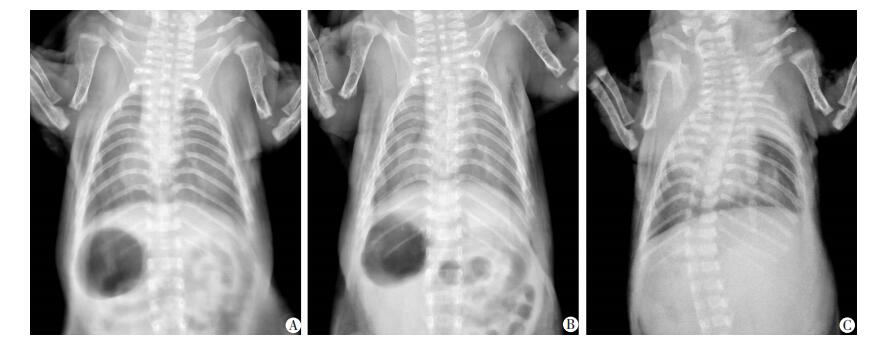
|
| A:正常大鼠;B:NS组;C:MAS组 图 1 正常大鼠和NS组、MAS组大鼠胸部X线表现 |
2.3 肺组织湿/干质量比
MAS组肺湿/干质量比为(5.85±0.47),显著高于NS组[(4.28±0.71),P < 0.05]。
2.4 肺组织肉眼观病理情况正常大鼠和NS组、MAS组肺组织的肉眼观见图 2。正常大鼠肺脏为海绵状,淡粉色,色泽均一;NS组大鼠肺组织肉眼观呈现肺脏为海绵状,淡粉色,色泽均一,同正常肺组织相似。MAS组大鼠肺组织表面可见局灶性肺出血。

|
| A:正常大鼠;B:NS组;C:MAS组 图 2 正常大鼠和NS组、MAS组大鼠肺组织肉眼观 |
2.5 肺组织病理结果
正常大鼠和NS组、MAS组大鼠肺组织HE染色后结果见图 3。NS组大鼠肺组织见肺泡通气均一,偶可见少许炎症细胞浸润,无明显充血、水肿;MAS组大鼠肺组织可见肺泡通气不均一,肺泡隔增宽,伴炎性细胞浸润,肺间质和肺泡弥散性水肿,肺泡壁、肺泡腔可见出血,局部微脓肿形成。
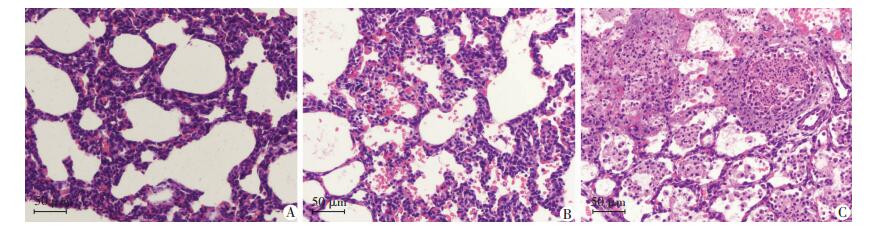
|
| A:正常大鼠;B:NS组;C:MAS组 图 3 HE染色观察正常大鼠和NS组、MAS组大鼠肺组织病理学变化 |
3 讨论
在我国,各种原因所致的急慢性呼吸衰竭仍是引起新生儿死亡与伤残最常见的临床危重症,新生儿期因肺部疾病所导致的急性呼吸衰竭常见于以下两种原因: ①因肺表面活性物质分泌不足而导致的新生儿呼吸窘迫综合征(NRDS),近年来随着肺表面活性物质及多种呼吸支持技术的临床应用已得到有效防治[16]。②急性肺损伤是新生儿死亡的另一个重要原因。新生儿围产期肺损伤主要指各种围产损伤因素(病原体、LPS、胎粪、胆酸等)对新生儿肺组织结构与功能的急性破坏以及由此而导致的继发性呼吸衰竭,包括一系列不同病因但发病机制及临床表现类似的疾病。发病机制及临床表现类似于成人的急性呼吸窘迫综合征(ARDS)。与NRDS相比较,新生儿ARDS以伴随严重的系统炎症反应为主要特征,肺表面活性物质替代治疗效果相对较差,综合诊治难度大,常导致新生儿死亡[17]。
MAS是新生儿肺损伤和呼吸衰竭的主要原因[18],是指胎儿发生宫内窘迫或产时窒息提前排出胎粪,吸入后胎粪到达各级气管、支气管及肺泡, 引起肺组织一系列的病理生理改变, 从而发生肺部病变。胎粪吸入引起的肺损伤病理改变非常复杂, 包括炎症细胞浸润、气道阻塞、血管活性物质释放、组织学改变和表面活性物质失活, 甚至直接损伤肺泡毛细血管屏障, 使肺泡毛细血管通透性增加, 蛋白渗出, 形成肺间质水肿, 影响气体交换, 使机体组织缺氧等。可致肺损伤、呼吸衰竭、气漏及持续肺动脉高压,若不及时处理或处理不当,可危及生命。故寻找稳定的接近新生儿病理生理条件的MAS动物模型可以为临床治疗新生儿肺损伤、呼吸衰竭提供较好的研究平台。
新生儿急性肺损伤/新生儿急性呼吸窘迫综合征的研究起步较晚,缺乏大样本随机对照研究,迄今尚无理想的新生儿急性肺损伤/新生儿急性呼吸窘迫综合征的诊断和治疗的方案[19]。动物模型为病人和实验室研究提供了一个桥梁。鼠类、兔、猪、山羊及灵长类等动物都可作为动物模型。虽然灵长类动物进化程度高,反应更接近人类,是目前最理想的动物,但由于动物来源困难、费用昂贵,应用受限;而鼠类动物繁殖快,来源容易,虽然其生理基础和疾病的病理变化与人类相比有一定的差距,但在一定程度上仍是一种良好的选择。目前国内外胎粪吸入综合征模型多采用新生猪、成年兔、成年大鼠、绵羊等制备,动物成本相对较高,且进行分子生物学实验时受到抗体试剂的限制,同时胎粪吸入是发生在胎儿向新生儿期转变的过程中,故采用新生大鼠(生后7 d内)吸入胎粪制作动物模型更接近于本研究胎粪吸入综合征导致新生儿急性肺损伤/新生儿急性呼吸窘迫综合征的病理过程。
本研究结果显示,MAS组无论是血气分析、肺湿/干质量、胸片还是病理形态学观察都表明胎粪吸入后出现了相应的肺损伤,胸片主要表现为轻型、中型损伤为主,重型少,血气分析的p(CO2)提示两组差异无统计学意义,可能与模型制备过程中重型胎粪吸入综合征的新生大鼠尚未来得及行胸片、血气分析检查就已经死亡有关,同时临床中血气分析及胸片应随病情变化及时复查,但因采血及操作困难,选择给予胎粪及生理盐水后8 h统一采血及胸片检查。以肺组织病理检查作为标准,NS组肺损伤不明显,而MAS组则表现为:肺泡大小不均,肺泡内及肺间质大量炎性细胞浸润,肺叶内均布肺不张,肺泡壁增厚同时也有肺泡壁破裂,其中有2例有明显的肺出血、肺大泡、微脓肿形成,肺损伤程度有轻有重,与临床相符合。
综上所述,胎粪吸入综合征造模成功,目前胎粪吸入模型及胆汁淤积等模型可较好的复制围产期肺损伤,但目前国内外研究大多使用新生猪、大鼠及成年兔制备胎粪吸入模型,而胆酸淤积模型则采用孕鼠、孕兔等制备着手,本研究拟从新生大鼠成功复制胎粪吸入综合征模型后,拟以同样的实验方法,气管插管内注入胆酸或重度胆汁淤积的羊水,模拟复制胆酸性肺炎模型,期待能更好地为下一步研究急性肺损伤/ARDS提供模型复制。
| [1] | 周海燕, 武荣. 新生兔重度胎粪吸入模型的制备[J]. 安徽医学,2010, 31 (9) : 1101 –1104. DOI:10.3969/j.issn.1000-0399.2010.09.040 |
| [2] | Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet,2012, 380 (9859) : 2095 –2128. DOI:10.1016/S0140-6736(12)61728-0 |
| [3] | 黄惠君, 杨军, 王国兵, 等. 新生鼠胎粪吸入综合征致急性肺损伤的发病机制研究[J]. 中国妇幼保健,2010, 25 (26) : 3801 –3802. |
| [4] | Renesme L, Elleau C, Nolent P, et al. Effect of high-frequency oscillation and percussion versus conventional ventilation ina piglet model of meconium aspiration[J]. Pediatr Pulmonol,2013, 48 (3) : 257 –264. DOI:10.1002/ppul.22590 |
| [5] | SilveraF E, BlasinaM F, Vaamonde L, et al. Sildenafil prevents the increase of extravascular lung water and pulmonary hypertension after meconium aspiration in newborn piglets[J]. BrazJ Med Biol Res,2011, 44 (8) : 778 –785. DOI:10.1590/S0100-879X2011007500085 |
| [6] | LiA M, ZhangL N, LiW Z. Amelioration of meconium-induced acute lung injury by parecoxib ina rabbit model[J]. IntJ Clin Exp Med,2015, 8 (5) : 6804 –6812. |
| [7] | TurhanA H, Atici A, Muslu N, et al. The effects of pentoxifylline on lung inflammation ina rat model of meconium aspiration syndrome[J]. Exp Lung Res,2012, 38 (5) : 250 –255. DOI:10.3109/01902148.2012.676704 |
| [8] | Mokra D, Drgova A, Mokry J, et al. Combination of budesonide and aminophylline diminished acute lung injury in animal model of meconium aspiration syndrome[J]. J Physiol Pharmacol,2008, 59 (Suppl 6) : 461 –471. |
| [9] | Martinez-Burnes J, Lopez A, Lemke K, et al. Transoral intratracheal inoculation method for use with neonatal rats[J]. Comparative Medicine,2001, 51 (2) : 134 –137. |
| [10] | Rey-Santano C, Alvarez-DiazF J, Mielgo V, et al. Bronchoalveolar lavage versus bolus administration of lucinactant, a synthetic surfactant in meconium aspiration in newborn lambs[J]. Pediatr Pulmonol,2011, 46 (10) : 991 –999. DOI:10.1002/ppul.21460 |
| [11] | 蔡栩栩, 刘春峰, 杜悦, 等. 内毒素致新生和成年大鼠急性肺损伤的比较[J]. 中华急诊医学杂志,2005, 14 (6) : 458 –462. DOI:10.3760/j.issn:1671-0282.2005.06.005 |
| [12] | 吴小兵. 新生儿胎粪吸入综合征的临床和X线分析[J]. 海南医学,2006, 17 (12) : 99 –100. DOI:10.3969/j.issn.1003-6350.2006.12.065 |
| [13] | Holopainen R, Aho H, Laine J, et al. Nitric oxide inhalation inhibits pulmonary apoptosis but not inflammatory injury in porcine meconium aspiration[J]. Acta Paediatr,1999, 88 (10) : 1147 –1155. DOI:10.1111/j.1651-2227.1999.tb01004.x |
| [14] | 杜悦, 蔡栩栩, 吴玉斌, 等. 内毒素对新生大鼠肺组织金属基质蛋白酶2及其抑制因子2表达影响的研究[J]. 中华围产医学杂志,2004, 7 (6) : 356 –360. DOI:10.3760/cma.j.issn.1007-9408.2004.06.010 |
| [15] | 付永萍, 孔祥永, 韩娟, 等. 血管紧张素II及其受体拮抗剂对胎粪诱导肺损伤中炎症反应的作用[J]. 实用医学杂志,2008, 24 (17) : 2955 –2957. DOI:10.3969/j.issn.1006-5725.2008.17.014 |
| [16] | 王六超, 农绍汉. 新生儿胎粪吸入综合征的治疗进展[J]. 医学综述,2014, 20 (22) : 4160 –4162. DOI:10.3969/j.issn.1006-2084.2014.22.050 |
| [17] | LevesqueB M, KalishL A, LaPierre J, et al. Impact of implementing 5 potentially better respiratory practices on neonatal outcomes and costs[J]. Pediatrics,2011, 128 (1) : e218 –e226. DOI:10.1542/peds.2010-3265 |
| [18] | De-Luca D, Piastra M, Tosi F, et al. Pharmacological therapies for pediatric and neonatal ALI/ARDS: an evidence-based review[J]. Curr Drug Targets,2012, 13 (7) : 906 –916. DOI:10.2174/138945012800675687 |
| [19] | 常立文, 李文斌. 新生儿急性肺损伤/急性呼吸窘迫综合征[J]. 实用临床儿科杂志,2007, 22 (2) : 84 –86. DOI:10.3969/j.issn.1003-515X.2007.02.002 |



