血管活性肠肽受体(vasoactive intestinal peptide receptor,VIPR)属于G蛋白偶联跨膜受体家族[1],目前发现有VPAC1、VPAC2和PAC1三种亚型。研究证实,VPAC1在结直肠癌、乳腺癌、肺癌等多种肿瘤原发及其转移灶细胞中高水平表达,而VPAC2仅表达于良性平滑肌瘤等少数肿瘤[1-2];VPAC1高亲和力结合位点(Bmax)是正常组织的22.5~57.9倍[3]。因此,VPAC1是一较为理想的肿瘤分子影像与靶向治疗研究靶标,并显示出潜在的应用前景[4-6]。然而,目前VIPR显像研究探针均为血管活性肠肽(vasoactive intestinal peptide,VIP)全分子或其类似物,皆能与上述三种受体亚型结合,故缺乏针对VPAC1的高特异性。
本课题组前期利用噬菌体展示肽库全细胞差减筛选技术,筛选并鉴定得到高特异靶向VPAC1的线性十二肽(GFRFGALHEYNS,简称VP2),其与VPAC1的结合亲和力显著高于天然配体VIP [7]。本研究拟通过多肽化学合成技术合成VP2,同时在其氨基末端偶联甘氨酸-丙氨酸(D)-甘氨酸-甘氨酸-氨基丁酸[G(D)AGG-Aba]双功能螯合剂,探讨99Tcm标记G(D)AGG-Aba-VP2(TP1724)的最佳条件,鉴定99Tcm-TP1724的理化性质,研究示踪动力学的特性、正常小动物体内的生物分布和动态显像变化特点,为下一步研究以受体VPAC1为靶点的肿瘤显像奠定基础。
1 材料与方法 1.1 材料 1.1.1 主要仪器Symbia T6 SPECT/CT(SIEMENS公司);活度计(RM-905a,北京易达测量技术有限公司);伽马免疫计数器(GC-1200,安徽中科中佳科学仪器有限公司);电子天平(AUX320,岛津公司);高速低温离心机(H2500R-2,长沙英泰仪器有限公司);恒温振荡仪(HNMTC-100,上海汗诺仪器有限公司);微量移液器(赛默飞公司)。
1.1.2 主要试剂与材料TP1724[Gly-(D)Ala-Gly-Gly-Aba-Gly-Phe-Arg-Phe-Gly-Ala-Leu-His-Glu-Tyr-Asn-Ser-NH2](委托上海强耀生物科技有限公司合成,相对分子质量1 723.86,化学纯度96.9%);99Mo-99Tcm(裂变型)发生器(放化纯度:Na99TcmO4> 98%,北京原子高科股份有限公司);SnCl2·2H2O(二水氯化亚锡,西格玛公司);葡聚糖凝胶(Sephadex)G-50 (上海宝曼生物科技有限公司);冻存管(Thermo 公司);3 MM色谱层析纸(Sigma公司);N2(纯度>99%,重庆展东气体有限公司);其余分析纯试剂均为国产。
1.1.3 实验动物健康昆明小鼠35只(5周龄,体质量20~23 g,雌雄各半),健康雄性6月龄日本大耳兔9只(体质量2.0 kg左右),第三军医大学西南医院动物实验中心购买。
1.2 方法 1.2.1 99Tcm-TP1724的标记参考查林等[8]的方法并且重新探索确定标记试剂用量。细胞冻存管在室温下按先后顺序加入蒸馏水溶解的TP1724(15 μg/15 μL)、50 mmol/L 盐酸(HCl)立即溶解配制的二水氯化亚锡(SnCl2·2H2O,66 μg/10 μL)、67 mmol/L磷酸钠(Na3PO4)溶液300 μL、99TcmO4-(即用即淋)100 μL(222 MBq),旋涡混匀;通N2、封口胶密闭,室温下放入恒温振荡仪内,震荡30 min,标记完成;然后加入1 mol/L磷酸二氢钠(NaH2PO4)20 μL,使标记溶液pH在7.0~7.2范围内。
1.2.2 标记率与比活度的计算标记物的纸层析:毛细管取标记混合物点样,经3 MM色谱纸上行层析,流动相分别为丙酮(展开剂Ⅰ)与水(Ⅴ)∶乙醇(Ⅴ)∶30%氨水(Ⅴ)=5∶2∶1(展开剂Ⅰ),分段裁剪层析纸,井型伽马计数器测定各放射性组成成分的比移值(Rf)。按下式分别计算99Tcm-TP1724的标记率和比活度。
1.2.3 稳定性实验(体外)标记的99Tcm-TP1724 溶液室温放置1、2、4 h后取样进行3 MM色谱纸的层析(方法同1.2.2),然后计算以上各时间点的放化纯度。
1.2.4 人血浆蛋白结合实验取99Tcm-TP1724 100 μL(37 MBq)与等体积正常人血浆混匀,置于37 ℃恒温振荡仪温育2 h;室温下,移出混合液行Sephadex G-50柱层析,平衡及洗脱液为含1%BSA的0.01 mol/L PBS(pH 7.4),按顺序收集洗脱液,然后取样并测定每管的放射性计数(Bq/min),制作成洗脱液的T-A曲线。取活度相同99Tcm-TP1724加入PBS至200 μL混匀,同上法行Sephadex G-50柱层析,作为对照。
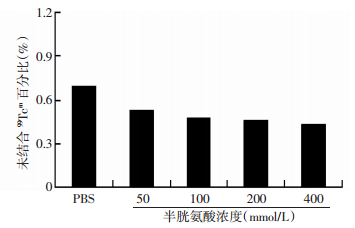
1.2.5 半胱氨酸置换实验1.5 mL细胞冻存管中分别加入50、100、200、400 mmol/L半胱氨酸溶液[0.01 mol/L PBS(pH7.4)配制],各管中加入99Tcm-TP1724 50 μL(111 MBq)后混匀,置于37 ℃恒温振荡仪温育1 h;取温育混合物行3 MM色谱纸层析(展开剂为丙酮),计算未结合99Tcm的百分比。以PBS作为对照。本实验行三复管。
1.2.6 脂/水分配实验分别取99Tcm-TP1724 100 μL(55.5 MBq)、50 mmol/L PBS 400 μL及n-octanol(辛醇)500 μL加入细胞冻存管,温室旋涡混匀1 min;待脂/水相分离后,12 000 r/min离心4 min;分别从水相与有机相中取出10 μL与100 μL测量放射性计数(Bq/min);经体积校正后,根据下式计算99Tcm-TP1724的脂/水分配系数(lg P)。本实验行三复管。
1.2.7 示踪动力学实验选择9只健康日本大耳兔,俯卧固定木质实验台上,每只经左侧耳缘静脉注射99Tcm-TP1724 200 μL(37 MBq);分别在注射后1、5、10、30、60、120、240 min从右侧耳缘静脉抽出血液,称量然后测量放射性计数(Bq/min)。按血液密度1 g/mL计,经参考源校正,将血样品的放射性换算成kBq/L。用药代动力学(DAS 3.1.6版本)软件分析,智能化分析平均血液放射性的浓度-时间数据,判断99Tcm-TP1724在健康家兔体内的最佳房室模型,并得到其药-时关系式及示踪动力学参数。
1.2.8 正常昆明小鼠体内生物分布实验按随机数字表法把35只昆明小鼠分为7组,每组5只。经尾静脉每只注入99Tcm-TP1724 100 μL(3.7 MBq),分别于注射后1、5、10、30、60、120、240 min将小鼠立即断头处死,收集血液及心脏、肾脏、肝脏、肠、肺、肌肉、脑和骨等组织器官,称量然后测定其放射性计数(Bq/min)。参考源校正结果后,换算为%ID/g(每克组织百分注射剂量率)。
1.2.9 健康家兔显像Symbia T6 SPECT/CT探头配备为低能、高分辨准直器,能峰为140 keV,窗宽为20%,矩阵为128×128,Zoom=1。固定家兔于实验台上,呈仰卧位,探头视野中心位于胸腹部。经耳缘静脉内注射99Tcm-TP1724 74 MBq,以1帧/s采集1 min,然后1帧/min采集59 min;分别于90、120、150、180、240 min静态采集图像,经时间衰减校正各预置计时采集1帧。利用ROI技术,作出注射99Tcm-TP1724后1 h内动态影像的心脏、肾脏、肝脏、膀胱等组织器官T-A曲线;显像过程中,观察整个实验动物的体内放射性动态分布变化。
2 结果 2.1 标记率与比活度标记混合物中各放射性组分在3 MM色谱纸层析中的比移值(Rf)见表 1。经计算99Tcm-TP1724的标记率(96.57±0.71)%,比活度(25.52±0.29)TBq/mmol。
| 放射性组分 | Rf值 | |
| 展开剂Ⅰ | 展开剂Ⅱ | |
| 99Tcm-TP1724 | 0 | 0.8~0.9 |
| 未结合99Tcm(99TcmO4-) | 0.9~1.0 | 0.7~0.8 |
| 水解锝(99TcmO4-·XH2O) | 0 | 0 |
2.2 理化性质
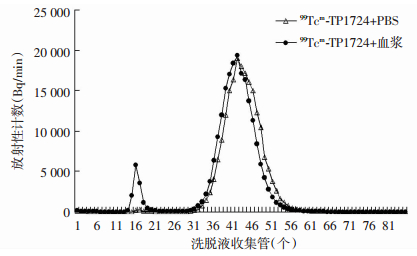
标记溶液室温放置1、2、4 h,99Tcm-TP1724的放化纯度分别为(95.74±1.53)%、(95.50±2.06)%与(93.64±2.25)%。99Tcm-TP1724与正常人血浆温育,经Sephadex G-50柱层析后显示:实验组与对照组的洗脱液主放射峰形状基本一致,保留时间均出现在第42管;实验组在第16管左右出现小蛋白结合放射峰,约占6.61%(图 1)。99Tcm-TP1724与不同浓度半胱氨酸温育后,混合物中未结合99Tcm含量的变化见图 2;标记多肽脂/水分配系数lg P为-(1.99±0.02)。
|
| 图 1 Sephadex G-50柱层析洗脱液T-A曲线 |
|
| 图 2 99Tcm-TP1724与不同浓度半胱氨酸温育后未结合99Tcm的变化 |
2.3 健康家兔体内示踪动力学
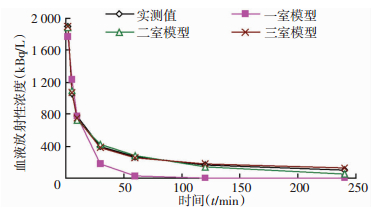
家兔血液平均放射性浓度-时间数据经DSA 3.1.6软件智能化分析判定,99Tcm-TP1724的示踪动力学符合权重为1的二室模型。以5号家兔为例,血液放射性浓度实测值与拟合不同室模型理论计算值的比较见图 3;药-时关系式C(t)=1 874.89e-14.03t+569.07e-0.63t,其中C是血液放射性浓度(kBq/L),t是注射99Tcm-TP1724后时间(min);示踪动力学的参数见表 2。
|
| 图 3 5号家兔血液放射性浓度实测值与不同室模型拟合值曲线(权重=1) |
| 室模型参数 | 参数值 |
| t1/2α(min) | 2.64±1.32 |
| t1/2β(min) | 78.36±13.38 |
| CL(mL/min) | 122.15±56.33 |
| K10(1/h) | 0.49±0.25 |
| K12(1/h) | 12.61±5.04 |
| K21(1/h) | 3.81±1.71 |
2.4 正常昆明小鼠的体内生物分布
99Tcm-TP1724经小鼠尾静脉注射后,60 min时血液放射性比1 min时血液放射性下降了98.43%,而肾脏放射性下降82.14%;肝脏放射性10 min 时开始降低,肠道放射性在30 min时出现增加;心脏、骨、肺的放射性快速减少,在60 min后基本接近肌肉;脑部持续性低放射分布(表 3)。
| 组织器官 | 1 min | 5 min | 10 min | 30 min | 60 min | 120 min | 240 min |
| 血液 | 16.52±1.21 | 6.10±0.41 | 2.85±0.56 | 0.85±0.11 | 0.26±0.08 | 0.15±0.01 | 0.11±0.04 |
| 心脏 | 4.01±0.48 | 1.66±0.20 | 0.88±0.22 | 0.31±0.06 | 0.11±0.03 | 0.07±0.01 | 0.05±0.01 |
| 肺 | 13.33±1.65 | 5.92±0.39 | 3.00±0.77 | 1.10±0.19 | 0.42±0.11 | 0.23±0.02 | 0.16±0.03 |
| 肾脏 | 22.84±5.82 | 20.30±3.66 | 12.44±1.38 | 8.77±1.09 | 4.08±0.66 | 3.95±0.63 | 2.67±0.78 |
| 肝脏 | 5.71±1.25 | 8.42±0.42 | 5.16±1.12 | 3.16±0.64 | 1.70±0.71 | 0.89±0.22 | 0.58±0.04 |
| 肠 | 3.43±0.47 | 1.73±0.22 | 0.91±0.19 | 7.60±0.10 | 2.54±1.99 | 2.26±2.30 | 1.52±1.32 |
| 骨骼 | 3.79±0.44 | 2.28±0.25 | 1.46±0.35 | 0.61±0.16 | 0.30±0.06 | 0.30±0.18 | 0.28±0.13 |
| 肌肉 | 2.18±0.31 | 1.42±0.34 | 0.93±0.32 | 0.37±0.09 | 0.27±0.11 | 0.25±0.09 | 0.25±0.10 |
| 脑 | 0.66±0.11 | 0.27±0.04 | 0.16±0.03 | 0.07±0.03 | 0.03±0.01 | 0.02±0.00 | 0.02±0.02 |
2.5 健康家兔显像
心脏、肝脏及双肾在1 min左右显影开始清晰,随时间双肾和肝脏的影像逐渐减弱;在5 min时膀胱清楚显影,随时间不断增强;心脏和软组织影在30 min时消退明显,并且胆囊可见显影,少量放射分布于肠道;整个显像中胃区域表现为放射性的缺损区,颈部无放射性异常浓聚影,脑部表现为低放射本底影(图 4)。注射99Tcm-TP1724以后动态显像的ROI分析(60 min内),心脏、双肾、肝脏、膀胱和肌肉T-A曲线见图 5。

|
| 图 4 健康家兔注射99Tcm-TP1724后不同时间平面显像(前位) |

|
| A:心脏;B:肝脏;C:右肾;D:左肾;E:膀胱;F:肌肉 图 5 家兔注射99Tcm-TP1724后1 h内动态显像主要脏器T-A曲线 |
3 讨论
受体显像属于分子影像范畴,其显像探针因分子量小、血液清除快、组织穿透力强、无免疫原性等优点,对病灶诊断灵敏度高、特异性强、准确性好,是分子核医学最活跃的前沿研究领域之一[9-10]。迄今,VIP受体显像探针有99Tcm、123I、18F和64Cu标记的VIP全分子或其类似物,尽管临床应用有限,但该技术能灵敏探测人体VIP受体阳性的结直肠癌、乳腺癌、胃肠道神经内分泌肿瘤、胰腺癌等肿瘤原发和/或转移灶[6, 11]。然而,上述显像探针缺乏针对VPAC1的高特异性;此外,123I、18F、64Cu则需加速器生产,并需配备有PET/CT,且检查费用昂贵,临床推广应用受到极大限制。
迄今,99Tcm标记药物占临床用显像剂的80%[10]。99Tcm来源于发生器(99Mo-99Tcm),物理性质优良,价格便宜,来源方便,冻干试剂盒制备简单可行,临床应用前景很好。99Tcm标记的多肽分为间接法和直接法两种:间接法需在多肽分子上(多为氨基或羧基末端)偶联双功能螯合剂(bifunctional chelating agent,BCA),通过99Tcm与BCA络合实现对多肽的标记,其优点为对多肽生物结合活性影响比较小;而多肽分子内含有二硫键的用直接法,由于需要结合基团与99Tcm络合,所以标记前要把二硫键还原为巯基,优点是多肽结构不需要修饰,缺点是标记的反应条件要求高且剧烈,易于影响多肽的生物结合活性;所以最常用的方法是间接法。
现在,99Tcm与多肽间接标记除了使用含N4、N2S2、N3S1等四配体的BCA外,还有HYNIC等。其中含N2S2、N3S1的BCA标记通常需加热煮沸;HYNIC的标记则需加入共轭配体tricine或EDDA等,标记温度要求同前。本项目用含N4的G(D)AGG四肽作为BCA,γ氨基丁酸(Aba)作为连接结构,以达到减少99Tcm与G(D)AGG螯合后可能对VP2与VPAC1结合的空间位阻影响。本标记方法简便,常温下、pH≈10的碱性条件完成标记,标记溶液pH调节至中性,产物99Tcm-TP1724的标记率为(96.57±0.71)%,表明标记后无需分离纯化可直接使用,可制备成一步法标记冻干试剂盒,便于临床推广应用;99Tcm-TP1724比活度为(25.52±0.29)TBq/mmol,满足开展体内外受体研究的要求;室温放置4 h后,99Tcm-TP1724放化纯度为(93.64±2.25)%,提示其良好的体外稳定性。
满足要求的受体显像探针除了具有与靶分子高亲和力、高特异性结合,还应满足血液清除快、体内稳定性好、组织分布迅速、主要经泌尿系统排泄等要求。本研究制备的99Tcm-TP1724分子量小,体内分布实验60 min 时血液放射性仅为1 min的1.57%(表 3),家兔显像5 min心影明显消退,与示踪动力学分布半衰期t1/2α为2.64 min的结果相一致,表明99Tcm-TP1724经静脉注射后血液清除快、体内分布迅速。半胱氨酸置换实验显示,未结合99Tcm与对照组相比无明显增加(图 2);家兔甲状腺区域显示为软组织的本底影,胃部显像始终是放射性缺损状态(图 4)。这表明99Tcm与G(D)AGG 螯合牢固不易脱99Tcm,说明99Tcm-TP1724体内稳定性良好。
受体显像探针与血浆蛋白的结合程度关系到注射后短时间内显像能否获得高信/噪比图像,若结合率过高,则靶/非靶比值降低,进而影响对病灶探测的灵敏度。99Tcm-TP1724 与血浆蛋白结合率仅为6.61%(图 1),从生物分布、示踪动力学及显像实验相关结果可知,该结合率对血液放射性的快速清除及心脏、肺、肌肉等组织放射性消退速度并无明显影响。99Tcm-TP1724的脂水分配系数为-(1.99±0.02),提示其为亲水性。生物分布实验肾脏60 min的放射性与1 min相比下降82.14%(表 3);家兔显像ROI分析,5 min双肾和膀胱放射性占全身放射性的27.3 %,30 min膀胱放射性占全身放射性的43%(图 4);表明99Tcm-TP1724静脉注射后体内放射性主要经泌尿系统快速排泄;脑表现为本底影,低放射性分布,说明99Tcm-TP1724不容易穿透血脑屏障,用于检测血脑屏障是否完整。小鼠体内生物分布表明:肝脏的放射性开始下降在10 min左右,肠道的放射性开始出现增加是在30 min左右;家兔显像的ROI分析:5 min时肝脏与全身放射性比为18.3%,但到30 min时降低至5%,胆囊同时开始显影,少量的放射性浓聚影在肠道内出现。有少部分放射性在肝胆系统分泌,在实际操作中延迟显像可减少对腹部病灶探测的影响。
示踪动力学研究显示,99Tcm-TP1724在健康家兔体内的动力学过程符合权重为1的二室模型。其中分布相半衰期t1/2α为(2.64±1.32)min,表明静脉注入的99Tcm-TP1724自血液循环通过毛细血管快速分布于组织间液,体现了血液中小分子多肽清除快,有助于减少大血管影和心脏对早期显像的干扰;消除相的半衰期t1/2β为(78.36±13.38)min,表明组织间液内放射性的消退相对缓慢。结合周边室与中心室之间的转运速率常数K12约为K21的3.3倍(表 2),即99Tcm-TP1724在体内达到分布的短时间平衡时,离开组织液(中心室)明显慢于进入速度,在病理情况下,保证99Tcm-TP1724与组织细胞(高表达VPAC1)有充分的时间结合。
考虑用小鼠做体内分布研究,是因为小鼠的各器官组织比较小,更能方便完整的收集和测量其放射性;正常小鼠体内分布研究结果为正常家兔显像提供了实际的数据支持,而且家兔显像结果也证明了小鼠体内分布数据的正确性;小鼠由于体积太小,机器分辨率不够,所以选择体积较大的家兔用于显像研究。
综上所述,本研究制备的99Tcm-TP1724方法简便,采用间接法的标记率>95%,可直接应用,无需分离纯化,冻干试剂盒易于制备(一步标记法),便于保存备用;标记率和比活度高,符合受体体内外研究要求;血液中快速清除,大部分排泄是经过泌尿系统;稳定性好、体内动力学性质优良,为进一步开展VPAC1阳性肿瘤显像实验研究奠定了基础。
| [1] | 唐波, 黄定德, 郑磊, 等. 噬菌体展示肽库筛选VPAC1高亲和力结合多肽[J]. 第三军医大学学报,2013, 35 (1) : 10 –14. DOI:10.16016/j.1000-5404.2013.01.005 |
| [2] | Reubi J C, Laderach U, Waser B, et al. Vasoactive intestinal peptide/pituitary adenylate cyclase-activating peptide receptor subtypes in human tumors and their tissues of origin[J]. Cancer Res,2000, 60 (11) : 3105 –3112. |
| [3] | Virgolini I, Yang Q, Li S, et al. Cross-competition between vasoactive intestinal peptide and somatostatin for binding to tumor cell membrane receptors[J]. Cancer Res,1994, 54 (3) : 690 –700. |
| [4] | Tang B, Yong X, Xie R, et al. Vasoactive intestinal peptide receptor-based imaging and treatment of tumors (Review)[J]. Int J Oncol,2014, 44 (4) : 1023 –1031. DOI:10.3892/ijo.2014.2276 |
| [5] | Moody T W, Nuche-Berenguer B, Jensen R T. Vasoactive intestinal peptide/pituitary adenylate cyclase activating polypeptide, and their receptors and cancer[J]. Curr Opin Endocrinol Diabetes Obes,2016, 23 (1) : 38 –47. DOI:10.1097/MED.0000000000000218 |
| [6] | Thakur M L, Zhang K, Berger A, et al. VPAC1 receptors for imaging breast cancer: a feasibility study[J]. J Nucl Med,2013, 54 (7) : 1019 –1025. DOI:10.2967/jnumed.112.114876 |
| [7] | Tang B, Li Z, Huang D, et al. Screening of a specific peptide binding to VPAC1 receptor from a phage display peptide library[J]. PLoS One,2013, 8 (1) : e54264 . DOI:10.1371/journal.pone.0054264 |
| [8] | 查林, 冯世斌, 郑磊, 等. 整合素αvβ3放射性配体99Tcm-TP1326的制备及其正常兔显像研究[J]. 第三军医大学学报,2012, 34 (3) : 235 –238. DOI:10.16016/j.1000-5404.2012.03.024 |
| [9] | Johnbeck C B, Knigge U, Kjaer A. PET tracers for somatostatin receptor imaging of neuroendocrine tumors: current status and review of the literature[J]. Future Oncol,2014, 10 (14) : 2259 –2277. DOI:10.2217/fon.14.139 |
| [10] | Fani M, Maecke H R. Radiopharmaceutical development of radiolabelled peptides[J]. Eur J Nucl Med Mol Imaging,2012, 39 (Suppl 1) : S11 –S30. DOI:10.1007/s00259-011-2001-z |
| [11] | Hessenius C, Bader M, Meinhold H, et al. Vasoactive intestinal peptide receptor scintigraphy in patients with pancreatic adenocarcinomas or neuroendocrine tumours[J]. Eur J Nucl Med,2000, 27 (11) : 1684 –1693. DOI:10.1007/s002590000325 |





