随着人们生活方式的改变,妊娠合并糖尿病的发病率明显上升,危害孕妇和胎儿的健康。据文献报道,妊娠期糖尿病导致妊高症、早产、新生儿窒息、巨大儿的发生率明显升高[1]。大量文献证明,高浓度葡萄糖具有神经毒性作用:过多的氧自由基以及糖基化终末产物的产生[2]。但是高浓度葡萄糖对多巴胺神经元发育的影响却鲜有报道。既往研究表明斑马鱼中多巴胺神经元主要分布在嗅球、端脑背侧区、视前区、腹侧和背侧丘脑、后结节、肾小球前区和延髓[3]。受精后18 h的斑马鱼胚胎,多巴胺神经元在后结节开始分化,神经系统在受精后4 d已完全形成[4],因此, 在胚胎时期可以观察到斑马鱼神经系统。本文使用斑马鱼作为模式动物,体外模拟妊娠高糖环境,研究高浓度葡萄糖对斑马鱼胚胎发育以及斑马鱼多巴胺神经元发育的影响,为临床治疗妊娠期糖尿病提供实验依据。
1 材料与方法 1.1 动物模型制备本实验使用Vmat-GFP转基因斑马鱼(中科院上海神经科学研究所杜久林教授馈赠),养殖系统为北京爱森公司净水系统,控制温度28.5~29.5℃,盐度0.03%~0.04%,pH值为7.2~7.6;光照/黑夜为14 h:10 h。于晚上8:00选取性成熟的斑马鱼,1∶1雌雄配对,次日8:00给予光照,斑马鱼自然产卵,收集受精卵,剔除死胚。
实验分3组:(1)空白对照(CON)组;(2)葡萄糖实验(25 mmol/L葡萄糖)组[5];(3)甘露醇对照(25 mmol/L甘露醇)组,每组30枚胚胎,28.5℃培养箱中培养,每隔12 h观察胚胎并拍照记录。当胚胎发育到24 h时,加入0.296 mmol/L的1-苯基-2-硫脲(PTU)[6],去除黑色素。
1.2 主要试剂及仪器葡萄糖、甘露醇、三卡因、1-苯基-2-硫脲购自Sigma公司;Tripure、逆转录试剂盒、荧光定量PCR试剂盒购自罗氏公司。使用仪器包括Bio-Rad公司实时荧光定量PCR扩增仪,Olympus FV-1000激光共聚焦显微镜,OlympusSZX16体视荧光显微镜。
1.3 方法 1.3.1 斑马鱼胚胎发育观察使用体视荧光显微镜,每隔12 h观察斑马鱼胚胎,记录死亡数、畸形数并拍照。当胚胎发育到48 h,记录孵化率。3 d提取总RNA并逆转cDNA,4 d使用激光共聚焦显微镜观察多巴胺神经元的发育。
1.3.2 实时荧光定量PCR高糖处理后,胚胎发育到3 d,收集胚胎,TRIpure(即TRIzol)法提取总RNA。按逆转录试剂盒说明书制备cDNA,染料法进行实时荧光定量PCR,β-actin作为内参基因。β-actin引物序列:上游5′-TGGCAAAGGGAGGTAGTTG-3′,下游5′-GTGAGGAGGGCAAAGTGG-3′,产物长度232 bp;Pink1引物序列:上游5′-GGCAATGAAGATGATGTGGAAC-3′,下游5′-TTGTGGGCATGAAGGAACTAAC-3′,产物长度251 bp;Parkin引物序列:上游5′-GAGGAGT-TTCACGAGGGTCC-3′,下游5′-TGAGTGGTTTTGGTGA-TGGTC-3′,产物长度243 bp;Dj-1引物序列:上游5′-CCTGCTGTGAAAGAGGTGTTG-3′,下游5′-ACTGTGC-TGCCATATGCAATAC-3′,产物长度223 bp;Larrk2引物序列:上游5′-GGATCTGTCACAGATTGGTG-3′,下游5′-CTAGTGGAATATCTGCGGAC-3′,产物长度261 bp。反应条件: 95℃预变性10 min,95℃变性10 s,60℃退火15 s,72℃延伸20 s。第二步开始读板,5 s读板1次,39个循环,溶解曲线65℃到95℃。
1.4 统计学分析采用Graphpad 5统计软件,数据以x±s表示,组间比较用独立样本t检验。当P < 0.05时,差异具有统计学意义。
2 结果 2.1 高糖致斑马鱼胚胎死亡率增加重复实验取平均值,正常组死亡率57.66%,葡萄糖组死亡率85%,甘露醇组死亡率51.33%。使用t检验分析,与正常组相比高糖组死亡率明显增加(P < 0.05)。甘露醇组死亡率与正常组相比无明显变化。说明死亡率的增高是由高浓度葡萄糖溶液引起。
2.2 高糖致斑马鱼心脏发育畸形斑马鱼胚胎发育至80 h,空白对照组斑马鱼胚胎孵化成幼鱼,形态正常,心血管系统等无畸形。葡萄糖实验组相比于空白对照组与甘露醇对照组,胚胎体长减少(图 1B)、心脏发育畸形:心室、心房肥大(图 1E箭头所示)、心包积液(图 1E黑色圆点所示)。甘露醇对照组胚胎正常发育(图 1F)。统计学分析发现,葡萄糖实验组斑马鱼心脏发育畸形率(33.3±8.8)%明显高于空白对照组(3.3±3.3)%和甘露醇组(6.7±3.4)%。说明高糖造成胚胎异常发育具有特异性作用,并不是由渗透压等其他原因引起。
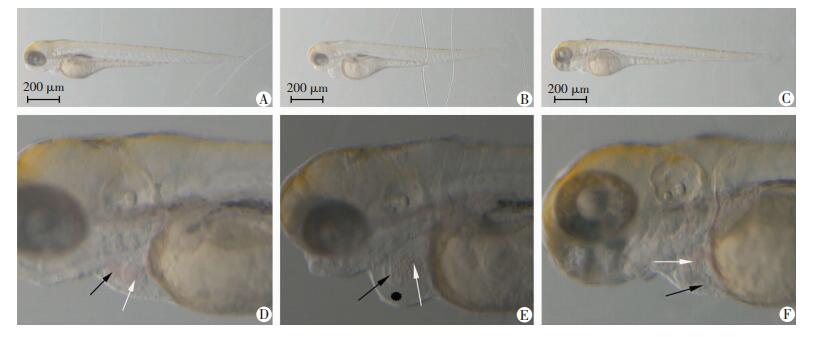
|
| A:空白对照组;B:葡萄糖实验组;C:甘露醇对照组:A~C分别为下斑马鱼发育低倍图片; D~F分别为A~C的局部放大黑色箭头示心室,白色箭头示心房,黑色圆点示心包 图 1 体视显微镜观察高糖致斑马鱼心脏发育畸形 |
2.3 高糖致斑马鱼胚胎未孵化数增加
温度28.5℃,斑马鱼受精卵发育到48 h胚胎完全出卵壳。48 h时,空白对照组胚胎未孵化数平均值为2(图 2A),葡萄糖实验组未孵化数均值为16(图 2B),与空白对照组相比差异具有统计学意义(P < 0.05)。甘露醇对照组与空白对照组近似,未孵化数平均值为2(图 2C),说明高糖影响了胚胎的孵化。
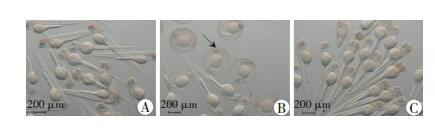
|
| A:空白对照组;B:葡萄糖实验组;C:甘露醇对照组黑色箭头示未出卵壳的胚胎 图 2 体视显微镜观察各组斑马鱼胚胎孵化 |
2.4 高糖致斑马鱼胚胎发育速度减慢
实验记录胚胎31、57、80 h胚胎发育情况,图 3中箭头所示为胚胎发育明显迟缓的特征,随着胚胎的发育卵黄缓慢被吸收,卵黄的大小以及心脏发育的程度可以代表胚胎发育的不同阶段。在相同条件下空白对照组胚胎发育到原基-15期时,葡萄糖实验组胚胎发育到原基-5期,大约晚3 h(图 3)。随着时间的推移,葡萄糖实验组发育迟缓现象越加严重。当空白对照组胚胎发育到早幼期时,葡萄糖实验组胚胎发育停留在孵化期(图 3),发育迟缓现象越加明显,发育迟缓率达80%。空白对照组发育迟缓胚胎数(0.33±0.33),葡萄糖实验组为(21.67±1.45),显著高于空白对照组(P < 0.05),甘露醇组为(2.23±0.88)。甘露醇组与正常组相比出现了部分的迟缓现象,但差异并不具有统计学意义。
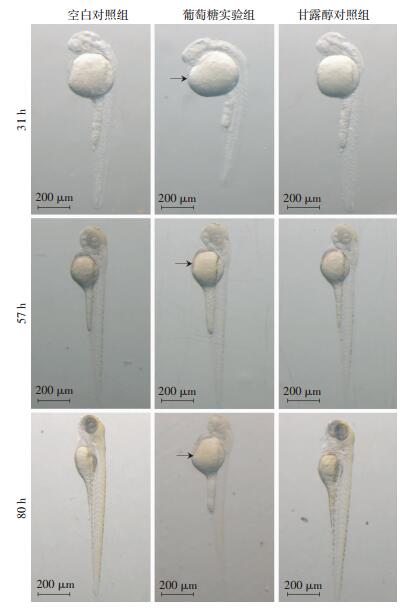
|
| 图 3 体视显微镜观察高糖致斑马鱼胚胎发育速度减慢 |
2.5 高糖致斑马鱼胚胎多巴胺能神经元数量增多
当vmat-GFP(GFP标记的囊泡转运体转基因斑马鱼)胚胎发育到4d,使用激光共聚焦拍摄多巴胺神经元的发育情况。葡萄糖实验组胚胎与空白对照组,甘露醇对照组相比,端脑部位多巴胺神经元荧光增强、数量增多(图 4B箭头所示)。而其他部位多巴胺神经元无明显变化。说明高糖在胚胎发育的早期对端脑部位多巴胺神经元具一定营养作用。
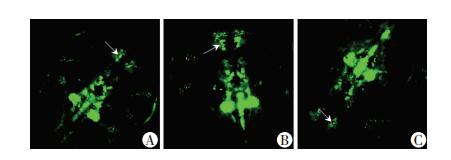
|
| A:空白对照组;B:葡萄糖实验组;C:甘露醇对照组箭头示斑马鱼端脑部位多巴胺神经元 图 4 共聚焦显微镜下观察vmat-GFP转基因斑马鱼多巴胺神经元数量的变化(×400) |
2.6 高糖致帕金森病相关基因表达升高
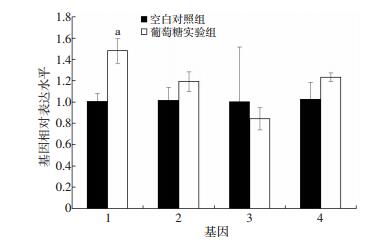
当胚胎发育到3 d,提取总RNA,使用荧光定量PCR检测PD(帕金森病)相关基因Parkin、Pink1、Dj-1、Larrk2的表达水平。Parkin表达水平的上升具有统计学意义(图 5),其余3个基因表达水平的变化差异均无统计学意义(图 5)。表明Parkin基因的高表达对神经元细胞具有一定的保护作用。
|
| 1:Parkin;2 :Pink1;3:Dj-1;4:Larrk2;a:P < 0.05,与空白对照组比较 图 5 荧光定量PCR检测帕金森病相关基因表达 |
3 讨论
临床流行病学研究表明,妊娠高糖影响胎儿发育[1]。有研究发现,体外实验中高糖可能导致胚胎致畸率升高[7],高血糖对早期胚胎的发育具有毒性作用。Chen等[8]使用鹌鹑胚胎在钝端开口注入25 mmol/L高糖溶液进行培养,发现巨大胚胎、肢芽、神经管发育异常,周围神经发育缺失。有研究表明妊娠糖尿病母体PPAGRC1A启动子的改变,是一个潜在的影响后代发育的机制[9]。血清中脂联素水平的降低导致患妊娠期糖尿病的风险增高[10]。本研究发现25 mmol/L的葡萄糖溶液导致斑马鱼胚胎发育异常、生长缓慢、死亡率增加以及心脏畸形,与文献报道的哺乳动物、鸟类妊娠期糖尿病对胚胎发育影响的研究结果相似[11-13]。
神经元需要持续性高糖输入,不受胰岛素调节的影响。神经元内正常水平的葡萄糖,在己糖激酶的作用下磷酸化并糖酵解供能,当葡萄糖水平升高时,葡萄糖进入多元醇通路,增加NADPH的消耗,损害谷胱甘肽的抗氧化能力。6-磷酸果糖将进入己糖胺通路。3-油酸甘油醛进入糖基化终末产物通路,产生大量的糖基化终末产物损害细胞[2]。妊娠期糖尿病中胎儿心血管和神经管发育缺陷是最常见的疾病。妊娠期糖尿病胎儿出生后精细动作异常、注意力缺陷、多动障碍、学习困难,自闭症的发生率增高。作用机制涉及氧化应激,缺氧,细胞凋亡和表观遗传的改变[14]。有研究发现妊娠高血糖导致大鼠胚胎的下丘脑易受攻击[15],雄性后代出生后1 d表现为体重不足,21 d后胰岛素水平提高,体质量继续减少。刚出生的幼鼠中下丘脑整个区域NE(去甲肾上腺素)和DA(多巴胺)的水平增加。妊娠高血糖大鼠的雌性后代产后21 d,在下丘脑腹内侧核和下丘脑腹外侧核NE显著增加,在室旁下丘脑和下丘脑腹外侧核DA显著升高。TH抗体标记DA神经元,定位室旁下丘脑和室周下丘脑区的神经内分泌小细胞,发现神经元密度显著增加。本研究观察到4 d时,斑马鱼端脑DA神经元数量增多,荧光增强。25 mmol/L葡萄糖溶液对多巴胺的发育具有一定的营养作用。作者推测该营养作用可能是导致胎儿后天多动症发生率升高的原因之一。
近十几年来,关于PD发病机制的研究围绕着线粒体功能的紊乱。在体外实验中将人脐静脉内皮细胞培养在30 mmol/L的葡萄糖中,发现血管黏附分子1水平增加和活性氧(ROS)的产生,线粒体功能紊乱[16]。在尸检中发现葡萄糖的代谢异常是PD早期发病的重要特征[17]。近年来Parkin的发现为线粒体功能的混乱促进PD的发病进程提供理论支持。PARKIN蛋白具有E3泛素连接酶功能,参与泛素-蛋白水解酶系统降解细胞内不需要的蛋白,从而保护细胞免受损伤。PARKIN蛋白与pink1能够直接结合,二者通过泛素蛋白酶体降解系统相互调节,协同参与帕金森病的致病过程[18]。在线粒体毒素诱导的细胞损伤模型中,Parkin的高表达可以对细胞起到保护作用[19]。据文献[20]报道,PARKIN蛋白位于突触囊泡膜上,并与突触传递相关。Rothfuss等[21]报道Parkin可与线粒体DNA直接结合,从而保护线粒体免受活性氧的损伤,并能激发线粒体的自我修复功能。Wang等[22]报道去泛素化蛋白酶usp30能够延缓线粒体自噬通过阻碍PARK2/Parkin募集到线粒体。本实验使用荧光定量PCR,在转录水平观察Parkin、Pink1、Larrk2、Dj-1表达水平的变化,发现Pink1、Parkin、Larrk2的表达水平上调,但只有Parkin表达的上调具有统计学意义。Dj-1表达水平下调,但不具有统计学意义。说明在高糖环境下,多巴胺神经元的发育并未受到影响,可能是通过上调Parkin的表达,调节细胞内线粒体的功能,对多巴胺的发育提供保护作用。
| [1] | 赵志丹. 102例妊娠期糖尿病的观察与护理[J]. 当代护士:学术版,2006 (8) : 58 –60. DOI:10.3969/j.issn.1006-6411.2006.08.042 |
| [2] | Tomlinson D R, Gardiner N J. Glucose neurotoxicity[J]. Nat Rev Neurosci,2008, 9 (1) : 36 –45. DOI:10.1038/nrn2294 |
| [3] |
杜雨晨.斑马鱼多巴胺神经元发育及逆行退变作用与机理研究[D].成都:成都医学院, 2015. |
| [4] | Schweitzer J, Driever W. Development of the dopamine systems in zebrafish[J]. Adv Exp Med Biol,2009, 651 : 1 –14. DOI:10.1007/978-1-4419-0322-8_1 |
| [5] | Liang J, Gui Y, Wang W, et al. Elevated glucose induces congenital heart defects by altering the expression of tbx5, tbx20, and has2 in developing zebrafish embryos[J]. Birth Defects Res A Clin Mol Teratol,2010, 88 (6) : 480 –486. DOI:10.1002/bdra.20654 |
| [6] | 张利军, 史慧勤, 苑晓燕, 等. 1-苯基-2-硫脲对斑马鱼胚胎发育与黑色素生成的影响[J]. 中国比较医学杂志,2012, 22 (9) : 21 –25. DOI:10.3969/j.issn.1671-7856.2012.009.005 |
| [7] | 罗晓敏, 邹海燕, 尹芳, 等. 高浓度葡萄糖对昆明小鼠早期胚胎发育的影响[J]. 生命科学研,2008, 12 (4) : 347 –350. DOI:10.16605/j.cnki.1007-7847.2008.04.015 |
| [8] | Chen Y, Fan J X, Zhang Z L, et al. The negative influence of high-glucose ambience on neurogenesis in developing quail embryos[J]. PLoS One,2013, 8 (6) : e66646 . DOI:10.1371/journal.pone.0066646 |
| [9] | Xie X, Gao H, Zeng W, et al. Placental DNA methylation of peroxisome-proliferator-activated receptor-γco-activator-1αpromoter is associated with maternal gestational glucose level[J]. Clin Sci (Lond),2015, 129 (4) : 385 –394. DOI:10.1042/CS20140688 |
| [10] | Pala H G, Ozalp Y, Yener A S, et al. Adiponectin levels in gestational diabetes mellitus and in pregnant women without glucose intolerance[J]. Adv Clin Exp Med,2015, 24 (1) : 85 –92. DOI:10.17219/acem/38141 |
| [11] | Casey B M, Mele L, Landon M B, et al. Does maternal body mass index influence treatment effect in women with mild gestational diabetes?[J]. Am J Perinatol,2015, 32 (1) : 93 –100. DOI:10.1055/s-0034-1374815 |
| [12] | Nadif R, Dilworth M R, Sibley C P, et al. The maternal environment programs postnatal weight gain and glucose tolerance of male offspring, but placental and fetal growth are determined by fetal genotype in the Leprdb/+ model of gestational diabetes[J]. Endocrinology,2015, 156 (1) : 360 –366. DOI:10.1210/en.2014-1562 |
| [13] | Tan R R, Zhang S J, Tsoi B, et al. A natural product, resveratrol, protects against high-glucose-induced developmental damage in chicken embryo[J]. J Asian Nat Prod Res,2015, 17 (5) : 586 –94. DOI:10.1080/10286020.2015.1043901 |
| [14] | Ornoy A, Reece E A, Pavlinkova G, et al. Effect of maternal diabetes on the embryo, fetus, and children: congenital anomalies, genetic and epigenetic changes and developmental outcomes[J]. Birth Defects Res C Embryo Today,2015, 105 (1) : 53 –72. DOI:10.1002/bdrc.21090 |
| [15] | 龚普盛, 张建亮, 付越姣, 等. 过表达PINK1抵抗鱼藤酮引起多巴胺神经元损伤的研究[J]. 中国生物工程杂志,2012, 32 (2) : 33 –38. DOI:10.13523/j.cb.20120206 |
| [16] | Dymkowska D, Drabarek B, Podszywałow-Bartnicka P, et al. Hyperglycaemia modifies energy metabolism and reactive oxygen species formation in endothelial cells in vitro[J]. Arch Biochem Biophys,2014, 542 : 7 –13. DOI:10.1016/j.abb.2013.11.008 |
| [17] | Dunn L, Allen G F, Mamais A, et al. Dysregulation of glucose metabolism is an early event in sporadic Parkinson’s disease[J]. Neurobiol Aging,2014, 35 (5) : 1111 –1115. DOI:10.1016/j.neurobiolaging.2013.11.001 |
| [18] | 王雪晶, 郭纪锋, 江泓, 等. 帕金森病相关蛋白Parkin与PINK1的相互作用研究[J]. 生物化学与生物物理进展,2010, 37 (9) : 983 –987. DOI:10.3724/SP.J.1206.2009.00612 |
| [19] | Johnson B N, Berger A K, Cortese G P, et al. The ubiquitin E3 ligase parkin regulates the proapoptotic function of Bax[J]. Proc Natl Aead Sci USA,2012, 109 (16) : 6283 –6288. DOI:10.1073/pnas.1113248109 |
| [20] | Kubo S J, Kitami T, Noda S, et al. Parkin is associated with cellular vesicles[J]. Neurochem,2001, 78 (1) : 42 –54. DOI:10.1046/j.1471-4159.2001.00364.x |
| [21] | Rothfuss O, Fischer H, Hasegawa T, et al. Parkin protects mitochondrial genome integrity and supports mitochondrial DNA repair[J]. Hum Mol Genel,2009, 18 (20) : 3832 –3850. DOI:10.1093/hmg/ddp327 |
| [22] | Wang Y, Serricchio M, Jauregui M, et al. Deubiquitinating enzymes regulate PARK2-mediated mitophagy[J]. Autophagy,2015, 11 (4) : 595 –606. DOI:10.1080/15548627.2015.1034408 |



