2. 儿童发育疾病研究省部共建教育部重点实验室,儿科学重庆市重点实验室,重庆市儿童发育重大疾病诊治与预防国际科技合作基地
2. Key Laboratory of Developmental Diseases in Childhood Co-founded by Chongqing and Ministry of Education, Chongqing Key Laboratory of Pediatrics, Chongqing International Science and Technology Cooperation Center for Child Development and Disorders, Chongqing Medical University, Chongqing, 400014, China
利用MRI报告基因成像对移植细胞进行活体示踪是当前分子影像学领域的研究热点之一[1-4]。铁蛋白重链(ferritin heavy chain 1, FTH1)是目前研究较多且较成熟的磁共振成像(magnetic resonance imaging, MRI)报告基因,已广泛用于多种类型细胞的示踪研究[1-3]。目前多数研究结果显示,由于FTH1基因整合到细胞的基因组,其表达不受细胞分裂增殖的影响[5],但是否受干细胞诱导分化的影响目前尚不明确。本研究拟通过构建携带FTH1基因的慢病毒载体,感染骨髓间充质干细胞(mesenchymal stem cells, MSCs),将MSCs向神经元样细胞诱导分化,并检测FTH1的表达情况,探讨FHT1基因表达对干细胞成神经分化的影响,以及MSCs成神经分化对FTH1基因表达的影响,明确FTH1在神经元样细胞内的聚铁能力是否能够引起足够的MRI信号改变,为进一步实现体内干细胞神经分化的MRI活体示踪奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞取4~6周SD大鼠(体质量40~60 g,雌雄不拘),分离四肢,完全培养基冲洗四肢长骨骨髓腔,离心,重悬冲洗液,全骨髓贴壁法提取MSCs。
1.1.2 目的基因、慢病毒载体和慢病毒包装系统FTH1基因委托上海吉凯基因化学技术有限公司合成,带有巨细胞病毒启动子的慢病毒载体质粒CMV-MCS-3Flag-Puro及慢病毒包装系统pHelper 1.0和pHelper 2.0由上海吉凯基因化学技术有限公司提供。
1.1.3 主要试剂DMEM/F12及胎牛血清(Gibco 公司),枸橼酸铁铵(ferric ammonium citrate, FAC;Sigma 公司),CCK-8试剂盒(Beyotime公司),普鲁士蓝染色试剂盒(广州凯秀贸易有限公司),细胞全蛋白提取试剂盒(南京钟鼎生物技术有限公司)。Western blot: 一抗rabbit anti-FTH1(Abcam公司),mouse anti-β-actin(南京钟鼎生物技术有限公司),二抗goat anti-rabbit(Abgent公司),goat anti-mouse(genscript公司);免疫荧光:一抗mouse anti-NSE,rabbit anti-nestin,rabbit anti-MAP2,二抗goat anti-mouse,goat anti-rabbit均购自Proteintech公司。
1.2 实验方法 1.2.1 携带FTH1基因的慢病毒重组人工合成 FTH1基因的cDNA序列,经PCR扩增、EcoRⅠ和AgeⅠ双酶切后与纯化的带有巨细胞病毒启动子的慢病毒空载体CMV-MCS-3Flag-Puro连接,获得重组慢病毒载体质粒CMV-FTH1-3Flag-Puro(pLV-FTH1)。经PCR和DNA测序鉴定成功后,将pLV-FTH1、包装质粒pHelper 1.0和包膜质粒pHelper 2.0共转染293T细胞后获得携带FTH1基因的重组慢病毒,命名为LV-FTH1。ELISA法测定病毒滴度。
1.2.2 MSCs的鉴定取第3代生长状态良好的细胞,0.25%胰酶消化,4 ℃离心(1 000 r/min,5 min),PBS(含1% BSA)清洗3次,各管依次加入单克隆抗体CD29、CD90、CD34、CD45,同时每管设立同型阴性对照。避光孵育30 min,再用PBS清洗3次,最后用200 μL PBS重悬细胞,流式细胞仪检测分析。
1.2.3 报告基因转染及细胞筛选①选取处于对数生长期、生长状态良好的MSCs接种于6孔板内,待细胞融合度达30%~40%时,加入经预实验确定好的最佳转染复数(MOI=20)的慢病毒LV-FTH1,24 h后更换培养基,继续培养。②48 h后加入4 μg/mL嘌呤霉素筛选7 d,获得稳定表达抗药基因的携带FTH1的MSCs细胞,命名为MSCs-FTH1。③取一定量未转染病毒的MSCs、转染空载病毒的细胞(MSCs-LV)和稳定表达抗药基因的细胞MSCs-FTH1,全蛋白试剂盒提取蛋白,BCA法测定蛋白浓度,Western blot检测FTH1基因表达产物。
1.2.4 MSCs体外成神经诱导分化将生长状态良好的MSCs-FTH1接种在24孔培养板中,当细胞融合度达70%~80%,加入含0.5 μmol/L全反式维甲酸(all-trans retinoic acid, ATRA)的新鲜培养基,作用24 h后,吸出原培养基,PBS洗涤3次,然后加入神经细胞诱导液诱导24 h[6],所获得的细胞为神经元样细胞,命名为Neurons-FTH1。同时将MSCs按上述方法诱导成神经元样细胞,命名为Neurons,作为阴性对照。接着采用免疫荧光方法检测Neurons-FTH1和Neurons细胞的神经元特异性标志物巢蛋白(Nestin)、神经元特异性烯醇化酶(neuron specific enolase, NSE)、微管相关蛋白-2(microtubule-associated protein, MAP-2)的表达[7-9]。
1.2.5 Western blot检测细胞分化前后FTH1表达将细胞分为不携带FTH1基因分化细胞(Neurons)、携带FTH1基因分化细胞(Neurons-FTH1)、携带基因干细胞(MSCs-FTH1)和携带基因干细胞4次传代(MSCs-FTH1-P4)共4组,提取细胞全蛋白,采用BCA法测定蛋白浓度,SDS-PAGE电泳转至PVDF膜上,5% BSA封闭1 h后,β-actin 一抗(1∶1 000)和FTH1一抗(1∶1 000) 孵育并4 ℃过夜,二抗孵育2 h,最后利用ECL增强试剂发光显影,实验重复3次。
1.2.6 体外细胞MR成像4组细胞(MSCs、MSCs-FTH1、Neurons、Neurons-FTH1)分别加入500 μmol/L FAC 培养72 h后收集1×106个细胞,4%多聚甲醛固定10~15 min,PBS清洗数次后,将细胞重悬,移至0.5 mL PCR管内静置30 min后,在管底形成细胞沉淀,行3.0 T磁共振(Philips Achieva)扫描,扫描参数: 自旋回波(SE)T2WI: TR=2 200 ms,TE=80 ms,成像视野(FOV)=120 mm×120 mm,层厚1 mm, 层间0.1 mm。
1.2.7 普鲁士蓝染色将细胞分为4组:MSCs、MSCs-FTH1、Neurons和Neurons-FTH1组,分别以含 500 μmol/L FAC的培养基培养72 h。PBS漂洗3次,4% 多聚甲醛固定20 min,普鲁士蓝染色试剂(2%亚铁氰化钾和2% HCl等体积混合)常温下染色30 min,核固红染色2~3 min,ddH2O冲洗,中性树脂封片,光镜观察。
1.2.8 透射电镜将细胞分为4组:MSCs、MSCs-FTH1、Neurons和Neurons-FTH1组,分别以含500 μmol/L FAC的培养基培养72 h。PBS清洗3次,消化、离心、弃上清收集,注入电镜固定液,送电镜室制样并观察。
1.3 统计学方法采用SPSS 19.0统计软件对获得的数据进行处理,数据以x±s表示,不同处理组采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果 2.1 骨髓间充质干细胞的鉴定流式细胞仪检测到第3代MSCs表达表面标志物CD34、CD45、CD29、CD90,其中CD29、CD90阳性率分别为96.7%、99.2%,CD34、CD45阳性表达率为0.2%、0.1%。见图 1。

|
| 图 1 骨髓间充质干细胞的鉴定 |
2.2 FTH1基因转染MSCs及鉴定
Western blot结果显示,运用携带FTH1基因慢病毒载体转染MSCs获得的细胞(MSCs-FTH1)在蛋白条带21×103处见阳性条带,与FTH1基因表达产物铁蛋白理论大小相吻合,而空白组(MSCs)和感染空载病毒组(MSCs-LV)未见阳性条带(图 2)。

|
| 图 2 FTH1基因阳性表达产物的鉴定 |
2.3 MSCs成神经诱导分化前后的形态学变化
MSCs和MSCs-FTH1呈扁平或梭形,无折光性(图 3A、D);经ATRA 预诱导24 h后,细胞形态无明显变化,再经神经细胞诱导液诱导12 h后,部分MSCs和MSCs-FTH1形态发生较大改变:部分细胞透光性增强,细胞质向核中心固缩(图 3B、E),继续诱导至24 h后,细胞有长细的突起伸出,呈双极或多极向四周展开,且形成次级甚至多级突起,并与邻近细胞相连(图 3C、F)。

|
| A、D:分别为MSCs和MSCs-FTH1;B、E:分别为MSCs和MSCs-FTH1经神经细胞诱导液诱导12 h后细胞形态;C、F:分别为MSCs和MSCs-FTH1经神经细胞诱导液诱导24 h后细胞形态 图 3 骨髓间充质干细胞诱导成神经元样细胞 |
2.4 MSCs成神经分化前后神经元特异标志物表达
未分化的MSCs不表达神经元特异性标志物,经诱导分化成Neurons后可以检测到NSE、Nestin、MAP-2强阳性表达,MSCs-FTH1经诱导分化后的Neurons-FTH1仍可表达NSE、Nestin、MAP-2神经元特异性标志物(图 4)。

|
| 图 4 免疫荧光检测MSCs诱导前后神经元特异标志物 |
2.5 骨髓间充质干细胞分化前后FTH1的表达
Western blot结果显示:不含FTH1基因的Neurons细胞组无目的条带显示,而Neurons-FTH1、MSCs-FTH1和MSCs-FTH1-P4组细胞均显示明显的目的条带 (图 5A),后3组灰度比值组间两两比较,差异无统计学意义(图 5B,P>0.05)。这说明MSCs经4次传代后以及分化为神经元样细胞后,FTH1基因表达无明显变化。

|
|
1: Neurons;2: Neurons-FTH1;3: MSCs-FTH1;4: MSCs-FTH1-P4 A:Western blot检测结果;B:半定量分析 图 5 4组细胞内FTH1的表达 |
2.6 细胞MR成像
MSCs-FTH1、Neurons-FTH1、MSCs、Neurons经500 μmol/L FAC培养后行MRI扫描,结果显示:MSCs-FTH1、Neurons-FTH1细胞沉淀T2WI信号较MSCs、Neurons细胞明显减低,MSCs-FTH1、Neurons-FTH1细胞间信号无明显差异(图 6)。此结果证明分化后的神经元样细胞内FTH1仍旧明显表达,并促进细胞对FAC的摄取,从而引起MRI信号降低。
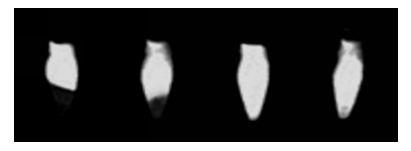
|
| 从左至右依次为MSCs-FTH1、Neurons-FTH1、MSCs和Neurons细胞 图 6 4组细胞MRI成像 |
2.7 FTH1聚铁效应
普鲁士蓝染色显示:4组细胞在加入枸橼酸铁铵后,细胞质内均可见较多蓝染颗粒,而对照组MSCs、Neurons未见蓝染颗粒(图 7)。透射电镜结果与普鲁士蓝染色结果一致,MSCs-FTH1细胞和Neurons-FTH1细胞的胞质内可见较多的黑色电子致密颗粒,对照组MSCs、Neurons无电子致密颗粒(图 8)。
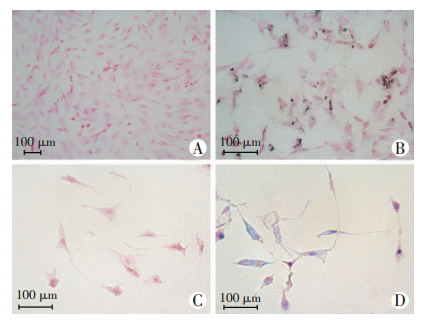
|
| 图 7 MSCs和MSCs-FTH1分化前后的普鲁士蓝染色观察 |
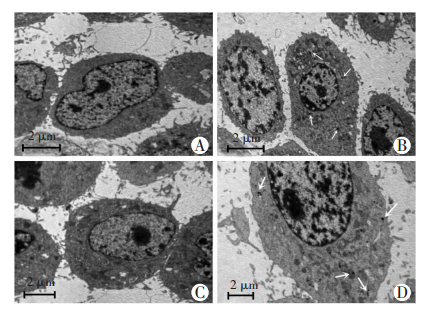
|
| 图 8 MSCs和MSCs-FTH1分化前后的透射电镜成像 |
3 讨论
MRI报告基因示踪策略的应用取决于报告基因能否在细胞内持续稳定地表达。在之前的研究中,已有研究者利用FTH1基因成功转染了多种细胞系,并证实细胞的分裂增殖不影响报告基因的表达[5, 10-12]。这些细胞主要用作靶向治疗的载体,仅仅通过其分裂增殖而不需要分化即可达到治疗的目的。然而用于组织修复目的的干细胞移植需要干细胞在病变部位的定向分化。要实现对这种移植细胞的长期示踪,就需要了解干细胞定向分化与报告基因表达之间的相互影响关系。本研究利用慢病毒载体将铁蛋白报告基因FTH1转染到MSCs内,在一定诱导条件下MSCs成功转化为神经元样细胞,这说明FTH1的转染对MSCs的成神经细胞分化潜能无明显影响。同时,诱导分化后的神经元样细胞虽然其形态和各种特异性标志物发生了变化,但细胞内FTH1依旧正常表达,提示干细胞成神经分化对报告基因的表达也没有明显的影响,这为进一步利用MRI报告基因成像对移植后MSCs的生物学行为进行长期示踪奠定了重要基础。
铁蛋白是生物体内普遍存在的一种储铁蛋白,包括重链(FTH1)和轻链两个多肽亚基。前者具有亚铁氧化酶活性,能在较低铁负荷情况下产生较高的横向弛豫率,从而引起MRI信号改变[13-15]。FTH1基因表达所产生的聚铁效应已被众多研究所证实[13, 16-18]。值得一提的是,Pereira等[11]研究表明,MSCs可以忍受铁蛋白的过度表达, 在培养基中补充足够的铁的情况下可以阻止细胞表型变化。Campan等[19]证实了在大鼠心肌梗死模型内,FTH1基因标记的干细胞移植到指定区域在一段时间后通过MRI仍可精确定位,并在组织学层面证实移植细胞和梗死区域的共区域化,标记细胞在移植部位成功存活并发生迁移。而Song等[5]在研究FTH1基因标记的人脂肪间充质干细胞分化为神经细胞时,证明了FTH1基因的表达对细胞的增殖未产生明显影响。这说明FTH1基因用于标记和追踪干细胞是可行的。
有研究表明FTH1基因标记的细胞摄入过量不稳定铁可能导致芬顿效应,引起胞内羧酸、醇、酯等的无机氧化对细胞造成破坏[2, 20]。而另一些研究中则认为,铁蛋白重链亚单位有催化不稳定二价铁离子与胞内羟基自由基反应生成三价铁离子的功能,从而削弱过量外源性铁摄入引起的芬顿效应对细胞的毒性作用[21-22]。铁离子的过量聚集对细胞的影响目前尚无统一定论,可能因细胞种类、铁离子作用浓度不同而呈现不同的结果,为了更安全地利用FTH1基因标记细胞,就需要寻找一种能够实现FTH1基因精确调控表达的方法。我们之前利用四环素基因表达调控系统成功地实现了报告基因的可诱导表达[13],即在需要成像时诱导基因表达,而不需要成像时使基因表达处于沉默状态,从而避免了基因持续过量表达对细胞的潜在损伤。在进一步的体内实验中,将利用这种可调控的报告基因成像系统对移植细胞的在体分化进行示踪研究。
本研究结果显示,在定向分化的神经元样细胞内,普鲁士蓝染色及电镜均有铁颗粒的存在,并且体外成像MRI可检测到明显的T2WI信号降低,较分化之前MSCs的聚铁能力无明显减弱。需要强调的是,本实验仅限于体外研究,为了验证FTH1的聚铁作用,在培养基中添加了一定浓度的FAC,而FTH1真正用于体内时其聚铁作用的发挥主要依靠对周围组织中铁离子的摄取。相对于单纯可控的体外实验条件,体内环境要复杂得多,在这种情况下,内源性铁离子的含量能否满足MRI成像的需要,细胞内基因表达及聚铁对细胞分化有无影响,以及分化后的细胞内报告基因是否继续表达等,这些问题均有待进一步体内实验研究证实。
本研究发现FTH1可表达于骨髓间充质干细胞及其定向分化的神经元样细胞内,通过MRI可以持续检测干细胞的增殖及分化过程。然而,在对移植细胞示踪的实际应用中,无论干细胞还是定向分化后的细胞,均有报告基因的表达,并表现为MRI信号的降低,因此,单纯依靠MRI报告基因成像无法区分这两种细胞。如何利用MRI活体判断干细胞是否已成功分化为某种特定的细胞,即利用MRI监测干细胞分化事件的发生,是目前本研究领域面临的一个难题,同时也是我们进一步研究的方向。
| [1] | Pereira S M, Herrmann A, Moss D, et al. Evaluating the effectiveness of transferrin receptor-1 (TfR1) as a magnetic resonance reporter gene[J]. Contrast Media Mol Imaging,2016, 11 (3) : 236 –244. DOI:10.1002/cmmi.1686 |
| [2] | Feng Y, Liu Q, Zhu J, et al. Efficiency of ferritin as an MRI reporter gene in NPC cells is enhanced by iron supplementation[J]. J Biomed Biotechnol,2012, 2012 : 434878 . DOI:10.1155/2012/434878 |
| [3] | Kim H S, Woo J, Choi Y, et al. Noninvasive MRI and multilineage differentiation capability of ferritin-transduced human mesenchymal stem cells[J]. NMR Biomed,2015, 28 (2) : 168 –179. DOI:10.1002/nbm.3236 |
| [4] | Cho I K, Moran S P, Paudyal R, et al. Longitudinal monitoring of stem cell grafts in vivo using magnetic resonance imaging with inducible maga as a genetic reporter[J]. Theranostics,2014, 4 (10) : 972 –989. DOI:10.7150/thno.9436 |
| [5] | Song C, Wang J, Mo C, et al. Use of Ferritin Expression, Regulated by Neural Cell-Specific Promoters in Human Adipose Tissue-Derived Mesenchymal Stem Cells, to Monitor Differentiation with Magnetic Resonance Imaging In Vitro[J]. PLoS One,2015, 10 (7) : e0132480 . DOI:10.1371/journal.pone.0132480 |
| [6] | 卓本慧, 李廷玉, 江和碧, 等. 全反式视黄酸在骨髓间充质干细胞向神经元分化中的作用研究[J]. 营养学报,2005, 27 (3) : 189 –192. DOI:10.3321/j.issn:0512-7955.2005.03.004 |
| [7] | 任铭新, 邓晓慧, 郭义威, 等. 碱性成纤维细胞生长因子对全脑缺血再灌注大鼠脑皮质内源性神经干细胞的影响[J]. 生物医学工程学杂志,2014, 31 (4) : 846 –849. DOI:10.7507/1001-5515.20140159 |
| [8] | Liu X, Zhang Z, Yan X, et al. The Rho kinase inhibitor Y-27632 facilitates the differentiation of bone marrow mesenchymal stem cells[J]. J Mol Histol,2014, 45 (6) : 707 –714. DOI:10.1007/s10735-014-9594-z |
| [9] | 龚敏. 视黄酸核受体β介导的ATRA对骨髓间充质干细胞成神经分化促进作用的实验研究[D]. 重庆: 重庆医科大学, 2012. |
| [10] | Yang Y, Gong M F, Yang H, et al. MR molecular imaging of tumours using ferritin heavy chain reporter gene expression mediated by the hTERT promoter[J]. Eur Radiol, 2016, [Epub ahead of print]. DOI: 10.1007/s00330-016-4259-9 |
| [11] | Pereira S M, Moss D, Williams S R, et al. Overexpression of the MRI Reporter Genes Ferritin and Transferrin Receptor Affect Iron Homeostasis and Produce Limited Contrast in Mesenchymal Stem Cells[J]. Int J Mol Sci,2015, 16 (7) : 15481 –15496. DOI:10.3390/ijms160715481 |
| [12] | Eid R, Boucher E, Gharib N, et al. Identification of human ferritin, heavy polypeptide 1 (FTH1) and yeast RGI1 (YER067W) as pro-survival sequences that counteract the effects of Bax and copper in Saccharomyces cerevisiae[J]. Exp Cell Res,2016, 342 (1) : 52 –61. DOI:10.1016/j.yexcr.2016.02.010 |
| [13] | He X, Cai J, Liu B, et al. Cellular magnetic resonance imaging contrast generated by the ferritin heavy chain genetic reporter under the control of a Tet-On switch[J]. Stem Cell Res Ther,2015, 6 : 207 . DOI:10.1186/s13287-015-0205-z |
| [14] | Moreno-Navarrete J M, Blasco G, Xifra G, et al. Obesity is associated with gene expression and imaging markers of iron accumulation in skeletal muscle[J]. J Clin Endocrinol Metab,2016, 101 (3) : 1282 –1289. DOI:10.1210/jc.2015-3303 |
| [15] | Naumova A V, Reinecke H, Yarnykh V, et al. Ferritin overexpression for noninvasive magnetic resonance imaging-based tracking of stem cells transplanted into the heart[J]. Mol Imaging,2010, 9 (4) : 201 –210. |
| [16] | Vidal R, Ghetti B, Takao M, et al. Intracellular ferritin accumulation in neural and extraneural tissue characterizes a neurodegenerative disease associated with a mutation in the ferritin light polypeptide gene[J]. J Neuropathol Exp Neurol,2004, 63 (4) : 363 –380. DOI:10.1093/jnen/63.4.363 |
| [17] | Vitrano A, Calvaruso G, Tese L, et al. Real-life experience with liver iron concentration R2 MRI measurement in patients with hemoglobinopathies: baseline data from LICNET[J]. Eur J Haematol, 2016. [Epub ahead of print]. DOI: 10.1111/ejh.12740 |
| [18] | Petrou E, Mavrogeni S, Karali V, et al. The role of magnetic resonance imaging in the evaluation of transfusional iron overload in myelodysplastic syndromes[J]. Rev Bras Hematol Hemoter,2015, 37 (4) : 252 –258. DOI:10.1016/j.bjhh.2015.03.014 |
| [19] | Campan M, Lionetti V, Aquaro G D, et al. Ferritin as a reporter gene for in vivo tracking of stem cells by 1.5-T cardiac MRI in a rat model of myocardial infarction[J]. Am J Physiol Heart Circ Physiol,2011, 300 (6) : H2238 –H2250. DOI:10.1152/ajpheart.00935.2010 |
| [20] | Kaur D, Rajagopalan S, Andersen J K. Chronic expression of H-ferritin in dopaminergic midbrain neurons results in an age-related expansion of the labile iron pool and subsequent neurodegeneration: implications for Parkinson’s disease[J]. Brain Res,2009, 1297 : 17 –22. DOI:10.1016/j.brainres.2009.08.043 |
| [21] | Fan Y, Liu C, Miao Q, et al. The effect of anti-inflammatory properties of ferritin light chain on lipopolysaccharide-induced inflammatory response in murine macrophages[J]. Biochim Biophys Acta,2014, 1843 (11) : 2775 –2783. DOI:10.1016/j.bbamcr.2014.06.015 |
| [22] | Zhao G, Arosio P, Chasteen N D. Iron(Ⅱ) and hydrogen peroxide detoxification by human H-chain ferritin. An EPR spin-trapping study[J]. Biochemistry,2006, 45 (10) : 3429 –3436. DOI:10.1021/bi052443r |



