2. 400038 重庆,第三军医大学:基础医学部细胞生物学教研室
2. Department of Cell Biology, College of Basic Medical Sciences, Third Military Medical University, Chongqing, 400038, China
生物体无时无刻不在经受外源性或者内源性DNA损伤的威胁。外源性因素包括紫外线、电离辐射、基因毒性的化合物(eg化疗药物)等;内源性的代谢副产物如活性氧族可以造成DNA结构的改变。如果DNA损伤被修复,细胞将恢复正常功能;若未被修复,慢性DNA损伤就会触发特殊的细胞反应,如凋亡或衰老等。新近研究表明,DNA损伤还可诱导自噬的发生,而且自噬在DNA损伤应答过程中发挥重要作用[1-2]。针对不同损伤,DNA的修复机制不尽相同,其中修复损伤类型最为广泛的是核苷酸切除修复(nucleotide excision repair,NER),它在细胞维持自身遗传稳定性中发挥最为重要的作用[3]。着色性干皮病C组基因(xeroderma pigmentosum group C,XPC)是该途径最早的损伤识别蛋白,也是主要的限速蛋白,在DNA损伤应答中起信号作用。研究显示其表达的缺失往往导致损伤DNA不能正常修复,以致突变积累甚至肿瘤的发生[4]。本课题组前期研究发现,XPC分子在膀胱癌中低表达高频发生;亦有报道显示XPC不仅参与经典的NER修复,其在碱基切除修复、双链损伤修复、染色质重塑、周期调控及细胞活力维持等方面也发挥一定的功能。DNA损伤既可触发DNA的损伤修复过程,又会诱导自噬的发生,其中自噬在DNA损伤应答中又发挥重要作用。但是,自噬与DNA损伤应答两者具体如何相互作用尚不清楚。本研究关注的XPC分子作为NER途径最早的损伤识别蛋白,在DNA损伤修复中发挥重要作用,但其是否参与自噬尚不清楚。本研究利用XPC沉默的细胞模型,通过氯喹抑制自噬小体的降解以更好地分析其积累情况[5-7],探讨XPC蛋白缺失对膀胱癌细胞自噬的影响。同时观察化疗药物顺铂处理下p-ATM(S1981)活性的改变及细胞的凋亡情况,初步探讨XPC蛋白缺失影响膀胱癌细胞自噬的分子机制。
1 材料与方法 1.1 主要材料人膀胱癌T24细胞,第三军医大学基础医学部细胞生物学教研室保存。顺铂、GAPDH抗体、DMSO购自Sigma公司,胰酶、RPMI1640培养基、胎牛血清购自美国HyClone公司,cleaved PARP(9546S)、LC3Ⅱ(3868S)抗体购自Cell Signaling公司,XPC(ab6264)、p-ATM(ab81292)抗体购自美国Abcam 公司,抗荧光淬灭剂、Tubulin 抗体、DAPI染色液、青链霉素溶液及细胞裂解液购自江苏碧云天生物技术公司,羊抗小鼠IgG/HRP、羊抗兔IgG/HRP购自北京中杉金桥公司,Cell Counting Kit-8购自Dojindo公司,封闭脱脂奶粉、4%多聚甲醛购自武汉博士德公司,DC Protein Assay 蛋白浓度测定试剂盒购自美国Bio-Rad公司,牛血清 白蛋白购自USB公司,蛋白酶抑制剂购自Roche公司,细胞培养板购自美国Thermo公司,PVDF膜购自Millipore公司,阳离子脂质体购自于美国Invitrogen公司。
1.2 方法 1.2.1 细胞培养采用含有10%胎牛血清的RPMI1640 培养基,于37 ℃、5% CO2环境下培养,待细胞进入对数生长期,接种于细胞培养板中。
1.2.2 稳定抑制XPC模型的建立依据本课题组前期制定的实验方法[8],利用shRNA策略,将处于对数生长期的T24细胞接种于48孔板,分为对照组T24NC细胞、干扰组T24shXPC细胞,病毒感染48 h后换液,采用荧光显微镜观察感染效果并倍比稀释至单细胞,待其增殖至200个细胞的克隆时,挑选荧光较强的克隆扩大培养并验证干扰效果。
1.2.3 细胞总蛋白的提取及Western blot检测顺铂(cisplatin,CIS)30 μmol/L、氯喹(chloroquine,CQ)20 μmol/L 及二者合用处理T24NC、T24shXPC两组细胞,使用胰酶消化后加培养基吹打,转移至离心管中离心,将沉淀用PBS洗涤后再次离心,弃去PBS而在沉 淀中加入RIPA裂解液,冰上裂解15 min后离心8 min ,4 ℃、14 800 r/min,底端粘稠沉淀物为DNA,上清为所需蛋白。蛋白浓度的测定采用DC Protein Assay法,将浓度标化后进行电泳。我们将总蛋白设定为20 μg,使用聚丙烯酰胺凝胶电泳将蛋白质进行分离,随后采用湿转法转至PVDF膜上。室温条件下将膜置于1% BSA或5%牛奶中,于翻滚摇床中封闭2 h,然后置于稀释倍数为1 ∶1 000的一抗中,4 ℃孵育过夜。使用PBST洗膜3次,共30 min,其中Tween20浓度为0.1%。于室温条件下置于稀释倍数为1 ∶10 000的二抗中孵育2 h,再次使用PBST洗涤3次,显影时采用化学发光底物法用X线片曝光。
1.2.4 质粒转染及荧光显微镜的观察将绿色荧光蛋白和微管相关蛋白1轻链3融合蛋白质粒(green fluorescent protein and microtubule associated protein 1 light chain 3 fusion vector,GFP-LC3,第三军医大学基础医学部生物化学与分子生物学教研室馈赠)与Lipofectamine 2000转染试剂分别加入无血清1640培养基中,室温静置5 min,混合后室温静置20 min。将此混合好的试剂与无血清1640加入密度为80%的T24NC、T24shXPC两组细胞中,转染4 h后换液,换成含血清培养基继续培养。培养48 h后,将T24NC、T24shXPC两组细胞接种至有盖玻片的6孔板中,培养24 h。分别在培养基中加入氯喹及顺铂加氯喹混合液,使氯喹终浓度为20 μmol/L,混合液终浓度为顺铂30 μmol/L、氯喹20 μmol/L,处理2 h。用4%的多聚甲醛溶液固定15 min,使用PBS清洗2遍,用DAPI染色,避光3 min,然后加入PBS,避光5 min。弃液后再次加入PBS,避光5 min,使用10 μL抗荧光淬灭剂封片,使用荧光显微镜观察GFP-LC3荧光聚集情况。
1.2.5 CCK-8 法检测药物对细胞增殖的影响取对数生长期的T24NC、T24shXPC两组细胞以每孔5 000个分别接种于96孔板。培养至完全贴壁后加药处理,设空白(DMSO)、顺铂30 μmol/L两种处理方式,设3个复孔,4 h后换液。待空白组细胞长满,将培养基更换为检测液,10 μL CCK-8+90 μL培养基,于温度为37 ℃、CO2浓度为5%的培养箱内孵育1~2 h,分光光度计测定光密度值,波长为450 nm,观察不同药物处理对T24NC、T24shXPC组细胞增殖的影响。
1.3 统计学方法数据以x±s表示,采用SPSS 13.0统计软件进行独立样本t检验。
2 结果 2.1 细胞模型的建立Western blot检测膀胱癌T24细胞XPC的干扰效果,显示干扰效果较好。见图 1。

|
| 1:病毒感染对照组T24NC;2:病毒感染组T24shXPC 图 1 Western blot检测病毒干扰T24细胞后两组XPC的表达 |
2.2 XPC蛋白缺失,膀胱癌T24细胞自噬小体的形成减少
单独使用氯喹处理,T24shXPC组细胞LC3Ⅱ的丰度低于T24NC组细胞(图 2),T24shXPC组细胞中GFP-LC3荧光明显聚集的细胞数(1.53±0.81)%显著少于T24NC组细胞(3.30±0.70)%(P<0.05),说明XPC缺失后细胞自噬小体的形成明显减少(图 3);氯喹及顺铂双重处理后,T24shXPC组细胞LC3Ⅱ的丰度低于T24NC组细胞(图 2),T24shXPC组细胞中GFP-LC3荧光明显聚集的细胞数(2.19±0.37)%显著少于T24NC组细胞(3.20±0.29)% (P<0.05),说明在化疗药物顺铂的作用下,XPC缺失后自噬小体的形成明显减少(图 3,图 4),但T24shXPC组细胞LC3Ⅱ的丰度要高于单独氯喹处理的T24shXPC组细胞(图 2),提示顺铂促进XPC缺失后的膀胱癌T24细胞自噬。
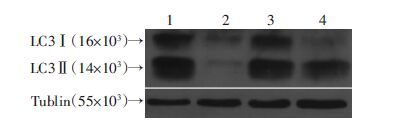
|
| 1:氯喹处理T24NC组;2:氯喹处理T24shXPC组;3:氯喹加顺铂处理T24NC组;4:氯喹加顺铂处理T24shXPC组 图 2 氯喹、氯喹加顺铂分别处理T24NC、T24shXPC两组细胞 2 h后LC3Ⅱ的积累情况 |
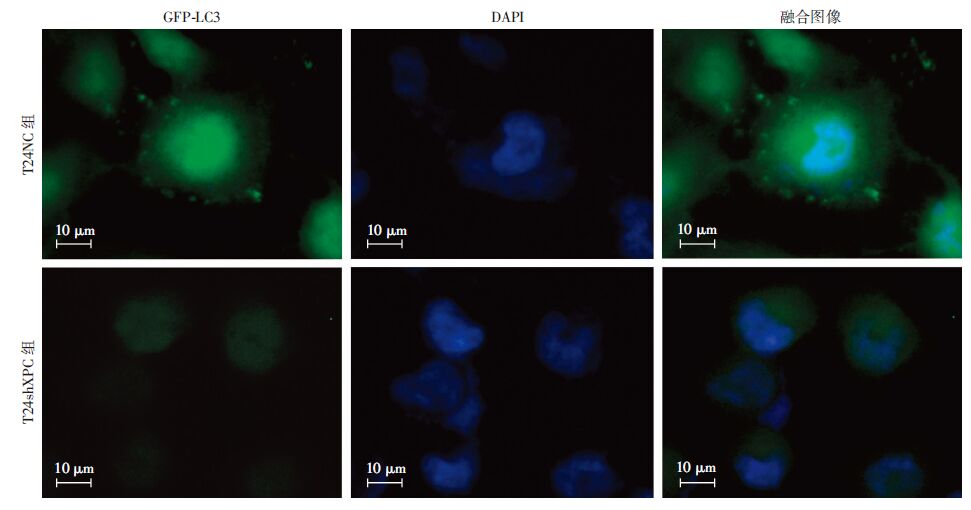
|
| 图 3 氯喹处理T24NC、T24shXPC两组细胞2 h后GFP-LC3的荧光聚集观察 |
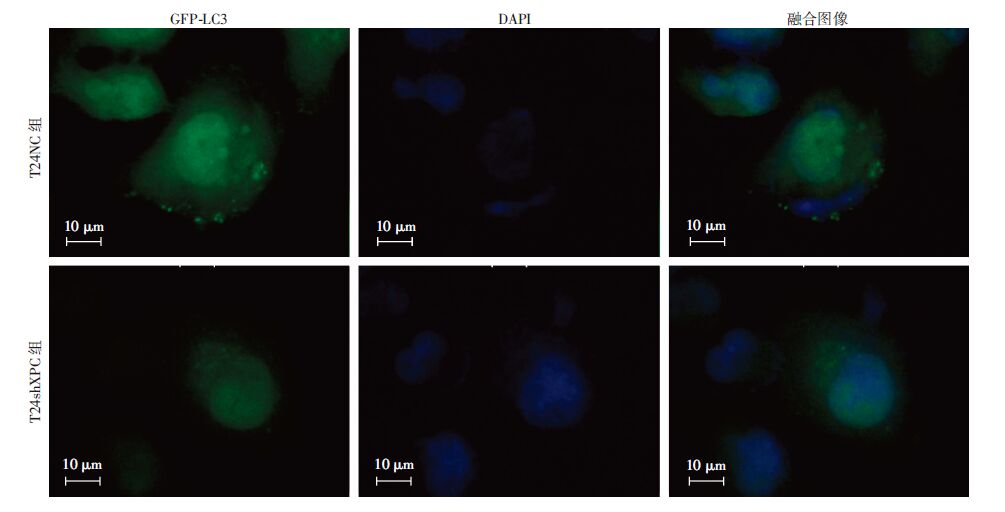
|
| 图 4 氯喹加顺铂处理T24NC、T24shXPC两组细胞2 h后GFP-LC3的荧光聚集观察 |
2.3 XPC蛋白缺失,膀胱癌T24细胞对顺铂的敏感性降低
检测p-ATM(S1981)活性的改变及细胞的凋亡情况,以进一步探讨XPC调控DNA损伤诱导自噬的相关分子机制。在顺铂诱导下,T24shXPC组细胞p-ATM的表达高于T24NC组细胞,而表征凋亡的蛋白Cleaved-PARP表达低于T24NC组细胞(图 5)。使用 顺铂处理细胞,T24shXPC组细胞相对细胞活力(37.46± 2.35)%明显高于T24NC组[(21.25±0.40)%,P<0.05],由此可见,XPC蛋白缺失,膀胱癌T24细胞对顺铂敏感性的降低是由于细胞凋亡的减少。

|
| 1:DMSO处理T24NC组;2:DMSO处理T24shXPC组;3:顺铂处理T24NC组;4:顺铂处理T24shXPC组 图 5 Western blot检测各处理组T24细胞p-ATM及Cleaved-PARP的表达 |
3 讨论
自噬包括两个过程:自噬触发引起自噬小体的形成,以及后续自噬小体对内容物及自身的降解。某个时间点LC3Ⅱ的丰度并不能反映自噬潮的高低,高水平的自噬可以促进自噬小体的形成使LC3Ⅱ的丰度增加,也可加速自噬小体的降解使LC3Ⅱ的丰度降低。甚至同一细胞系,分别在完全相同的环境下培养,其LC3Ⅱ的丰度都会出现很大的差异[5, 7],因此我们摒弃了对某个时间点LC3Ⅱ丰度的观察。我们采用氯喹阻断了自噬小体的降解,通过观察LC3Ⅱ的积累情况来衡量整个前期过程自噬的强弱:自噬强则LC3Ⅱ积累多,弱则相反。本研究分析XPC分子在自噬中的作用,发现XPC缺失后,膀胱癌T24细胞LC3Ⅱ的丰度、GFP-LC3的荧光聚集程度都降低,即自噬小体的形成减少;即使使用化疗药物顺铂处理细胞,XPC缺失后自噬小体的形成依然减少,其中T24shXPC细胞自噬相比于未加顺铂组有所增加,说明顺铂促进了T24shXPC细胞的自噬。
目前,肿瘤细胞对放射治疗的耐受及对化疗药物的耐药被认为与自噬及DNA损伤应答机制关系最为密切。越来越多的证据表明,与正常细胞相比,肿瘤细胞的基础自噬及应激下自噬都有所提高。新近研究显示,肿瘤细胞中自噬与DNA损伤应答存在功能上的互补,从而导致肿瘤细胞对放疗的耐受及对化疗药物的耐药[9]。但是,自噬及DNA损伤应答两者具体如何相互作用尚不清楚。本研究关注的ATM自身磷酸化是DNA损伤应答早期的关键事件[10]。其主要参与双链损伤并通过磷酸化下游分子进而激活周期阻滞、转录调控及相应的DNA修复途径。本实验中XPC蛋白缺失后,p-ATM表达增加,提示XPC可能参与对p-ATM调控。研究[11]发现,在HeLa细胞中,ATM可以通过MAPK14通路、mTOR通路及Beclin/PI3KⅢ复合体促进电离辐射诱导的自噬。Alexander等[12]研究发现,在活性氧的刺激下,ATM通过促进TSC2肿瘤抑制器来抑制mTORC1并诱导自噬发生。据此,我们推断,XPC可能通过p-ATM参与调控细胞的自噬。
由于化疗药物或放疗能诱发肿瘤细胞内自噬的变化,因此自噬调节成为肿瘤治疗一个新的研究热点。Galan-Acosta等[13]研究发现,过度激活伴侣介导自噬可造成代谢的紊乱,从而促进肿瘤细胞的死亡。同样,PTEN缺失诱导的自噬增强可导致乳腺癌细胞对抗肿瘤药物曲妥珠单抗的耐药[14]。Zhang等[15]研究发现,胃癌细胞可通过自噬对抗化疗药物,抑制自噬可促进顺铂诱导的凋亡。自噬对子宫内膜肿瘤的生长及耐药都发挥重要作用,使用氯喹抑制自噬可减少其对顺铂的耐药[16]。Zhao等[17]研究证实对待顺铂耐药的胃癌细胞,可以通过miR-181a抑制自噬从而逆转其对顺铂的耐药。本研究中,XPC被干扰后,顺铂诱导膀胱癌细胞的自噬增加幅度明显降低,同时细胞对顺铂的耐药明显增加,提示自噬在膀胱癌细胞对顺铂的耐药方面发挥了重要作用。在今后对膀胱癌的临床治疗中,可依据其自噬特点设计新的联合化疗方案,将自噬调节药物和化疗药物联合使用,可能成为治疗膀胱癌的一种新手段。
| [1] | Czarny P, Pawlowska E, Bialkowska-Warzecha J, et al. Autophagy in DNA damage response[J]. Int J Mol Sci,2015, 16 (2) : 2641 –2662. DOI:10.3390/ijms16022641 |
| [2] | Qiang L, Zhao B, Shah P, et al. Autophagy positively regulates DNA damage recognition by nucleotide excision repair[J]. Autophagy,2016, 12 (2) : 357 –368. DOI:10.1080/15548627.2015.1110667 |
| [3] | Spivak G. Nucleotide excision repair in humans[J]. DNA Repair (Amst),2015, 36 : 13 –18. DOI:10.1016/j.dnarep.2015.09.003 |
| [4] | Nemzow L, Lubin A, Zhang L, et al. XPC: Going where no DNA damage sensor has gone before[J]. DNA Repair (Amst),2015, 36 : 19 –27. DOI:10.1016/j.dnarep.2015.09.004 |
| [5] | Maycotte P, Aryal S, Cummings C T, et al. Chloroquine sensitizes breast cancer cells to chemotherapy independent of autophagy[J]. Autophagy,2014, 8 (2) : 200 –212. DOI:10.4161/auto.8.2.18554 |
| [6] | Klionsky D J, Abdalla F C, Abeliovich H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy,2012, 8 (4) : 445 –544. DOI:10.4161/auto.19496 |
| [7] | Mizushima N, Yoshimori T. How to interpret LC3 immunoblotting[J]. Autophagy,2007, 3 (6) : 542 –545. DOI:10.4161/auto.4600 |
| [8] | 王欢欢, 黄亚琴, 余瑾, 等. XPC蛋白促进膀胱癌细胞DNA损伤修复的作用[J]. 第三军医大学学报,2014, 36 (9) : 856 –859. |
| [9] | Lan Y Y, Londono D, Bouley R, et al. Dnase2a deficiency uncovers lysosomal clearance of damaged nuclear DNA via autophagy[J]. Cell Rep,2014, 9 (1) : 180 –192. DOI:10.1016/j.celrep.2014.08.074 |
| [10] | Xu Y, Xu C, Price B D. Mechanistic links between ATM and histone methylation codes during DNA repair[J]. Prog Mol Biol Transl Sci,2012, 110 : 263 –288. DOI:10.1016/B978-0-12-387665-2.00010-9 |
| [11] | Liang N, Jia L, Liu Y, et al. ATM pathway is essential for ionizing radiation-induced autophagy[J]. Cell Signal,2013, 25 (12) : 2530 –2539. DOI:10.1016/j.cellsig.2013.08.010 |
| [12] | Alexander A, Cai S L, Kim J, et al. ATM signals to TSC2 in the cytoplasm to regulate mTORC1 in response to ROS[J]. Proc Natl Acad Sci U S A,2010, 107 (9) : 4153 –4158. DOI:10.1073/pnas.0913860107 |
| [13] | Galan-Acosta L, Xia H, Yuan J, et al. Activation of chaperone-mediated autophagy as a potential anticancer therapy[J]. Autophagy,2015, 11 (12) : 2370 –2371. DOI:10.1080/15548627.2015.1106666 |
| [14] | Ning L, Guo-Chun Z, Sheng-Li A, et al. Inhibition of autophagy induced by PTEN loss promotes intrinsic breast cancer resistance to trastuzumab therapy[J]. Tumour Biol,2016, 37 (4) : 5445 –5454. DOI:10.1007/s13277-015-4392-0 |
| [15] | Zhang H Q, He B, Fang N, et al. Autophagy inhibition sensitizes cisplatin cytotoxicity in human gastric cancer cell line SGC7901[J]. Asian Pac J Cancer Prev,2013, 14 (8) : 4685 –4688. DOI:10.7314/APJCP.2013.14.8.4685 |
| [16] | Fukuda T, Oda K, Wada-Hiraike O, et al. The anti-malarial chloroquine suppresses proliferation and overcomes cisplatin resistance of endometrial cancer cells via autophagy inhibition[J]. Gynecol Oncol,2015, 137 (3) : 538 –545. DOI:10.1016/j.ygyno.2015.03.053 |
| [17] | Zhao J, Nie Y, Wang H, et al. miR-181a suppresses autophagy and sensitizes gastric cancer cells to cisplatin[J]. Gene,2016, 576 . DOI:10.1016/j.gene.2015.11.013 |



