噬血细胞性淋巴组织细胞增多症(hemophagocytic lymphohistocytosis,HLH)又称为噬血细胞综合征(hemophagocytic syndrome,HPS), 常伴有多脏器功能受损, 其病情进展迅猛, 病死率高[1]。HLH分基因缺陷所导致的原发性HLH及继发于感染、肿瘤、自身免疫性疾病等的继发性HLH[2],两种类型的HLH均伴有肝脏受损[3],而目前的治疗方案并不能及时、有效地解决肝脏受损的情况,爆发性的肝衰甚至会使得患者失去治疗机会。间充质干细胞(mesenchymal stem cells,MSCs)是一类具有低免疫原性及多向分化能力的多能干细胞,其无异体排斥反应、趋化迁移及组织修复的特点使其被广泛应用于各种抗炎症损伤及组织损伤等领域中,如移植物抗宿主病(graft versus host disease,GVHD)[4]。本课题组前期利用IFN-γ联合CPG-ODN1826成功建立了类HLH小鼠模型,小鼠出现了以肝脾为主的多脏器的受损[5]。本实验将模型稍加改良后作为疾病的研究载体评估人脐带间充质干细胞对肝脏损伤的修复作用,并对其相关机制进行初步探讨。
1 材料与方法 1.1 动物及材料C57BL/6雄性小鼠54只,8~10周龄,体质量23~26 g,饲养条件为SPF级,由重庆医科大学实验动物中心提供。全硫代化修饰CPG-ODN1826由上海英骏生物公司合成,序列为5′-TCCATGACGTTCCTGACGTT-3′。小鼠IFN-γ(美国Peprotech公司),人脐带间充质干细胞(重庆医科大学附属儿童医院干细胞中心实验室),DMEM/F12培养基(美国HyClone公司),胎牛血清(美国Gibco公司),CM-Dil染料(美国Invitrogen公司),F4/80抗体、兔抗人白蛋白抗体(美国Abcam公司),大鼠抗小鼠二步法免疫组化二抗(北京中杉金桥生物有限公司),胰酶、FITC荧光二抗、DAPI染料(上海碧云天生物技术有限公司)。本研究所用肝脏标本已获得患者知情同意。
1.2 方法 1.2.1 hUC-MSCs的体外标记hUC-MSCs长满90%左右,细胞状态良好,用4 mg/L的CM-Dil液重悬细胞,37 ℃孵育30 min染色,PBS液洗2遍后以PBS液重悬细胞,计数。
1.2.2 类HLH小鼠模型建立及hUC-MSCs移植将54只小鼠按完全随机方法分为3组:CON组、PBS组、MSC组,每组18只。PBS组及MSC组分别于0、2、4、6、8 d腹腔注射250 μg/mL的CPG-ODN1826 200 μL,同期每日颈部皮下注射IFN-γ 4 μg/mL的100 μL 2次,间隔12 h,连续10 d。CON组则与相应时间点注射相应量PBS液。建模成功之后第10天MSC组经尾静脉移植3×106个/L hUC-MSCs悬液200 μL,PBS组及CON组则经尾静脉移植PBS缓冲液200 μL。监测移植治疗后小鼠的精神活动状况及体质量的变化。
1.2.3 血清生化及外周血三系的检测移植后第1、3、7天,各组随机挑选6只小鼠,采用眼球摘除法取外周血取全血及3 500 r/min离心10 min后取血清后送重庆医科大学附属儿童医院临检中心进行谷草转氨酶(AST)、谷丙转氨酶(ALT)、甘油三酯(TG)、白蛋白(ALB)及白细胞(WBC)、血小板(PLT)、红细胞(RBC)、血红蛋白(HGB)的检测。
1.2.4 肝质量体质量比及肝脏病理形态学变化上述时间点小鼠取血后取肝脏称质量,并取1 cm×1 cm×0.5 cm大小的组织块,以4%多聚甲醛固定48 h,梯度乙醇脱水后石蜡包埋,制备石蜡切片,苏木精-伊红染色在光学显微镜下观察。
1.2.5 各组肝脏内活化巨噬细胞情况石蜡切片制作同上,免疫组化染色方法参考说明书。免疫组织化学染色结果判读:每张玻片在高倍镜(×400)下随机选取5个视野观察染色强度并计算阳性细胞百分率。染色强度评分:无染色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分率评分: < 5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。两者分数相加: < 2分为不表达(-), 2~3分为低表达(+),4~5分为中度表达(+ +),6~7分为高表达(+ + +)。
1.2.6 CM-Dil标记的hUC-MSCs移植后肝脏内示踪上述时间点小鼠采血后取MSC组小鼠肝脏组织,大小约1 cm×1 cm×0.5 cm,立即进行OCT包埋,用冰冻恒温切片机切片,厚度8 μm,4%多聚甲醛固定30 min,0.3% Triton X-100打孔20 min,3 μg/mL DAPI液染核后抗荧光淬灭剂封片,在荧光显微镜下观察。
1.2.7 免疫荧光法检测肝内定植hUC-MSCs取移植后第7天MSC组(细胞移植组)小鼠肝脏组织,并以人正常肝脏组织作为阳性对照组,按上述方法制作冰冻切片,固定后0.3% Triton X-100打孔20 min,BSA封闭30 min,人白蛋白抗体4 ℃孵育过夜,FITC荧光二抗(1 ∶200)常温孵育1 h,3 μg/mL DAPI染色剂染核,抗荧光淬灭剂封片,在荧光显微镜下观察。
1.3 统计学处理采用SPSS 19.0统计软件进行分析,数据以x±s表示,方差齐时,采用单因素方差分析;方差不齐时,采用Kruskal-Wallis检验。α=0.05为检验水准。
2 结果 2.1 hUC-MSCs体外标记CM-Dil染色后绿色荧光激发,发现细胞红染,标记率可达95%以上(图 1)。
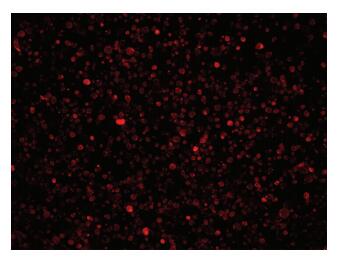
|
| 图 1 荧光显微镜下观察CM-Dil体外标记的hUC-MSCs (×100) |
2.2 各组小鼠的一般情况及体质量
造模后小鼠状态萎靡,攀爬笼数减少,细胞移植后MSC组较PBS组小鼠状态好转,活动增加,而各组小鼠体质量并未有较大改变。
2.3 细胞移植后血生化、外周血三系的变化细胞移植后第1、3天,MSC组及PBS组ALT、AST均高于CON组(P < 0.05);与PBS组相比,MSC组明显降低(P < 0.05);移植后第7天,与CON组相比,MSC组ALT、AST基本恢复正常(P>0.05),但PBS组尚未恢复正常(P < 0.05,表 1)。细胞移植后第1天,MSC组及PBS组TG高于CON组(P < 0.05),与PBS组相比,MSC组TG明显降低(P < 0.05);移植后第3天,MSC组TG基本恢复正常(P>0.05),但PBS组尚未恢复正常(P < 0.05);移植后第7天,MSC组及PBS组均恢复正常(P>0.05);细胞移植后第1、3、7天,MSC组及PBS组血清中ALB均未恢复正常(P>0.05,表 1)。
| 组别 | ALT(U/L) | AST(U/L) | ALT(U/L) | AST(U/L) | |||||||||||
| 1 d | 3 d | 7 d | 1 d | 3 d | 7 d | 1 d | 3 d | 7 d | 1 d | 3 d | 7 d | ||||
| CON组 | 47.10±3.85 | 47.11±3.88 | 46.60±4.13 | 135.22±23.10 | 132.61±15.93 | 126.50±16.62 | 0.68±0.12b | 0.67±0.08b | 0.68±0.14 | 31.12±1.85b | 32.03±2.03b | 30.57±1.86b | |||
| MSC组 | 332.80±57.63ab | 237.65±111.63ab | 48.40±6.20b | 389.18±169.71ab | 223.90±65.11ab | 121.45±25.48b | 1.19±0.31ab | 0.83±0.27b | 0.64±0.08 | 25.68±2.59a | 26.12±1.70a | 27.47±2.08a | |||
| PBS组 | 487.16±59.84a | 429.42±113.64a | 143.46±63.71a | 526.65±68.21a | 470.25±69.07a | 162.12±35.74a | 1.31±0.30a | 1.15±0.25a | 0.72±0.21 | 25.58±0.67a | 25.63±1.39a | 27.52±1.07a | |||
| a: P < 0.05,与CON组比较;b: P < 0.05,与PBS组比较 | |||||||||||||||
细胞移植后第1天,MSC组及PBS组WBC、PLT、 RBC、HGB均低于CON组(P < 0.05),且两组之间各指标差异无统计学意义(P>0.05);细胞移植后第3天,与PBS组相比,MSC组三系水平均恢复较快,除WBC外,各指标差异均具有统计学意义(P < 0.05);细胞移植后第7天,除PLT尚未恢复正常外(P < 0.05),MSC组WBC、RBC、HGB均恢复正常(P>0.05),而PBS组各指标均未恢复正常(P < 0.05,表 2)。
| 组别 | WBC(×109/L) | PLT(×109/L) | RBC(×1012/L) | HGB(g/L) | |||||||||||
| 1 d | 3 d | 7 d | 1 d | 3 d | 7 d | 1 d | 3 d | 7 d | 1 d | 3 d | 7 d | ||||
| CON组 | 8.44±1.08b | 8.55±1.10b | 8.73±1.12b | 1 250.67±119.74b | 1 247.00±137.08b | 1 260.67±251.54b | 9.95±0.44b | 9.93±0.48b | 9.85±0.49b | 144.50±7.29b | 144.00±8.60b | 144.33±9.79b | |||
| MSC组 | 4.50±1.14a | 5.87±1.69a | 6.97±1.85 | 598.00±85.99a | 785.17±164.16ab | 962.50±168.89ab | 7.70±1.15a | 8.61±0.75ab | 9.28±0.76 | 106.83±17.50a | 124.00±11.66ab | 137.50±5.79 | |||
| PBS组 | 4.46±0.56a | 4.74±0.10a | 5.47±1.65a | 546.33±85.48a | 606.50±89.11a | 749.17±147.60a | 7.45±0.43a | 7.76±0.62a | 9.02±0.71a | 101.17±8.42a | 110.67±5.85a | 127.50±7.15a | |||
| a: P < 0.05,与CON组比较;b: P < 0.05,与PBS组比较 | |||||||||||||||
2.4 细胞移植后各组小鼠肝脏大小及病理学改变
细胞移植后第7天,与CON组的(4.92±0.37)%相比,MSC组(5.77±0.28)%及PBS组(6.39±0.46)%小鼠肝质量体质量比均显著升高(P < 0.05);与PBS组相比,MSC组肝质量体质量比明显降低(P < 0.05),说明hUC-MSCs可以明显改善类HLH小鼠的肝脏肿大。
HE染色结果显示各时间点CON组小鼠肝小叶结构正常,细胞染色清晰,肝细胞组成的肝板呈放射状,未见肝细胞变性坏死。细胞移植后第1天,PBS组小鼠肝组织中可见肝细胞浊肿,胞浆疏松,部分肝窦扩张充血,散在淋巴细胞浸润,可见炎症细胞聚集灶,而MSC组小鼠肝脏组织的上述病变均有所改善;移植后第3天PBS组小鼠肝脏较第1天均已好转,但仍见炎症细胞浸润,胞浆疏松等改变,而MSC组小鼠肝脏组织结构大致恢复正常, 散在炎症细胞浸润。移植后第7天PBS组尚可见血管周围炎症浸润, 说明尾静脉移植hUC-MSCs可以减少肝脏中的炎症反应,修复肝脏结构损伤(图 2)。
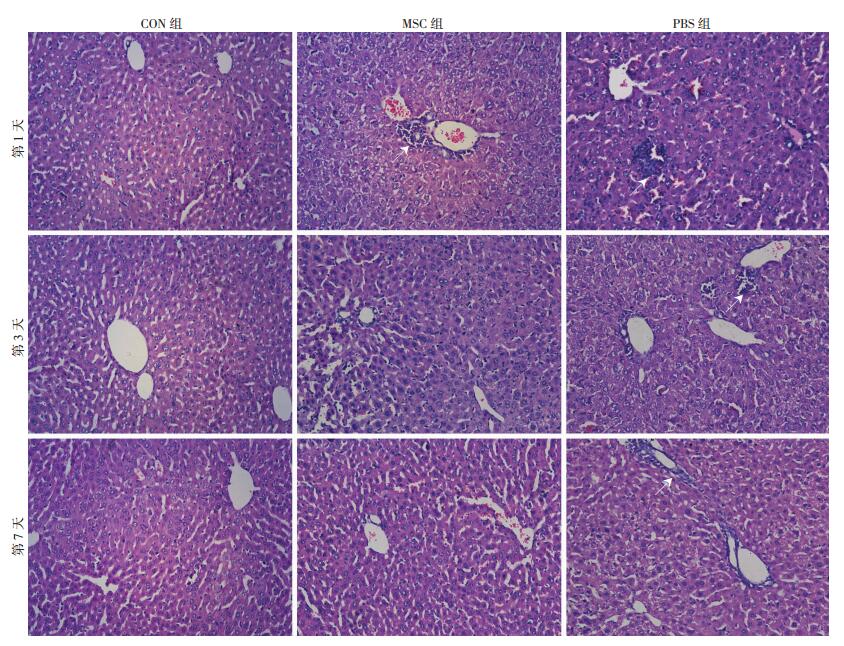
|
| ↑:示肝脏内炎症浸润灶 图 2 各组小鼠细胞移植后肝脏组织病理形态变化 (HE ×200) |
2.5 细胞移植后各组小鼠肝组织中巨噬细胞活化水平
细胞移植后第7天,根据1.2.5的评分标准,免疫组化染色观察结果显示,CON组为不表达(-), MSC组为低表达(+),PBS组为中度表达(+ +)。染色强度评分及阳性细胞百分率评分综合统计结果显示MSC组(2.47±0.27)分,PBS组(4.43±0.53)分,均高于CON组(1.43±0.29)分(P < 0.05);与PBS组相比,MSC组活化巨噬细胞的数量及染色程度明显降低(P < 0.05,图 3)。

|
| A: CON组;B: MSC组;C: PBS组 图 3 各组小鼠细胞移植后第7天肝脏中F4/80阳性细胞的表达情况 (二步法×200) |
2.6 hUC-MSCs在肝组织的定植及表达人白蛋白情况
细胞移植后第1、3、7天,取各组小鼠肝脏组织行冰冻切片,荧光显微镜下可发现第1天CM-Dil的hUC-MSCs主要在肝脏大血管周围定植,第3天受损的肝小叶中均可看到CM-Dil标记的hUC-MSCs定植,第7天肝小叶中仍可见CM-Dil标记的hUC-MSCs定植,但荧光信号较前减少,而CON组及PBS组均未发现CM-Dil的hUC-MSCs定植(图 4)。免疫荧光结果显示细胞移植后第7天肝脏中定植的hUC-MSCs未见人白蛋白的表达(图 5)。
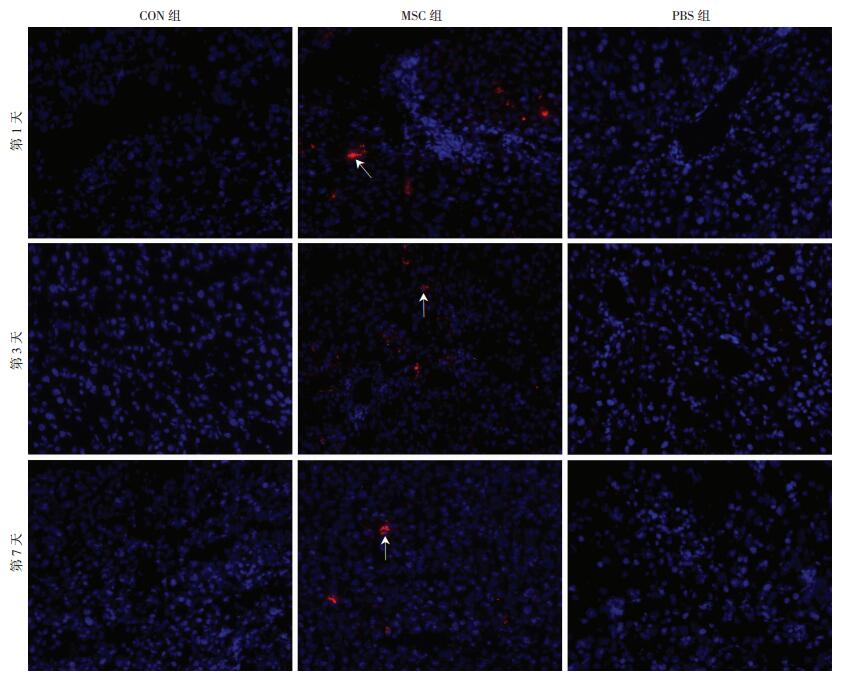
|
| ↑:示肝脏内定植的hUC-MSCs 图 4 荧光显微镜下观察CM-Dil标记的hUC-MSCs移植后肝脏组织内的定植情况 (×200) |
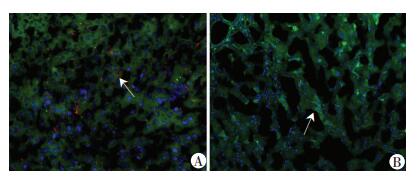
|
| A:细胞移植组;B:阳性对照组↑:示人白蛋白 图 5 免疫荧光观察细胞移植后第7天肝脏中定植hUC-MSCs人白蛋白的表达情况 (×200) |
3 讨论
HLH是一种由多种病因引起的单核巨噬细胞系统过度反应性疾病,其主要特点为自身免疫功能紊乱,T细胞与巨噬细胞过度活化,最终引起多脏器功能受损。前期本课题组肖莉等[6]分析217例HLH患儿临床及实验室检查特点时,发现患儿肝脏受损尤为突出,严重的肝功能损害甚至会导致患儿死亡。现阶段HLH的治疗主要采用化学、免疫抑制治疗及造血干细胞移植治疗[7], 但是化疗方案中采用的依托泊苷及环孢素均具有肝脏毒性,使得肝脏受到二次打击,而造血干细胞移植在一些暴发型肝脏受损的患者中并不能及时发挥作用,以急性肝衰为首要表现的HLH患儿由于免疫系统的亢进使得肝脏移植成为禁忌[8-9]。因此寻求新的治疗方法成为必要。近年来,国内外学者陆续报道了关于MSCs在肝脏疾病中的应用,证实了其在改善肝纤维化、脂肪肝、急性肝损伤等非免疫性肝病及自身免疫性肝病中的积极作用。目前人脐带间充质干细胞治疗HLH中肝脏损伤的研究尚少见报道。
本研究发现细胞移植后第1天便可观察到ALT、AST及TG的显著缓解。郑盛等[10]采用hUC-MSCs治疗CCl4导致的急性肝衰后也发现细胞移植后第1天肝酶明显下降,提示hUC-MSCs具有快速的肝脏损伤修复作用,可能与其免疫调节有关。本研究发现血清中ALB恢复较慢,提示其合成功能的恢复尚需时间, 与临床治疗经验相符。虽然本研究在前期造模的基础上,增加了IFN-γ的给药次数,使得模型更加稳定以及减少给药不规范对治疗评估效果的影响,但是本模型与经典的穿孔素基因敲除的小鼠模型及患者相比,模拟的是高细胞因子血症等造成的各系统损伤,其表现温和,无致死性,且随着给药的停止,小鼠的临床表现随时间推移可恢复正常,故在一定程度上也有助于肝脏相关指标的恢复。下一步,可采用经典的HLH小鼠模型作为载体更好、更全面地评估hUC-MSCs的调节、修复作用。
既往已经在肝脏损伤的动物模型中证实了MSCs的免疫调节功能[11],其可逆转Th1与Th2类细胞的失衡,调控DC细胞、NK细胞的细胞因子分泌谱,引起抗炎症细胞因子增多,进而减少炎症性细胞因子对组织的损害。本研究MSC组小鼠肝脏内炎症浸润灶的消失及肝脏结构的恢复也证实了这一点。同时研究表明hUC-MSCs可调控肝脏内活化的巨噬细胞即Kupffer细胞向抗炎型M2型细胞转化[12],IL-10、IL-4等细胞因子增多,并降低其活化程度,阻止肝内的炎症级联反应继续发展。Higashimoto等[13]采用脂肪来源的MSCs治疗Con-A诱导的肝炎小鼠后发现,肝脏中增多的F4/80阳性细胞数明显下降,与本研究结果一致,证实了巨噬细胞的激活状态在肝脏损伤与修复中具有重要作用。这推测hUC-MSCs在本研究中肝脏恢复作用主要通过调控体内T细胞的转化,减少CD8+T细胞的数量,降低IFN-γ、TNF-α等细胞因子的产生,进而降低巨噬细胞的活化程度,最终保护肝脏及其他脏器的进一步损害。
本实验采用细胞染色剂CM-Dil标记hUC-MSCs进行体内示踪,结果显示细胞移植后第1、3、7天,在受损的肝脏中均可发现CM-Dil标记的hUC-MSCs定植,与陈浩等[14]研究结果一致,说明hUC-MSCs对炎症或受损部位具有强的归巢能力。肝脏损伤时局部释放多种生长因子、趋化粘附因子诱导hUC-MSCs向受损肝脏迁移定植,发挥肝脏修复作用。但随着时间的推移,肝脏组织中定植的hUC-MSCs数量有所减少,可能与细胞分裂增殖后单个细胞荧光减弱以及移植细胞随着肝组织逐渐恢复而迁移出肝脏等因素有关。研究表明植入到受损肝脏中的hUC-MSCs在局部损伤微环境下可以分化为肝样细胞发挥肝脏修复作用,维持肝脏功能[15],而本实验结果显示移植后第7天定植于肝脏中的hUC-MSCs未表达人白蛋白,即hUC-MSCs在移植后第7天并未发生肝样的转化,证实了肝脏损伤的修复作用并非完全依赖于hUC-MSCs的肝样转化。Tsai等[16]发现移植入CCl4导致的小鼠模型中肝脏的hUC-MSCs并未发生肝样转化而是调控细胞因子发挥作用,另有研究采用MSCs的培养液(MSC-CM)治疗D-半乳糖导致的肝衰时,发现MSC-CM可以显著减少细胞死亡、增加肝细胞的再生[17], 证实了MSCs旁分泌在肝脏损伤修复中的作用。另有研究表明只有1%~3%的宿主肝脏接受外来细胞的植入[18],而即便有肝样转化的细胞,其是否具有成熟肝细胞的功能尚需要证实。近年来旁分泌理论的提出,为间充质干细胞治疗肝脏疾病的机制提供新的方向[19]。
总之,在以CPG-ODN1826联合IFN-γ诱导的类HLH小鼠模型为载体的情况下,尾静脉移植CM-Dil标记的hUC-MSCs可在受损肝脏中定植,发挥肝脏修复作用,推测其可能与其免疫调控、旁分泌作用等有关,为临床解决HLH肝脏受损特别是为造血干细胞移植前的爆发性肝脏损伤如何快速解决提供新思路。但MSCs发挥修复作用的具体机制需要进一步研究。
| [1] | Janka G E, Lehmberg K. Hemophagocytic lymphohistiocytosis: pathogenesis and treatment[J]. Hematology Am Soc Hematol Educ Program,2013, 2013 : 605 –611. DOI:10.1182/asheducation-2013.1.605 |
| [2] | Janka G E. Familial and acquired hemophagocytic lymphohistiocytosis[J]. Annu Rev Med,2012, 63 : 233 –246. DOI:10.1146/annurev-med-041610-134208 |
| [3] | Jordan M B, Allen C E, Weitzman S, et al. How I treat hemophagocytic lymphohistiocytosis[J]. Blood,2011, 118 (15) : 4041 –4052. DOI:10.1182/blood-2011-03-278127 |
| [4] | Lu L L, Liu Y J, Yang S G, et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J]. Haematologica,2006, 91 (8) : 1017 –1026. |
| [5] | 张妮, 郑启城, 肖莉, 等. CPG-ODN和IFN-γ联合诱导建立类噬血淋巴组织细胞增生症小鼠模型[J]. 中华血液学杂志,2014, 35 (9) : 835 –839. DOI:10.3760/cma.j.issn.0253-2727.2014.09.011 |
| [6] | 肖莉, 管贤敏, 孟岩, 等. 217例噬血细胞性淋巴组织细胞增生症患儿的临床及实验室检查特点分析[J]. 中华血液学杂志,2014, 35 (7) : 628 –632. DOI:10.3760/cma.j.issn.0253-2727.2014.07.013 |
| [7] | Henter J I, Horne A, Arico M, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer,2007, 48 (2) : 124 –131. DOI:10.1002/pbc.21039 |
| [8] | Soyama A, Eguchi S, Takatsuki M, et al. Hemophagocytic syndrome after liver transplantation: report of two cases[J]. Surg Today,2011, 41 (11) : 1524 –1530. DOI:10.1007/s00595-010-4512-9 |
| [9] | Taniai N, Akimaru K, Kawano Y, et al. Hemophagocytic syndrome after living-donor liver transplantation for fulminant liver failure: a case report[J]. Hepatogastroenterology,2005, 52 (63) : 923 –926. |
| [10] | 郑盛, 殷芳, 肖琼怡, 等. 脐带间充质干细胞移植对急性肝功能衰竭的修复及移植途径的优化[J]. 肝脏,2014, 19 (12) : 918 –923. DOI:10.3969/j.issn.1008-1704.2014.12.006 |
| [11] | Fiore E J, Mazzolini G, Aquino J B. Mesenchymal Stem/Stromal Cells in Liver Fibrosis: Recent Findings, Old/New Caveats and Future Perspectives[J]. Stem Cell Rev,2015, 11 (4) : 586 –597. DOI:10.1007/s12015-015-9585-9 |
| [12] | Ylostalo J H, Bartosh T J, Coble K, et al. Human mesenchymal stem/stromal cells cultured as spheroids are self-activated to produce prostaglandin E2 that directs stimulated macrophages into an anti-inflammatory phenotype[J]. Stem Cells,2012, 30 (10) : 2283 –2296. DOI:10.1002/stem.1191 |
| [13] | Higashimoto M, Sakai Y, Takamura M, et al. Adipose tissue derived stromal stem cell therapy in murine ConA-derived hepatitis is dependent on myeloid-lineage and CD4+ T-cell suppression[J]. Eur J Immunol,2013, 43 (11) : 2956 –2968. DOI:10.1002/eji.201343531 |
| [14] | 陈浩, 尹飞, 孟春阳, 等. 骨髓间充质干细胞移植对严重烧伤大鼠肝损伤的修复作用及其机制[J]. 吉林大学学报:医学版,2014, 40 (2) : 219 –223. DOI:10.13481/j.1671-587x.20140201 |
| [15] | Nonome K, Li X K, Takahara T, et al. Human umbilical cord blood-derived cells differentiate into hepatocyte-like cells in the Fas-mediated liver injury model[J]. Am J Physiol Gastrointest Liver Physiol,2005, 289 (6) : G1091 –G1099. DOI:10.1152/ajpgi.00049.2005 |
| [16] | Tsai P C, Fu T W, Chen Y M, et al. The therapeutic potential of human umbilical mesenchymal stem cells from Wharton's jelly in the treatment of rat liver fibrosis[J]. Liver Transpl,2009, 15 (5) : 484 –495. DOI:10.1002/lt.21715 |
| [17] | van-Poll D, Parekkadan B, Cho C H, et al. Mesenchymal stem cell-derived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo[J]. Hepatology,2008, 47 (5) : 1634 –1643. DOI:10.1002/hep.22236 |
| [18] | Dhawan A, Puppi J, Hughes R D, et al. Human hepatocyte transplantation: current experience and future challenges[J]. Nat Rev Gastroenterol Hepatol,2010, 7 (5) : 288 –298. DOI:10.1038/nrgastro.2010.44 |
| [19] | 崔丽娜, 韩英. 多能干细胞在肝脏损伤和修复过程中的免疫调节作用[J]. 临床肝胆病杂志,2014, 30 (9) : 855 –859. DOI:10.3969/j.issn.1001-5256.2014.09.005 |



